丁酸钠联合Feed促进293F细胞表达PD-1嵌合抗体
2019-04-29黄子逸陈晨彭雪楠申春苹朱一蓓王雪峰张学光
黄子逸,陈晨,彭雪楠,申春苹,朱一蓓,王雪峰,张学光
(1.苏州大学附属第一医院江苏省临床免疫研究所,江苏 苏州215006;2.江苏省临床免疫学重点实验室,江苏 苏州215006;3.江苏省胃肠道肿瘤免疫重点实验室,江苏 苏州215006;4.苏州大学基础医学与生物科学学院生物化学与分子生物学系,江苏 苏州215123;5.苏州大学基础医学与生物科学学院免疫学系,江苏 苏州215123)
最近程序性死亡受体-1(programmed death-1,PD-1)免疫卡控点治疗性抗体带来了前所未有的临床效益[1],但作为临床抗肿瘤药物,PD-1抗体须通过体外无血清培养进行制备,并避免动物来源成分和内毒素污染。在基因工程抗体的生产制备过程中,增加抗体表达可以降低治疗性抗体的生产成本[2]。293F细胞具有较强的蛋白质表达加工能力,因此常用于表达外源重组蛋白[3]。研究表明,添加小分子短链脂肪酸丁酸钠是一种提高真核细胞蛋白产量经济有效的方法[4]。丁酸钠可增加真核细胞中凝血因子、组织纤溶酶原激活物、促红细胞生成素等各种蛋白的表达[5-7],增加程度取决于蛋白产物种类。另有研究表明,丁酸钠可一定程度抑制细胞生长、阻断细胞周期并诱导细胞凋亡[8]。因此,单独使用丁酸钠易致细胞凋亡和改变N-糖基化相关基因表达[9-11],对细胞生长和蛋白产量产生不利影响。
CHO CD Efficient Feed(以下简称Feed)补充剂可为细胞培养提供增强代谢的营养元素,与常规培养条件相比,添加Feed的细胞生长和蛋白产量显著增加。细胞扩增期间,随着营养物质耗尽,积累的细胞代谢物对细胞产生毒性作用,培养环境渗透压升高[12]。Feed可补充细胞增殖过程中培养基所消耗的成分而不额外增加盐离子或未消耗的氨基酸等,充分保护细胞免受自由基和细胞凋亡引起的损伤。
PD-1(CD279)作为免疫卡控点受体分子[13],与肿瘤的发生、发展密切相关。阻断PD-1/PD-L1信号可增强肿瘤和病毒特异性CD8+T细胞的活性,从而增强淋巴细胞对肿瘤和病毒的杀伤能力[14-15]。目前,抗人PD-1单克隆抗体作为肿瘤免疫治疗的有效靶分子已在临床治疗中取得显著成效[16]。基于我们前期自主研制的抗人PD-1嵌合抗体,瞬时转染获得表达抗人PD-1基因工程抗体的293F细胞,本研究旨在用不同浓度的丁酸钠配合Feed处理293F细胞,观察和比较不同培养条件对细胞生长代谢和表达PD-1抗体的影响;并在细胞培养期间检测细胞周期,测定单抗表达量,以达到抗体产量的最大化。
1 材料和方法
1.1 293F细胞传代培养
取1 L不含L-谷氨酰胺的Hyclone SFM4 Transfx-293培养基,加入10 mL L-谷氨酰胺(200 mmol/L)。将细胞用新鲜配制的Hyclone培养基悬浮在三角摇瓶(Thermo Fisher公司)中,于37℃,8%CO2和一定湿度的培养箱进行传代培养。
1.2 293F细胞的培养
在转染前1天将培养基更换成Gibco®Free-StyleTM293表达培养基。传代前细胞计数保持在1.5×106/mL。收集细胞并将细胞悬液转移到离心管中,以600×g常温离心5 min;弃上清液,并用新鲜的FreeStyleTM293培养基重悬。
1.3 转染试剂聚乙烯亚胺(polyethyleneimine,PEI)的制备
称取100 mg PEI溶于95 mL Milli-Q水中,逐滴加入浓HCl直至溶液pH=2.0,磁力搅拌直至PEI溶解;缓慢滴加5 mol/L NaOH溶液将pH调至7.2;继续加Milli-Q水直至PEI终体积为100 mL,0.2 μm膜过滤灭菌。
1.4 丁酸钠溶液的制备
PBS溶解丁酸钠粉剂(Sigma公司),制备1 mol/L的储备溶液,并用0.2μm膜过滤灭菌,-20℃储存。
1.5 瞬时转染293F细胞的培养
取2×106/mL细胞接种于50 mL flask瓶中,分为A,B组,每组分别加入浓度梯度丁酸钠,即0,0.5,1.0,2.0,4.0 mmol/L,分别记为A1~A5,B1~B5;A组细胞培养过程中于第1,3,5天额外添加5%Feed添加剂(美国Gibco公司),B组则不加。每24 h计数细胞并收集一定量的细胞样本检测细胞周期。
1.6 培养过程中293F活细胞密度的测定
根据本实验的检测要求,利用Countsar全自动细胞计数仪,每日取样进行细胞精确计数,获得细胞活率、细胞平均直径、细胞平均圆度等测量结果,观察细胞结团情况。
1.7 抗人PD-1嵌合单抗的表达及定量
本所自行研制分泌抗人PD-1单抗的杂交瘤细胞株,收集细胞提取cDNA;利用特定设计的上、下游引物,PCR克隆该杂交瘤细胞重链可变区和轻链可变区;重、轻链可变区PCR产物与酶切预先处理的线性表达载体连接,转化感受态大肠埃希菌;测序并挑选转化菌,扩大培养后抽提质粒;单抗重链和轻链可变区的表达载体共转染真核细胞株293F细胞;连续培养7 d,4 000×g常温离心30 min;取含有目的抗体的上清液,流式细胞术检测表达单抗与L929/PD-1转基因细胞结合良好,阳性率为95%以上。
收获培养上清液,过Protein A亲和层析柱,用100 mmol/L的甘氮酸(pH=2.6)洗脱;预先加入1 mol/L Tris缓冲液(pH=9)于收集管中,中和洗脱样品;将洗脱的抗体收集至离心管,4 000×g,4℃离心30 min。BCA蛋白定量试剂盒测定纯化抗体浓度并电泳鉴定,根据抗体总量和表达体积计算产量(μg/mL)。
1.8 细胞周期检测
细胞以500×g常温离心5 min;预冷PBS洗2遍;细胞悬液500×g,4℃离心5 min;取细胞沉淀转移至冰上,每管1×106个细胞重悬于PBS;逐滴缓慢加入预冷的无水乙醇至浓度为70%,4℃固定过夜;1 000×g,4℃离心5 min;弃上清液,将细胞重悬于1 mL PBS,500×g,4℃离心10 min;取细胞沉淀,重悬于500μL含50μg/mL的碘化吡啶和100μg/mL的RNA酶(Sigma公司)的PBS中,37℃避光孵育30 min;流式细胞仪检测各组样品的细胞周期。
1.9 流式细胞术鉴定抗人PD-1嵌合抗体
转染后第7天收集培养物,4 000×g,4℃离心20 min;纯化抗体稀释一定倍数后,与L929/PD-1细胞于4℃反应40 min;PBS洗涤2次,加PE标记的羊抗人IgG,Fcγ链特异性反应二抗,4℃反应20 min;PBS洗2遍;细胞重悬于预冷的0.5 mL PBS,流式细胞术鉴定抗人PD-1嵌合抗体的表达水平与效价。
1.10 统计学方法
运用SPSS 20.0软件进行统计分析,计量结果以均数±标准差(±s)表示,对各组数据进行t检验和方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 丁酸钠和Feed影响293F细胞增殖与活细胞密度
A组中未加丁酸钠处理的A1细胞第4天最大活细胞密度为7.66×106/mL,用0.5,1.0,2.0和4.0 mmol/L丁酸钠处理的A2~A5细胞最大活细胞密度分别为5.80×106/mL,5.05×106/mL,5.21×106/mL,4.68×106/mL(图1A)。相应地,B组未处理细胞B1第4天最大活细胞密度为5.38×106/mL,加入浓度梯度丁酸钠的B2~B5细胞最大活细胞密度分别为4.37×106/mL,3.29×106/mL,3.76×106/mL,3.54×106/mL(图1B)。同组内未用丁酸钠处理的293F细胞最高活细胞数明显多于丁酸钠处理过的细胞;两组间相比,添加Feed的A组细胞的增殖数量高于B组。

图1 丁酸钠和CHO CD Efficient Feed对293F活细胞密度的剂量效应
2.2 不同浓度丁酸钠对细胞周期的影响
流式细胞术检测结果显示,丁酸钠增加了G0/G1期细胞数量。未加丁酸钠的A1细胞在第3天和第7天G1期占比为36.836%和34.913%,第3天A2~A5组G1期细胞均在60%左右,直至第7天培养结束,G1期细胞占比略有减少;较高浓度(2.0,4.0 mmol/L)的丁酸钠促使更多数量的细胞位于G1期,减少S期细胞数(图2)。

图2 流式细胞仪检测浓度梯度丁酸钠作用的293F细胞周期
2.3 丁酸钠与Feed联合作用提高293F细胞的抗体产量
尽管用丁酸钠处理后活细胞数量进一步下降,第7天收获抗体检测产量发现,1.0 mmol/L丁酸钠+5% Feed培养的A3组细胞表达的PD-1单抗产量达到最高值57.4 mg/L,明显高于A1、A2组(P均<0.05);进一步提高丁酸钠浓度,抗体产量有所减少,2.0 mmol/L和4.0 mmol/L丁酸钠作用下抗体产量为43.2 mg/L和32.7 mg/L;不加Feed的B组细胞抗体分泌量远低于添加的A组,产量最高的A3组因补充了Feed,抗体表达量较未加Feed的B3组明显增加(t=7.1,P<0.01);其中B1组未加丁酸钠和Feed,最终收获PD-1抗体仅为7.1 mg/L,约是最高产量的1/8。见图3。
2.4 丁酸钠与Feed联合应用对PD-1嵌合抗体识别抗原位点鉴定和抗体效价的影响
取A1~A5培养上清液,经纯化获得的PD-1嵌合抗体均能识别表达于转基因细胞株L929/PD-1表面的PD-1分子;5组抗体稀释一定倍数后,当浓度为0.5μg/mL时,不加丁酸钠的A1组细胞表达的嵌合抗体与L929/PD-1结合的阳性率有所下降,低于其他4组;相同条件下A2~A5组细胞的结合率不变,仍然保持在90%以上(图4)。由此表明,添加丁酸钠对PD-1嵌合抗体的效价有一定的影响。

图3 添加丁酸钠和CHO CD Efficient Feed对293F细胞抗体产量的影响
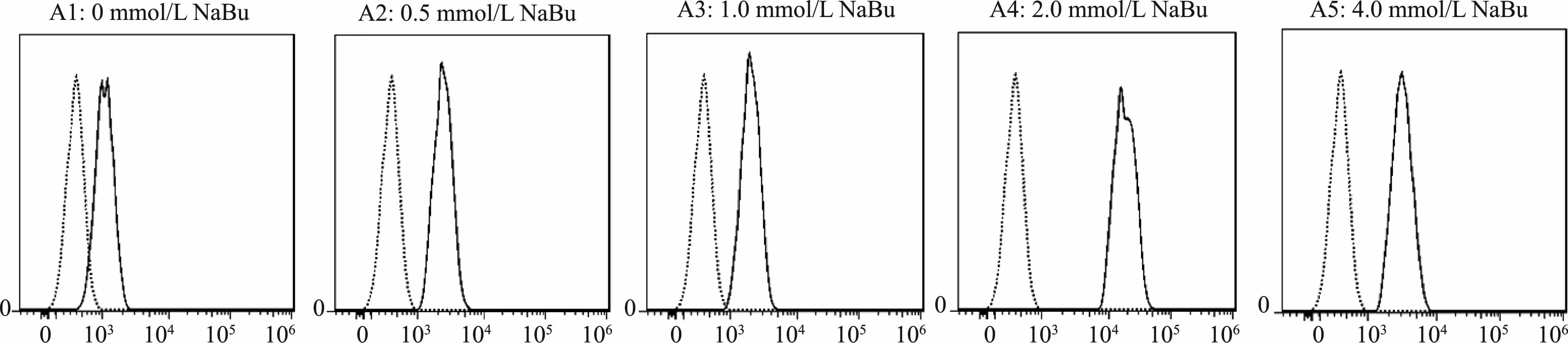
图4 流式细胞术检测PD-1嵌合抗体特异性识别转基因细胞L929/PD-1表面PD-1分子
3 讨论
丁酸钠是一种天然小分子,作用于细胞周期影响细胞生长和分化。研究发现,丁酸钠,尤其是稳定存在于体内的另一种类似物三丁酸甘油酯,是DNA有效合成和细胞增殖的抑制剂[17]。在常规培养条件下,丁酸钠可通过诱导G0/G1期阻滞和细胞凋亡从而抑制细胞生长与增殖[18],其机制在于丁酸钠可调节细胞周期蛋白的表达,如细胞周期蛋白依赖性激酶及其抑制剂,二者都是参与G1期细胞周期调控的重要蛋白[19]。研究证实,丁酸盐下调小鼠成纤维细胞的细胞周期蛋白(cyclin)D1 mRNA和蛋白质的表达;对猪上皮细胞的作用则与cyclin D1相反,丁酸钠增加cyclin D3蛋白的表达水平,随着cyclin D3表达上调,cyclin D1表达降低,该现象与G0/G1期细胞周期阻滞密切相关[20]。上述研究表明,丁酸钠诱导包括肿瘤细胞在内的大多数细胞系的G1期细胞周期阻滞;这种G1期阻滞效应表明,为了通过G1期进入DNA合成S期,细胞需要具备对丁酸钠敏感的相关基因和蛋白质[21]。
本研究结果表明,尽管在常规细胞培养条件下加入丁酸钠,可增加293F细胞PD-1单抗表达量,然而由于丁酸钠对细胞生长和活性有抑制作用,与未处理的细胞相比,所有用丁酸钠处理的活细胞数量均有所下降。因此,为了消除丁酸钠带来的不良反应,在培养过程中使用5%Feed补充培养基消耗;与未处理的细胞相比,抗体收获量至少增加2倍。由此可见,Feed对293F细胞瞬时表达PD-1抗体是必不可少的补充剂,同时随着丁酸钠浓度进一步提高至2.0 mmol/L和4.0 mmol/L,293F细胞增殖受到抑制,PD-1抗体产量开始减少。Feed在无血清培养基的稳定性低于有血清培养基,利用丁酸钠和Feed有利于细胞生长和蛋白产生的优势,因此本研究在培养后第1天添加丁酸钠,第1,3,5天补充Feed,观察二者对抗体表达的联合效应。丁酸钠和Feed联合培养的293F细胞抗体产量高于单独使用丁酸钠或Feed,且最佳浓度为加入1.0 mmol/L丁酸钠和5% Feed,此时抗体产量最高。本研究可能对大规模工业生产治疗性抗体药物具有一定的参考价值。
