shRNA稳定干扰Raptor基因表达的小鼠胸腺上皮细胞系的建立
2019-04-29闵玉娇吴皓杰王荟潘子辉邵启祥
闵玉娇,吴皓杰,王荟,潘子辉,邵启祥
(1.江苏大学医学院免疫学与免疫学检验教研室,江苏 镇江212013;2.江苏大学生殖医学科学研究院,江苏 镇江212001)
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号途径是普遍存在于细胞中的一条重要信号途径,可调节细胞周期进程、细胞增殖和代谢[1-2]。mTOR 激酶分为雷帕霉素敏感的mTORC1和雷帕霉素不敏感的mTORC2。mTOR和mLST8均存在于两种mTOR激酶中,此外mTORC1中还包含Raptor、PRAS40等分子。研究表明,mTORC1在个体、组织和细胞的生长发育和退化中发挥重要作用[3]。mTORC1与T细胞的发育分化关系密切,胸腺上皮细胞(thymic epithelial cells,TECs)作为构成胸腺微环境的重要组分对T细胞的发育有很大影响。本课题组前期研究发现mTORC1可能参与TECs的退化过程(未发表),本研究拟通过构建Raptor shRNA慢病毒载体稳定转染小鼠胸腺上皮细胞系(mouse thymic epithelial cell line 1,mTEC1),敲降Raptor基因,观察mTORC1在TECs中的作用,从而阐明TECs衰老和退化机制。
1 材料与方法
1.1 试剂与材料
慢病毒载体质粒pLKO.1-puro由上海交通大学医学院、上海市免疫学研究所李斌教授惠赠;ps-PAX2及PMD2.0G慢病毒包装质粒为我院龚爱华教授赠予;感受态DH5α细菌由本实验室杜凤移老师馈赠;限制性内切酶AgeⅠ和Eco RⅠ购自宝生物工程(大连)有限公司;胶回收试剂盒以及质粒提取试剂盒为生工生物工程(上海)股份有限公司产品;DMEM培养液、胎牛血清和Lip2000为美国Thermo公司产品;牛血清白蛋白购自湖州英创生物科技有限公司;哺乳动物蛋白抽提试剂RIPA购自上海碧云天生物技术有限公司;蛋白酶抑制剂混合物为瑞士Roche公司产品;抗磷酸化mTOR(phosphomTOR,p-mTOR)、抗mTOR、抗Raptor、抗磷酸化核糖体S6激酶(phospho-p70S6k,p-p70S6k)、抗核糖体S6激酶总蛋白(t-p70S6k)和HRP偶联的羊抗兔IgG抗体均为美国CST公司产品;抗β-肌动蛋白抗体为美国Santa Cruz公司产品;ECL检测试剂盒为德国Merck公司产品。
1.2 细胞培养
1.3 Raptor基因shRNA目的片段的合成
从Sigma网站检索Raptor基因的shRNA序列,并在其5′端和3′端分别加入AgeⅠ和Eco RⅠ限制性核酸酶切位点序列,具体序列如下:正义链,5′-CCGGGCCCGAGTCTGTGAATGTAATCTCGAGATT ACATTCACAGACTCGGGCTTTTTG-3′;反义链,5′-A ATTCAAAAAGCCCGAGTCTGTGAATGTAATCTCGA GATTACATTCACAGACTCGGG-3′;由生工生物工程(上海)股份有限公司合成。
1.4 pLKO.1-puro慢病毒载体质粒酶切
慢病毒载体质粒pLKO.1-puro经感受态DH5α细菌扩增后,用限制性内切酶AgeⅠ和EcoRⅠ进行酶切,体系如下:AgeⅠ2.5μL,Eco RⅠ2.5μL,pLKO.1-puro 2.5μg,缓冲液5μL,以无菌双蒸水补足至50μL。酶切反应条件:37℃4 h。
1.5 胶回收酶切后pLKO.1-puro载体
将“1.4”产物行1%琼脂糖凝胶电泳,并于长波紫外检测仪中检测,切取目的位置相应的条带并称重。按照生工生物工程(上海)股份有限公司胶回收试剂盒操作步骤进行胶回收。
1.6 载体酶切及与目的片段的连接
将Raptor基因shRNA目的片段的正义链与反义链1∶1混合,退火后按下述体系加样,16℃连接过夜,将shRNA连接到胶回收的pLKO.1-puro载体中。体系如下:10×缓冲液2μL,pLKO.1-puro酶切纯化载体1μL,Raptor shRNA目的片段16μL,T4连接酶1μL。
1.7 pLKO.1-puro-shRNA-Raptor转化感受态细菌
取“1.6”中连接产物1μL加入感受态DH5α中,轻轻混匀置于冰上孵育30 min;42℃孵育90 s,期间勿摇动EP管;休克结束后迅速移至冰上,加入LB液体培养基400μL,于37℃摇床250 r/min扩增2 h;4 000 r/min室温离心4 min,弃去一半上清液后混匀,将菌液均匀涂布于含有氨苄西林的LB固体平板上,37℃培养16 h;然后挑取单个菌落接种于含有氨苄西林的LB液体培养基中,于37℃摇床250 r/min孵育过夜。
1.8 质粒的提取和测序
按照试剂盒说明书提取质粒,送生工生物工程(上海)股份有限公司测序,分析shRNA序列(含AgeⅠ和Eco RⅠ两个酶切位点)是否正确,确认是否成功构建pLKO.1-puro-shRNA-Raptor载体。
1.9 病毒的包装与感染
将HEK-293T细胞接种于60 mm培养皿中,当细胞生长至汇合度为70%且状态良好时,加入6μg质粒进行转导,即pMD2G、psPAX2和pLKO.1-puroshRNA-Raptor载体按质量比1∶2∶3比例混匀,加入高糖DMEM至250 mL;同时另取高糖DMEM 232 mL,加入18μL Lip2000混匀,室温静置5 min;最后将含有质粒的DMEM 加入至含有Lip 2000的DMEM中,混匀,室温静置20 min;加入到HEK-293T细胞培养皿中,补充培养基体系至3 mL,置于37℃,5% CO2培养箱培养8 h;弃培养液,加入3 mL含10%胎牛血清的无双抗高糖DMEM继续培养24 h;收集培养上清液,用0.22μm除菌滤器过滤,即为病毒悬液;同时将转染的HEK-293T细胞更换新鲜培养基孵育24 h,再次收获病毒悬液。将收获的病毒悬液和含10%胎牛血清的DMEM以1∶1加入到汇合度为30%左右的mTEC1中,加入聚凝胺(5μg/mL)培养24 h;重复此步骤再次培养24 h后更换正常的无双抗DMEM并加入嘌呤霉素(2~5 μg/mL)筛选稳定感染的细胞。待细胞生长稳定,完全抵抗嘌呤霉素后,收集部分细胞提取蛋白进行免疫印迹法鉴定,另一部分继续传代培养。
1.10 免疫印迹法检测各组细胞相关蛋白的表达
将野生型mTEC1和稳定感染shRNA-Raptor病毒的mTEC1以每孔2×105接种于6孔板,前者接种2孔,后者接种1孔,37℃5% CO2培养24 h,分别记作mTEC1组,shRNA-Raptor组。在其中1孔野生型mTEC1中以1∶1 000加入50μmol/L雷帕霉素,记作mTEC1-雷帕霉素组。继续培养12 h,收集各组细胞提取蛋白;mTEC1-雷帕霉素组作为mTOR及其下游被抑制的阳性对照。
蛋白行SDS-PAGE,70 V 2 h;350 mA转膜2 h;PVDF膜洗涤后用5% BSA封闭1 h;抗Raptor、mTOR、p-mTOR、p70S6k、p-p70S6k和内参β-肌动蛋白等一抗按说明书用封闭液按1∶1 000稀释,4℃孵育过夜;TBST洗膜3次,每次10 min;加入HRP偶联的羊抗兔IgG抗体(TBST稀释,均为1∶10 000),室温孵育1 h;TBST洗膜3次,每次10 min;采用ECL检测试剂盒曝光检测各蛋白表达情况并进行灰度扫描,使用Graph-Pad Prism 5软件进行统计学分析。
1.11 连续计数法检测mTEC1-shRNA-Raptor细胞的增殖
将野生型mTEC1与稳定感染shRNA-Raptor病毒的mTEC1以每孔5 000个细胞的初始密度接种于12孔板,各接种7个复孔。每天各计数两种细胞其中一个孔的细胞数,计数7 d;重复3次。
1.12 TUNEL法检测mTEC1-shRNA-Raptor细胞的凋亡
将野生型mTEC1与稳定感染shRNA-Raptor病毒的mTEC1以5 000个/孔接种于96孔板,5% CO237℃培养48 h,根据罗氏公司Tunel试剂盒说明书染色。主要步骤如下:弃去96孔板中培养基,PBS洗2次;每孔加100μL 4%低聚甲醛(pH=7.4),室温固定20 min;PBS洗2次;加入新鲜配制的渗透液100μL置于冰上破膜10 min;PBS洗涤2次;将标记溶液与酶浓缩液以9∶1比例混合,每孔加入50 μL,37℃孵育1 h;PBS洗涤2次,滴加1滴PBS置于荧光显微镜下观察,阳性细胞可见绿色荧光。最后计算出阳性细胞比例。
1.13 统计学方法
所有实验数据采用GraphPad Prism 5软件行统计学分析,计量数据采用均数±标准差(±s)表示,3组间均数比较采用单因素方差分析,进一步两两比较采用SNK-q检验;2组间均数比较采用t检验,以P<0.05判断差异有统计学意义。
2 结果
2.1 载体质粒pLKO.1-puro酶切和电泳鉴定
pLKO.1-puro慢病毒载体经酶切后,琼脂糖凝胶电泳显示在1 900 bp和7 000 bp左右处出现条带,表明载体质粒酶切成功。见图1。
2.2 Raptor shRNA目的片段与载体连接产物的鉴定
测序结果与插入的Raptor基因的shRNA序列5′-CCGGGCCCGAGTCTGTGAATGTAAT-CTCGAGATTACATTCACAGACTCGGGCTTTTTG-3′完全一致(第261~318位),表明成功构建pLKO.1-puro-shRNARaptor载体。见图2。
2.3 pLKO.1-puro-shRNA-Raptor稳定转染mTEC1细胞系的建立
由图3可见,与mTEC1组相比,shRNA-Raptor组Raptor蛋白、p-mTOR以及p-p70S6k表达量均明显降低(P均<0.05);与mTEC1组相比,mTEC1-雷帕霉素组p-mTOR以及p-p70S6k表达量也明显降低,但二者间Raptor蛋白表达差异无统计学意义(P>0.05)。由此进一步说明,shRNA-Raptor组pmTOR以及p-p70S6k表达降低是由Raptor基因抑制造成的。

图1 p LKO.1-puro载体酶切电泳鉴定
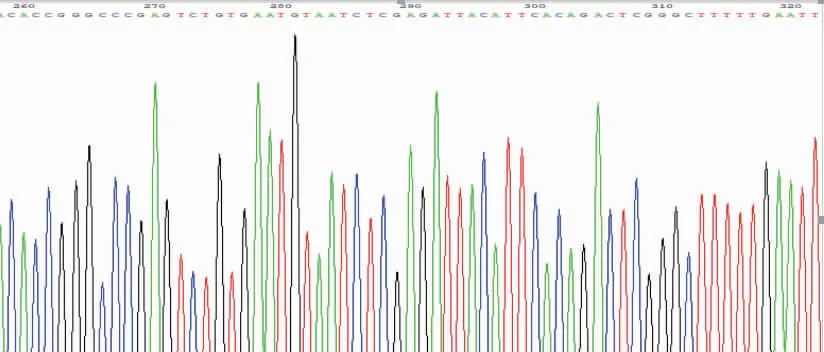
图2 pLKO.1-puro-shRNA-Raptor载体鉴定

图3 免疫印迹检测各组细胞相关蛋白的表达
2.4 mTEC1-shRNA-Raptor和野生型mTEC1细胞数变化
如图4所示,mTEC1-shRNA-Raptor和mTEC1培养7 d,2种细胞同一天的细胞数间差异均无统计学意义(P均>0.05)。

图4 mTEC1-shRNA-Raptor和mTEC1细胞计数
2.5 Tunel细胞凋亡试验阳性率统计
如图5所示,mTEC1-shRNA-Raptor和野生型mTEC1细胞Tunel试验阳性率均很低,二者差异无统计学意义(t=1.27,P>0.05),表明2种细胞正常培养时很少发生凋亡。由此说明,Raptor基因敲降并不引起mTEC1明显的凋亡。
3 讨论
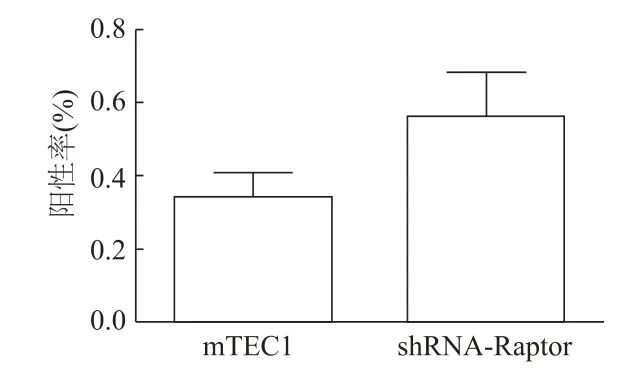
图5 mTEC1与mTEC1-shRNA-Raptor细胞Tunel试验阳性率比较
自噬是细胞清除其损伤的细胞器或错误折叠蛋白的重要方式。自噬减弱时,细胞内错误折叠的蛋白堆积,导致细胞衰老死亡。mTOR信号通路是细胞内重要的信号通路,其可抑制自噬[4]。大量文献报道,mTOR活化增加可致细胞衰老和退化[5-9]。胸腺是机体最重要的中枢免疫器官,TECs是胸腺中最为重要的基质细胞之一,是胸腺微环境的重要组成部分。本实验室研究发现,随着小鼠年龄的增长,胸腺mTOR表达上调(未发表)。为进一步研究mTOR在TECs退化中的作用,本研究通过建立mTORC1与下游作用的重要分子Raptor基因稳定敲降的mTEC1细胞,成功构建Raptor基因的pLKO.1-puro-shRNA慢病毒质粒,并成功感染mTEC1。免疫印迹结果表明,转染后的mTEC1-shRNA-Raptor细胞Raptor和p-mTOR以及p-p70S6k蛋白表达水平明显降低,说明已成功构建Raptor基因敲降的mTEC1细胞系。mTOR参与细胞的增殖和凋亡,本实验采用连续计数法以及Tunel法检测细胞增殖与凋亡,结果显示,Raptor基因的敲降并不影响mTEC1增殖和凋亡。Foxn1是转录叉头因子家族成员,在胸腺发育中起重要作用。已有文献报道,敲除mTORC1/Raptor并不会引起胸腺的明显萎缩和胸腺细胞的凋亡,只有联合敲除Foxn1后,胸腺才发生明显的退化和萎缩[10]。本实验结果也证明这一点。尽管mTORC1信号通路参与细胞的生长增殖,但其对mTEC1的作用还未阐明,在胸腺退化过程中mTOR信号和Foxn1之间以何种方式发挥作用,尚有待深入研究。
