尼莫地平对脑缺血大鼠自噬的影响
2019-04-29李鲁博陈波钱尧李巧玉
李鲁博,陈波,钱尧,李巧玉
(1.江苏大学医学院,江苏 镇江212013;2.江苏大学附属人民医院神经外科,江苏 镇江212002)
脑缺血会导致颅内缺氧,随着缺血缺氧进展会导致氧糖剥夺/复氧损伤(oxygen-glucose deprivation/reoxygenation,OGD/R)的发生,并导致神经元及血管损伤,同时缺氧也会诱发自噬[1-3]。研究表明,适度的自噬可在外界环境刺激下维持细胞稳态,过度自噬则可能导致细胞死亡[4]。脑卒中发生后,颅内会出现缺血缺氧,从而导致自噬的发生[1]。尼莫地平是一种1,4-二氢吡啶类L-型钙通道拮抗剂。该药物具有神经保护作用,可改善动脉瘤性蛛网膜下腔出血预后、预防迟发型缺血性神经功能障碍及预防听神经鞘瘤术后面神经和听神经损伤[5-6]。研究表明,尼莫地平可以通过影响凋亡的发生影响脑卒中的预后[7],但是未明确说明该药物有无影响自噬发生的作用。在脑卒中的发生过程中,由于自噬的作用,神经及血管会受到损伤[3]。关于尼莫地平对脑卒中疾病有无神经血管保护作用尚不清楚。因此,本研究制备2种自噬模型:大鼠大脑中动脉局灶性线栓法(middle cerebral artery occlusion,MCAO)模型即脑缺血模型,以及星形胶质细胞氧糖剥夺(OGD)模型;并将尼莫地平应用到2种模型中,通过蛋白免疫印迹法检测自噬相关蛋白LC3-Ⅱ、Beclin-1、m-TOR/p-mTOR的表达变化,观察该药物在脑卒中疾病中的作用,以及其对自噬的影响。
1 材料与方法
1.1 材料
SPF级SD大鼠,雌雄各半,共90只,体质量220~250 g;新生SD大鼠(10只,出生3 d内),均由江苏大学动物实验中心提供[许可证号:SYXK(苏)2013—0036]。尼莫地平注射液(拜尔医药保健有限公司);兔抗LC3-Ⅱ抗体、兔抗Beclin-1抗体、兔抗m-TOR抗体、兔抗p-mTOR(S2448)抗体、鼠抗GFAP抗体、抗-GFAP/FITC荧光标记抗体均为美国CST公司产品;氯代三苯基四氮唑(TTC)购自上海玉博科技有限公司;CCK8细胞计数试剂盒(美国Sigma公司);多聚赖氨酸(美国Gibco公司)。
1.2 大鼠分组及MCAO大鼠模型制备
将90只SD大鼠均分为3组,分别为尼莫地平组、缺血模型组、假手术组,每组30只。MCAO模型按照相关文献方法[8],以10%水合氯醛(4 mL/kg)麻醉大鼠,在显微外科手术显微镜下,用眼科剪于大鼠颈部右侧近正中央处切开皮肤,逐层剥离颈部肌肉群及舌下腺,充分显露颈总动脉及其分支颈内、颈外动脉。夹闭颈内动脉并结扎颈总动脉、颈外动脉远心段,于颈总动脉近颈内动脉处开一小口并插入线栓。手术完成后,在自然状态下,等其苏醒。在缺血2 h后,取出线栓,行再灌注处理。尼莫地平组及缺血模型组常规制备MCAO模型,尼莫地平组行1 mg/kg尼莫地平注射液腹腔注射,缺血模型组以等体积的0.9%生理盐水腹腔注射。假手术组仅将丝线插入1 cm,以避免阻断大脑中动脉血流,并同样给予等体积0.9%生理盐水腹腔注射。各组分别于造模前1 h、灌注后2 h、4 h行腹腔给药。
1.3 Zea-Longa评分标准
Zea-Longa评分为常用MCAO大鼠模型判断方法[9]。评分标准:0分,未见明显异常,未见神经损伤症状;1分,将大鼠尾巴提起时,对侧前爪不能完全伸展;2分,大鼠存在向缺血侧旋转的行为;3分,大鼠损伤侧倾向瘫痪或倾倒,重度神经功能缺损;4分,无自发行走,意识丧失。当模型大鼠存在对侧肢体瘫痪、行动异常、部分存在侧向移动的现象时,即为模型制备成功。术后24 h进行评分,并选取符合2~3分标准的大鼠入组。
1.4 TTC染色检测各组脑组织梗死体积
按Zea-Longa评分分组后,每组随机选取3只大鼠;各组大鼠麻醉后,心脏放血并行生理盐水灌注,随后迅速取出大鼠脑组织并保持大脑完整,而后于-20℃冰箱中速冻20 min。去除脑膜等多余脑组织,并将冰冻大脑均匀切片。将脑切片置入2%TTC中均匀染色30 min。应用Image J软件标定出正常组织(红色)及梗死组织(白色)像素值,与标准比例尺像素值做比较,通过软件自动计算出相关组织面积。将各脑切片梗死面积(非缺血侧半球面积-缺血侧半球未梗死区面积)相加后,乘以厚度(2 mm)为总的梗死体积。梗死体积/全脑体积×100%即为脑梗死体积百分比。
1.5 蛋白质印迹法检测脑组织中LC3-Ⅱ、Beclin-1和m-TOR/p-mTOR的表达
各组在评分分组后,取出新鲜大脑组织,配置蛋白裂解液,选取大脑基底节区缺血半暗带组织,以超声细胞破碎仪低温匀浆,低温冰柜保存备用。取制备好的脑组织匀浆,测定蛋白浓度,每孔蛋白上样量10μL,行SDS-PAGE;将凝胶上的蛋白转印至PVDF膜;转膜后用含5%脱脂奶粉的TBST封闭液封闭2 h;分别滴入兔抗LC3-Ⅱ抗体(1∶400)、兔抗Beclin-1抗体(1∶500)、兔抗p-mTOR抗体(1∶1 000),并以β-肌动蛋白作为内参,4℃孵育过夜;予TBST洗膜5次,每次10 min;以2 mL的羊抗兔IgG二抗(FITC标记,1∶5 000)孵育,室温缓慢摇动2 h;加ECL显色剂曝光胶片处理,并用蛋白测定分析软件计算条带的光密度值。
1.6 HE染色检测大鼠脑组织中细胞死亡情况
选取标记好的大鼠,予以水合氯醛麻醉,充分显露心脏,分别以300 mL生理盐水及4%低聚甲醛400 mL经心尖注入,并由右心耳放血。离断大鼠颈部,取出大脑组织并固定于4%低聚甲醛中,标记并备用。将组织放入包埋盒中,升梯度浓度乙醇脱水处理,二甲苯透明;放入熔蜡箱中保温浸泡;待石蜡完全浸入组织后即可冷却凝固成型。于视交叉后5 mm处开始向后切片至基底节区,以3μm厚度开始取材。染色前需脱蜡,二甲苯浸泡,降梯度浓度乙醇浸泡。行苏木精-伊红染色,具体过程为苏木精染液染色10 min;水洗多余染液,1%盐酸乙醇分色片刻;镜检控制,直至细胞核及核内染色质清晰为止,约10 s;流水冲洗15~30 min,蒸馏水洗;0.5%伊红染液染色5 min;依次经70%、85%、95%、100%乙醇脱水,各级为2~3 min;二甲苯透明2次,每次1 min;擦去切片周围多余二甲苯,迅速滴加适量中性树胶,再加盖玻片封固。
1.7 星形胶质细胞培养及纯化
取新生SD大鼠,心脏放血后,取大脑组织,仔细剔除脑膜、血管、小脑等,取大脑皮层并剪成组织块,胰酶消化,吹打成细胞悬液,室温1 000 r/min离心5 min;重悬后并筛网过滤。将细胞接种于多聚赖氨酸包被的培养瓶中,每3 d换液1次,培养7~10 d,根据胶质细胞间黏附性不同行星形胶质细胞纯化。具体方法:将培养瓶置于恒温振荡器中,37℃180 r/min振荡5 h,去除上层细胞;将下层细胞消化、重悬,继续置于多聚赖氨酸包被的培养瓶中培养。重复上述方法至第4代细胞,方可用于细胞实验。将纯化后的星形胶质细胞消化、离心、重悬,5%牛血清白蛋白封闭10 min。PBS洗涤,离心重悬,重复3次。加入1%牛血清白蛋白稀释的一抗GFAP于4℃孵育过夜。PBS再次洗涤,加入抗GFAP/FITC荧光标记抗体,4℃避光孵育1 h。PBS清洗3次,上流式细胞仪检测其纯度。
1.8 糖氧剥夺实验模型建立
取纯化后的星形胶质细胞,待细胞在培养瓶中生长到一定密度后,弃培养液,并加入PBS,将培养瓶置于OGD实验装置中,加入N2∶CO2=0.95∶0.05(v/v)的混合气体,置于培养箱中培养。
1.9 CCK8法检测星形胶质细胞活性
选取纯化后的星形胶质细胞,接种于96孔板,分别设置空白对照组、OGD模型组、尼莫地平组,细胞按常规培养。待细胞铺满孔底90%后,空白对照组无特殊处理,OGD模型组仅制备OGD模型,尼莫地平组于氧糖剥夺模型制备前1 h予5μg/mL尼莫地平预处理。设置5个复孔,分别给予OGD处理0,1、2、4、8 h,每孔加入10μL CCK8试剂,继续孵育3 h,采用酶标仪测定各孔光密度(D)。按以下公式计算细胞活性,细胞活性(%)=[D(加药)-D(空白)]/[D(0加药)-D(空白)]×100。D(加药):具有细胞、CCK8溶液和尼莫地平预处理/OGD模型孔D值;D(空白):具有培养基和CCK8溶液而没有细胞的孔D值;D(0加药):具有细胞、CCK8溶液而没有尼莫地平预处理/OGD模型孔D值。
1.10 统计学处理
应用SPSS 17.0进行统计学分析,所有数据行方差齐性检验及正态检验后,对各组数据行单因素方差分析,多组数据间应用LSD-t检验进一步分析,P<0.05为差异有统计学意义。
2 结果
2.1 Zea-Longa评分比较
由图1可见,缺血模型组和尼莫地平组Zea-Longa评分均明显高于假手术组(P<0.05);其中,缺血模型组评分明显高于尼莫地平组(t=2.585,P<0.05)。
2.2 各组大鼠脑组织Beclin-1、LC3-Ⅱ、m-TOR/pmTOR蛋白表达
与假手术组相比,尼莫地平组与缺血模型组LC3-Ⅱ及Beclin-1表达,m-TOR蛋白与p-mTOR表达均明显增高(P均<0.05)。与缺血模型组相比,尼莫地平组LC3-Ⅱ及Beclin-1表达明显下降,m-TOR蛋白及p-mTOR表达明显增加(P<0.05)。见图2。
2.3 脑组织HE染色结果
由图3可见,假手术组脑组织基本形态结构相对完整;缺血模型组脑组织有散在的空腔结构,间质呈水肿态,存在大量神经元变性、坏死;尼莫地平组与缺血模型组比较,缺血灶周围区域中坏死灶明显减少,细胞死亡数量降低。见图3。
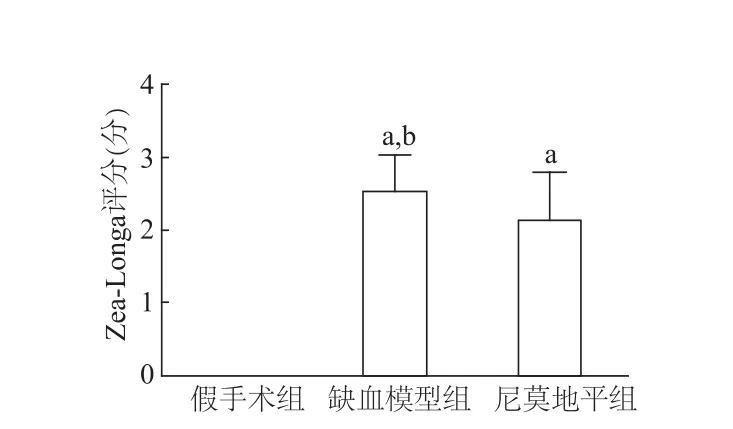
图1 各组大鼠Zea-Longa评分比较
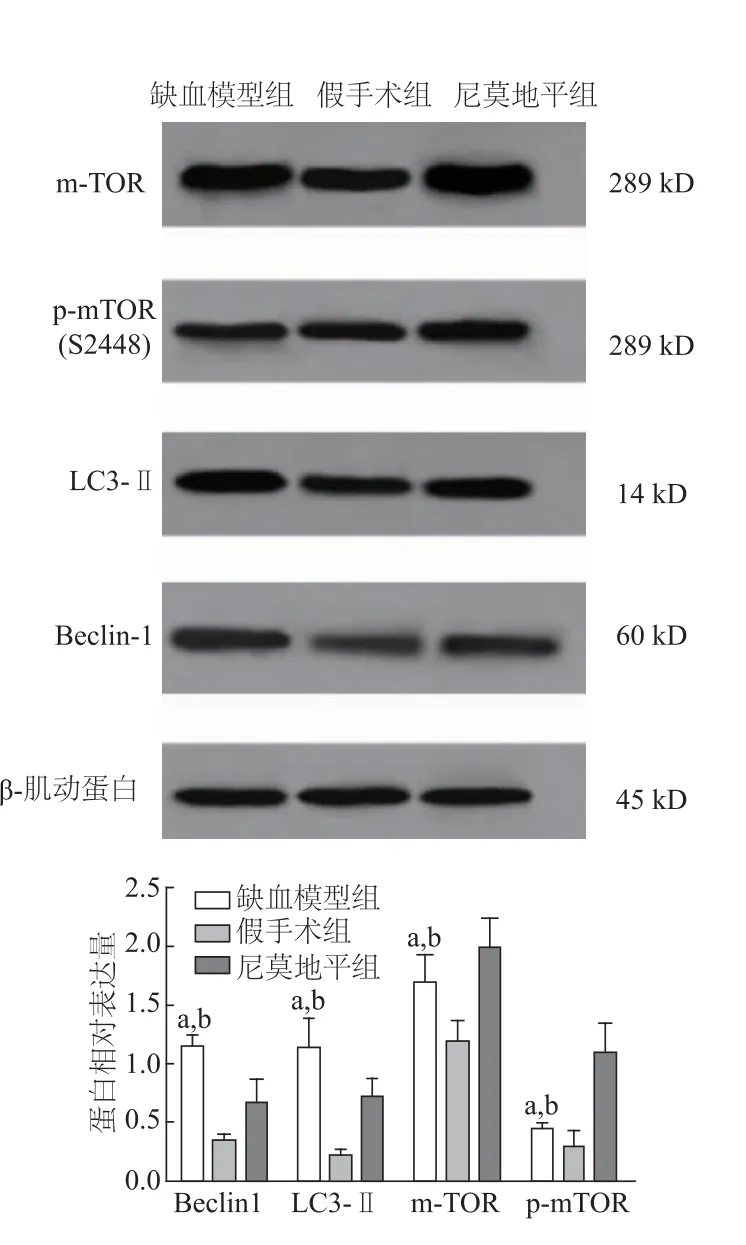
图2 免疫印迹法检测各组大鼠脑组织中相关蛋白的表达

图3 3组脑组织病理形态(HE染色×200)
2.4 脑组织TTC染色结果
由图4TTC染色结果可见,假手术组未发生梗死;尼莫地平组及缺血模型组梗死体积均大于假手术组(P<0.05);且缺血模型组梗死体积明显大于尼莫地平组(t=3.859,P<0.05)。
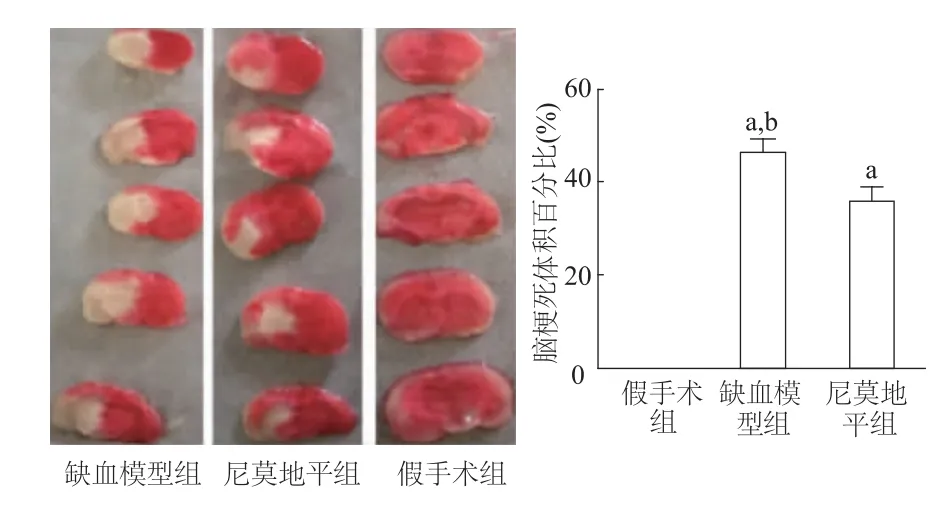
图4 TTC染色结果及脑梗死体积百分比
2.5 星形胶质细胞细胞活性比较
应用GFAP标记星形胶质细胞后行流式细胞术检测,星形胶质细胞纯度为98.36%(图5)。CCK8实验表明,随着时间的推移,OGD模型组中星形胶质细胞存活下降,细胞损伤加重;尼莫地平组细胞仍有损伤,但损伤程度低于OGD模型组(图6)。
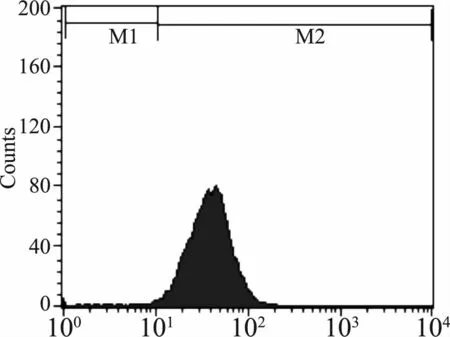
图5 流式细胞仪检测星形胶质细胞纯度结果
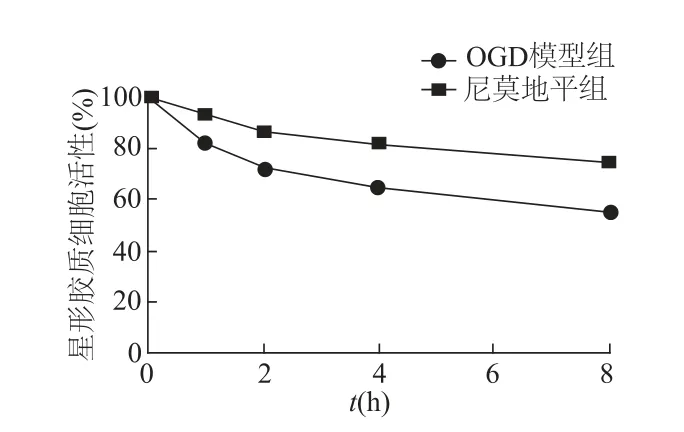
图6 CCK8检测星形胶质细胞活性
2.6 各组星形胶质细胞Beclin-1、LC3-Ⅱ、m-TOR蛋白表达
与OGD模型组相比,尼莫地平组LC3-Ⅱ及Beclin-1表达明显降低,m-TOR蛋白及p-mTOR蛋白表达明显增加(P均<0.05)。尼莫地平组及OGD模型组各种蛋白表达程度均明显高于空白对照组(P均<0.05)。见图7。

图7 各组星形胶质细胞中Beclin-1、LC3-Ⅱ和m-TOR蛋白表达
3 讨论
脑卒中发病部位特殊,对其研究通常依赖于建立相关模型,常用的模型有双动脉法、四血管法、MCAO法等脑缺血模型。其中前两种方法操作相对简单,但疾病模型构筑的病理环境与机体脑卒中存在差异[10]。大脑中动脉是颈内动脉最大的分支,也是颈内动脉的直接延伸,是人类脑卒中发病的常见部位[1]。通过颈内动脉可以将线栓直接通入大脑中动脉并制造局灶性脑缺血,因此,MCAO模型被广泛应用[11]。其优点有操作创伤小,简便易行,易于筛选成功模型等;此外,选用MCAO模型更有利于重复实验,并最大可能地复原人脑缺血疾病相关病理环境。OGD实验是在氧糖剥夺后利用其损伤诱发自噬发生的一种模型,而星形胶质细胞则是颅内重要的细胞,利用OGD实验研究细胞层面自噬的发生,对研究自噬机制及相关通路有着重要意义[12]。
尼莫地平可特异扩张脑血管、增加冠脉血流量,对外周血管影响较小,在降低血压同时,保证颅内供血,对缺血性脑损伤有保护作用[13]。本研究通过制备MCAO模型并行大脑组织HE染色发现,假手术组脑组织基本形态结构相对完整,无明显梗死缺血;缺血模型组脑组织有散在的空腔结构,间质呈水肿态,存在大量神经元变性、坏死。与缺血模型组比较,尼莫地平组缺血灶周围区域中坏死灶明显减少,细胞死亡数量降低。同时TTC染色结果也表明,应用尼莫地平处理后,大鼠脑组织梗死体积较单纯缺血再灌注损伤时要小。由此说明,应用尼莫地平可以降低局部脑缺血所致的神经损伤。
自噬是一种细胞自我消亡的过程,主要有两种自噬分子调控机制,一种是m-TOR相关的通路,另一种是m-TOR非依赖性通路[14]。Beclin-1是一种自噬相关蛋白,与酵母Atg6分子相类似,在处于恶劣细胞内环境时,Beclin-1的降解物可与Ⅲ型PI3K复合物结合,影响m-TOR相关通路,促进自噬发生[15]。LC3-Ⅱ蛋白是自噬指示蛋白,直接反应自噬发生的程度[16]。本研究结果显示,与假手术组相比,尼莫地平组及缺血模型组Belcin-1及LC3-Ⅱ蛋白表达均明显升高;与缺血模型组相比,尼莫地平组Belcin-1及LC3-Ⅱ的表达明显降低。同时OGD模型作为细胞层面的自噬模型同样证明了星形胶质细胞中可以发生自噬;与OGD模型组相比,尼莫地平组Belcin-1和LC3-Ⅱ表达同样降低。此外,应用尼莫地平处理后,细胞损伤率有所降低。由此说明,随着脑卒中的发生,自噬亦会在脑组织中发生,应用尼莫地平可抑制自噬发生。同时,细胞层面的OGD实验及CCK8实验也证明,尼莫地平可以提高自噬发生后星形胶质细胞的活性,从而降低自噬对星形胶质细胞的损伤。综上所述,本研究表明,尼莫地平对脑卒中有一定的神经保护作用,并存在一定的治疗作用,但具体作用机制及是否可以应用于临床治疗仍有待进一步研究。
