柴胡皂甙D经mTOR通路抑制A549细胞的上皮间质转化
2019-04-29史小东郑金旭钱海杨磊孙金玲
史小东,郑金旭,钱海,杨磊,孙金玲
(1.江苏大学附属医院呼吸内科,江苏 镇江212001;2.江苏大学医学院,江苏 镇江212013)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种病因不明、进展迅速、不可逆、预后极差的慢性肺疾病。生长因子及其胞内的下游信号通路等多种因素可以促进纤维化的进展[1]。IPF过程中肺组织损伤及其生理功能异常的特点是肺泡上皮细胞发生上皮间质转化(epithelial-mesenchymal transition,EMT),形成迁移能力强的间充质类细胞。转化生长因子β1(TGF-β1)是可诱导肺泡上皮细胞发生EMT的最经典生长因子之一[2]。发生EMT时上皮细胞标志物E-钙黏蛋白等表达下调,间质细胞标志物α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)等表达上调[3]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是丝氨酸/苏氨酸蛋白激酶家族的成员,是细胞内调控细胞代谢、生长、增殖和凋亡的信号途径之一。近年来相关研究发现mTOR信号通路异常与肺纤维化发生有关[4]。Nistala等[5]研究发现,发生IPF时组织细胞内mTOR信号通路活化,但具体机制尚不明确。
柴胡皂甙D(saikosaponins D,SSd)是从中药柴胡中提取分离出来的有效成分,具有抗纤维化、抗炎、抗肿瘤等作用[6-7]。SSd治疗肺纤维化小鼠模型可取得与激素类似的疗效[8],但具体作用机制,尤其是否通过相关信号通路而阻断EMT尚不明确。本实验通过TGF-β1刺激体外培养的A549细胞建立EMT模型,并予SSd干预,检测细胞内mTOR、p70S6及EMT发生时α-SMA、N-钙黏蛋白、Ⅰ型胶原蛋白、E-钙黏蛋白的表达,进一步探讨SSd经mTOR通路对EMT过程的可能影响。
1 材料与方法
1.1 材料
非小细胞肺腺癌A549细胞株购于中国科学院上海生命科学研究院细胞资源中心。SSd(南京灵宝生物科技公司);重组TGF-β1、p-mTOR、p70S6兔来源多克隆抗体、E-钙黏蛋白、N-钙黏蛋白(CST公司);Ⅰ型胶原蛋白、α-SMA(武汉博士德生物工程公司)。
1.2 细胞培养
将人肺癌细胞株A549置于含10%胎牛血清的RPMI 1640培养液中,于5%CO2、37℃条件下,每2天换1次培养液,0.25%胰蛋白酶消化细胞进行传代培养。
1.3 SSd的配制
将20 mg SSd用780μL DMSO稀释为终浓度2 mmol/L的浓缩液。实验使用时予RPMI 1640工作液稀释至需要浓度。
1.4 MTT实验检测细胞增殖
取对数生长期的A549细胞,分为5组,用胰蛋白酶常规消化,离心收集细胞沉淀。用含10%胎牛血清的DMEM培养液重悬制成细胞悬液,计数细胞并调整细胞密度至1×104/mL,接种于96孔板中,每孔加入100μL,每组设3个复孔。培养12 h后,改用无血清DMEM培养液,饥饿细胞12 h。其中4组加入TGF-β1(10 ng/mL)4μL刺激A549细胞24 h后,再予不同终浓度SSd(0、0.5、1.0、2.0μmol/L)作用24 h。培养结束后分别每孔加入20μL MTT溶液,置37℃培养箱孵育4 h,弃去培养液。每孔加入100μL DMSO,振荡20 min,使紫色结晶物甲臜液溶解充分后在酶联免疫仪上490 nm波长测定光密度(D)值。在相同条件下重复实验3次,对照组也以同样方法进行测定。
1.5 蛋白质印迹检测mTOR信号通路及EMT相关蛋白
1.5.1 细胞处理及蛋白提取 分别取对数生长期的A549细胞,常规消化细胞接种6孔板,以10 ng/ml的TGF-β1刺激24 h,用不同浓度(0.5、1.0、2.0 μmol/L)的SSd溶液作用于细胞,培养24 h后,弃培养液,用预冷的PBS洗涤细胞1~2遍,吸干PBS后加入100μL煮沸的2×SDS-上样缓冲液裂解细胞,收集细胞,加入1.5 mL离心管中,干式恒温器100℃煮沸蛋白5 min,再用超声仪破碎细胞10 s,于4℃,12 000×g离心5 min,-20℃冰箱待检。
取对数生长期的A549细胞,常规消化细胞接种6孔板,以10 ng/mL的TGF-β1刺激24 h,再用1 μmol/L SSd溶液作用于细胞8 h、12 h、24 h后,弃培养液,用预冷的PBS清洗细胞1~2遍,吸干后按上述方法提取蛋白。
1.5.2 蛋白质印迹 根据上述分离蛋白分子质量的大小,配制相应浓度的分离胶及浓缩胶。加样后,浓缩胶以70 V恒压积聚蛋白,再以120 V电压在分离胶中分离蛋白。电泳结束后将PVDF膜贴于目标蛋白对应大小的标准参照物上,转膜条件为恒流350 mA、4℃、2 h,转膜结束后用含5%BSA的封闭缓冲液室温封闭1 h。按说明书要求稀释抗体并室温孵育一抗mTOR、p70S6、α-SMA、N-钙黏蛋白、Ⅰ型胶原蛋白、E-钙黏蛋白抗体及内参β-肌动蛋白(1∶1 000)4 h,然后用TBST洗涤膜3次。用TBST按1∶5 000的比例稀释辣根过氧化物酶标记的二抗,置摇床室温孵育1 h,快速洗膜3次。最后在膜表面加入曝光液后于化学发光成像系统中扫描条带。
1.6 统计学分析
应用SPSS 17.0软件进行统计分析,计量资料以均数±标准差(±s)表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 SSd抑制TGF-β1诱导的A549细胞增殖
MTT结果显示,与对照组相比,TGF-β1(10 ng/mL)刺激A549细胞24 h后,细胞的增殖能力显著上升(t=0.000 214,P<0.05)。与TGF-β1刺激组比较,TGF-β1+SSd组细胞增殖能力明显降低,且随着SSd剂量的增加,抑制效果逐渐增强(F =67.33,P<0.05)。见图1。
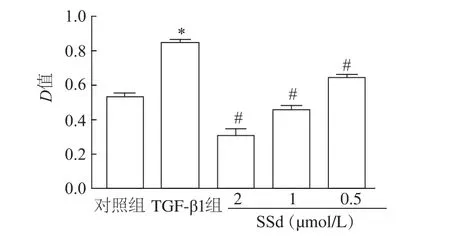
图1 不同浓度SSd对TGF-β1作用下A549细胞增殖能力的影响
2.2 不同浓度SSd作用后TGF-β1诱导的A549细胞EMT相关蛋白的表达
蛋白质印迹结果显示,不同浓度SSd溶液(0.5,1.0,2.0μmol/L)作用后,TGF-β1(10 ng/mL)刺激的A549细胞E-钙黏蛋白明显升高(F=53.7,P<0.05),N-钙黏蛋白(F=90.22,P<0.05)、α-SMA(F=154.01,P<0.05)、Ⅰ型胶原蛋白(F=29.88,P<0.05)表达水平明显下降。表明SSd可抑制TGF-β1诱导的A549细胞发生EMT,且呈浓度依赖性。见图2。
同时TGF-β1作用后A549细胞p70S6蛋白、pmTOR表达显著增强(P<0.05),表明TGF-β1促进A549细胞EMT发生同时磷酸化激活mTOR。经不同浓度SSd(0.5,1.0,2.0μmol/L)作用后,TGF-β1刺激的A549细胞p70S6(F=101.44,P<0.05)、pmTOR蛋白(F=13.84,P<0.05)的表达随SSd浓度的增加而逐渐降低。见图2。

图2 不同浓度SSd抑制TGF-β1诱导A549细胞EMT相关蛋白表达
2.3 SSd作用不同时间点TGF-β1诱导的A549细胞EMT相关蛋白的表达
A549细胞经TGF-β1(10 ng/mL)刺激24 h发生EMT,选择1μmol/L的SSd作用8,12,24 h后,p70S6(F=24.47,P<0.05)、mTOR(F=24.00,P<0.05)蛋白的表达随时间变化逐渐降低,表明mTOR磷酸化及其下游信号通路的激活受到抑制;间质化指标α-SMA(F=19.72,P<0.05)、Ⅰ型胶原蛋白(F=49.53,P<0.05)表达显著下降,表明SSd同时逆转了EMT过程(图3)。
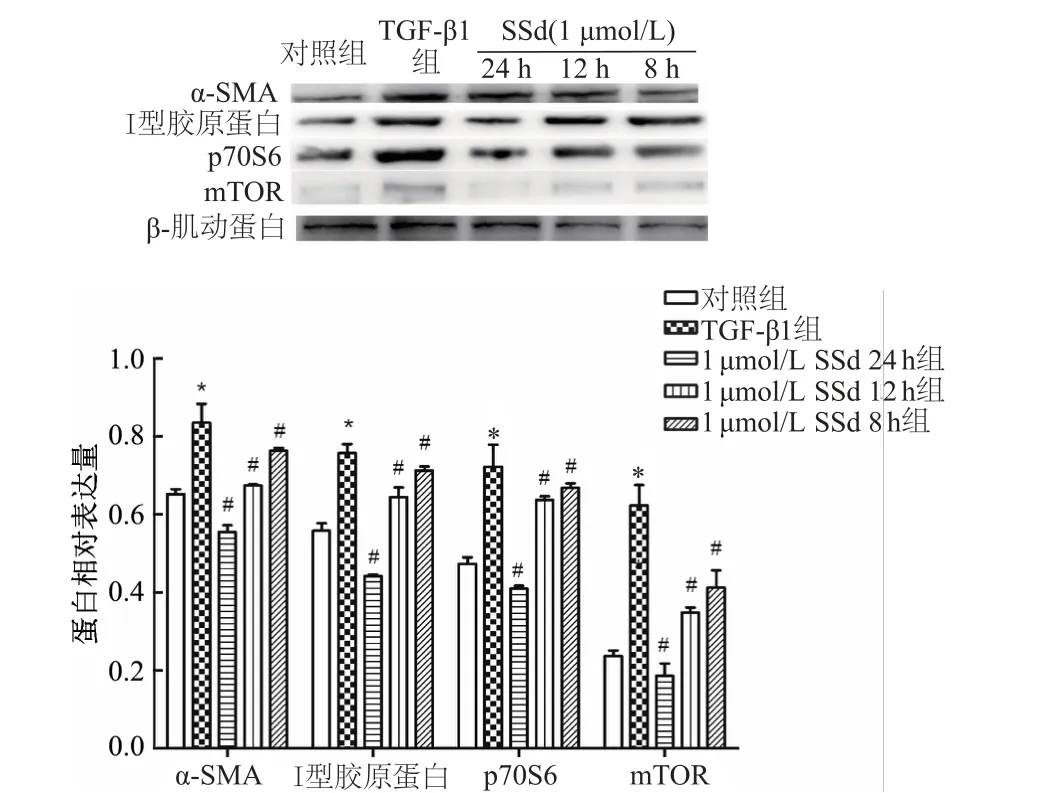
图3 SSd作用不同时间点TGF-β1诱导的A549细胞EMT相关蛋白的表达
3 讨论
人肺腺癌A549细胞属上皮来源细胞,具有稳定的肺泡上皮细胞的特征,广泛用于体外Ⅱ型肺上皮细胞药物代谢的模型。IPF病理特点是Ⅱ型肺泡上皮细胞增生,肌纤维母细胞聚集及肺组织结构重塑。目前认为,IPF是起源于肺泡上皮反复发生微小损伤的异常修复。在损伤修复时肺泡上皮细胞、巨噬细胞异常激活产生多种生长因子和趋化因子诱导固有成纤维细胞增生,趋化循环纤维细胞到肺脏损伤部位,刺激EMT和成纤维细胞分化为肌成纤维细胞[9]。肌成纤维细胞增生分泌大量的细胞外基质(extracellular matrix,ECM),导致纤维瘢痕形成、肺结构破坏、肺功能丧失,促进IPF的进展。在此过程中伴有TGF-β1、肿瘤坏死因子-α(TNF-α)、白细胞介素如IL-8、IL-31、IL-32等多种细胞因子的异常增多,以及TGF-β1/Smads、Wnt/β-catenin等信号通路的异常激活[10]。关于mTOR信号通路的相关研究主要集中在肿瘤领域,mTOR信号通路异常也参与EMT过程[11]。有研究发现PI3K/AKT/mTOR信号通路能调控Snail转录因子的表达,诱导EMT的发生[12]。另有研究表明,TGF-β1通过激活PI3K/AKT/mTOR信号通路诱导SPC-A1细胞EMT,从而促进Snail进入细胞核[13]。
阻断EMT过程是预防、治疗IPF的方法之一。IPF的治疗除了肺移植外,目前尚缺乏令人满意的治疗药物。虽然抗纤维化新药吡啡尼酮已经上市应用[14],但治疗作用及效果还需大规模及长时间的临床观察,且费用昂贵。SSd有较强的抗炎、抑制血管生成、抗氧化、抗肿瘤、抗纤维化、诱导细胞凋亡的作用,且毒副作用小、安全性高。
本研究用TGF-β1刺激A549细胞建立EMT模型,其α-SMA表达增加、p-mTOR表达增强,且其下游p70S6蛋白水平也升高。表明A549细胞经TGFβ1刺激发生EMT,同时细胞内mTOR信号通路活化。此外,不同浓度SSd处理后TGF-β1刺激的A549细胞p70S6蛋白表达水平降低,间质细胞特征性指标α-SMA、Ⅰ型胶原蛋白、N-钙黏蛋白也降低,上皮细胞相关指标E-钙黏蛋白则升高,呈明显剂量—时间依赖关系。由此可见,SSd可抑制TGFβ1诱导的A549细胞发生EMT,其机制可能是抑制了mTOR通路的活化,使ECM表达减少。本研究结果为阻止IPF形成,阻断EMT过程提供了新靶点,也为SSd用于临床肺纤维化治疗提供了理论依据。
