吉西他滨对小鼠实验性自身免疫性心肌炎的影响
2019-04-29倪道斌吕宏祥陈蓉田雨张士清苏兆亮许化溪
倪道斌,吕宏祥,陈蓉,田雨,张士清,苏兆亮,许化溪
(江苏大学医学院,江苏 镇江212013)
实验性自身免疫性心肌炎(experimental autoimmune myocarditis,EAM)是模拟自身免疫性炎症的疾病模型,Th17细胞在心肌炎的发生中起重要作用[1-2]。骨髓来源的抑制性细胞(myeloid-derived suppressor cell,MDSC)是一群异质性细胞,为树突状细胞、巨噬细胞和粒细胞的前体,生理情况下能迅速分化为成熟的树突状细胞、巨噬细胞和粒细胞,并进入相应的器官、组织,发挥正常免疫功能[3-4]。研究显示,MDSC在炎症、肿瘤和自身免疫疾病中增殖和聚集,参与疾病的进展[5]。但是,MDSC和Th17细胞在EAM中的相互作用尚不清楚。吉西他滨是阿糖胞苷类似物,是一种新型的细胞周期抗代谢物,可以阻止细胞从G1期向S期的进展致细胞死亡[6-7],多应用于肿瘤和炎症的治疗[8-10]。研究发现,吉西他滨可通过减少MDSC的数量从而抑制肿瘤的进展[11]。但是,吉西他滨在EAM中的作用尚不清楚。本研究拟探讨吉西他滨在EAM模型中的作用以及MDSC和Th17细胞的相互关系。
1 材料与方法
1.1 实验对象
21只6~8 周龄雄性Balb/c小鼠购自扬州大学比较医学中心,动物合格证编号:201807105。SPF条件下适应饲养1周,15只用于构建EAM小鼠模型,6只用于分选Naïve CD4+T细胞和MDSC。本实验动物方案均经过江苏大学实验动物保护与使用委员会批准。
1.2 主要仪器和试剂
qRT-PCR扩增仪(美国ABI公司);流式细胞仪(美国BD公司);酶标仪(美国Bio-Rad公司);Triozol试剂(美国Invitrogen公司);反转录试剂盒,SYBR Green PCR 试剂盒(大连TaKaRa公司);ELISA试剂盒(杭州联科生物技术股份有限公司);MDSC分离试剂盒,Naïve CD4+T细胞分离试剂盒(德国Miltenyi Biotec公司);IL-17A,Gr-1,CD11b流式抗体(美国BD公司);猪心肌肌球蛋白(上海生工生物公司);吉西他滨(江苏豪森药业股份有限公司);IL-17A引物由上海生工生物公司合成。
1.3 EAM小鼠模型的建立和处理
取1.5 mg猪心肌肌球蛋白,溶于75μL乙腈和150μL冰醋酸,用双蒸水定容至1.5 mL;将溶液与弗氏完全佐剂按照1∶1体积混合,乳化为1号均匀的乳浊液,用于建立EAM小鼠模型。分别取50μL乙腈、100μL冰醋酸、850μL双蒸水,共1 mL,与弗氏完全佐剂按照1∶1体积混合,乳化为2号均匀的乳浊液,用于注射对照组小鼠。
将15只Balb/c小鼠分为对照组,EAM组,EAM+吉西他滨组,每组5只。对照组:于第1天和第7天背部皮下多点注射2号乳浊液,每只200μL。EAM组和EAM+吉西他滨组于第1天和第7天背部皮下多点注射1号乳浊液,每只200μL。EAM+吉西他滨组于第1天开始,给予吉西他滨腹腔注射(50 mg/kg),每3 d注射1次。在第21天,取眼球血,颈椎脱臼处死3组小鼠,取心脏和脾脏组织用于后续实验。
1.4 Naïve CD4+T细胞和MDSC分选及共培养
于超净台中取6只Balb/c小鼠脾脏,经筛网研磨得到脾细胞悬液;用无菌滴管吸入无菌离心管中,经ACK裂解红细胞后,行500×g离心5 min,弃上清液。按照Naïve CD4+T细胞磁珠分选试剂盒说明书操作,先加适量MACS缓冲液稀释混匀,加入CD4+T细胞生物素抗体混匀,4℃孵育5 min;再加入CD4+T微磁珠4℃孵育10 min;用MACS缓冲液湿润柱子,将细胞悬液加入柱子,收集通过柱子的细胞,即为Naïve CD4+T细胞;标记CD4流式抗体,用流式细胞术检测分选的Naïve CD4+T细胞纯度。
按照MDSC磁珠分选试剂盒说明书操作,用500μL PBE重悬脾细胞,加入10μL FcR封闭液混匀,4℃静置30 min;加10μL Gr-1抗体混匀,4℃静置30 min;加入10 mL PBE,吸管吹打洗涤并吸弃大的杂质;4℃行500×g离心10 min;弃上清液,加600μL PBE重悬;加20μL抗生素磁珠4℃静置30 min;过MS分离柱;最后用PBE将MS分离柱中细胞压出得到MDSC,标记CD11b,Gr-1抗体后用流式细胞术检测分选的MDSC细胞纯度。
按照MDSC、Naïve CD4+T细胞磁珠分选试剂盒分别分离出MDSC、Naïve CD4+T细胞。本实验分为3组,活化组、诱导组和共培养组。活化组是经CD3抗体和CD28抗体活化Naïve CD4+T细胞;诱导组是用IL-6和TGF-β诱导活化Naïve CD4+T细胞分化为Th17细胞;共培养组使用诱导分化的Th17细胞,然后按照MDSC∶Th17=2∶1比例共培养;培养3 d,流式细胞仪检测各组Th17细胞比例。
1.5 HE染色观察心脏组织炎细胞浸润及炎症评分
取“1.3”中的心脏组织,4%低聚甲醛固定,石蜡包埋,4μm切片;二甲苯、梯度乙醇水化切片;苏木精染色2 min,流水冲洗;伊红染色2 min,流水冲洗;梯度乙醇、二甲苯脱水10 min;中性树脂封片,晾干,于光镜下观察炎性细胞浸润情况。
根据Pummerer等[12]提出的4级标准行炎症评分。0分:无炎性细胞浸润;1分:少量炎性细胞浸润;2分:局灶炎性细胞浸润;3分:炎性细胞浸润10%~30%;4分:炎性细胞浸润大于30%。
1.6 流式细胞术检测小鼠脾脏中MDSC和Th17细胞比例
取“1.3”中得到的脾脏组织放入滤网中,加入PBS研磨制备脾细胞悬液,用ACK裂解红细胞;4℃行3 500 r/min离心5 min;弃上清液后分2管,每管加250μL PBS重悬细胞,一管依次加入Gr-1和CD11b荧光抗体各1μL;另一管加入IL-17A荧光抗体1μL,室温避光孵育15 min;加入1 mL PBS混匀,4℃行3 500 r/min离心5 min;弃去未结合的荧光抗体上清液,加入200μL PBS重悬,然后经流式细胞仪检测MDSC和Th17细胞比例。
1.7 ELISA法检测小鼠血清中IL-17A浓度
取“1.3”中眼球血,常温静置30 min,4℃行3500 r/min离心5 min;取100μL血清加入包被好抗体的反应孔中,加HRP标记的抗体,37℃孵育1 h;洗涤液反复洗5遍;加底物显色15 min;加终止液,经酶标仪检测各样本IL-17A浓度。
1.8 组织RNA提取和qRT-PCR检测心肌组织IL-17A mRNA的表达
取“1.3”中的心脏组织1 mg,剪碎后加入1 mL Trizol,按照RNA提取步骤提取组织RNA。用核酸分析仪检测RNA浓度和纯度。选取浓度大于100 ng/μL,纯度D(260 nm)/D(280 nm)位于1.8~2.0的RNA行反转录。按照反转录试剂盒说明书反转录获得cDNA,反应条件:37℃15 min,85℃5 s,4℃保存。将获得的cDNA作为模板行qRT-PCR检测IL-17A mRNA表达。扩增条件:95℃预变性15 s,95℃变性10 s,60℃退火20 s,72℃延伸15 s,共40个循环。以GAPDH为内参,采用2-ΔΔCT法行相对定量分析。
1.9 统计学分析
实验数据采用SPSS 15.0软件和GraphPad Prism 5.0软件进行统计学分析和制图,计量数据以均数±标准差(±s)表示,组间数据比较采用单因素方差分析,进一步两两比较采用LSD-t检验,所有实验均重复3次以上。P<0.05为差异有统计学意义。
2 结果
2.1 心肌炎症损伤情况
HE染色结果显示,与对照组相比,EAM组心脏组织中以淋巴细胞为主的炎性细胞浸润增多,并且可见心肌细胞坏死;与EAM组相比,EAM+吉西他滨组小鼠心脏组织中炎性细胞浸润减少。心肌炎症评分显示,与对照组相比,EAM组心脏组织炎症评分明显升高(t=6.364,P<0.05);与EAM组相比,EAM+吉西他滨组心脏组织炎症评分明显降低(t=4.95,P<0.05)。见图1。
2.2 吉西他滨下调EAM模型鼠脾脏中MDSC和Th17的比例
如图2所示,与对照组相比,EAM组MDSC比例明显增加(t=12.43,P<0.05),Th17比例也明显增加(t=16.42,P<0.05)。但与EAM组比较,EAM+吉西他滨组小鼠脾脏中MDSC和Th17比例均明显降低(t=22.64,15.52,P均<0.05)。

图1 各组小鼠心脏组织炎性细胞浸润情况(HE染色)及炎症评分

图2 流式细胞术检测各组小鼠脾脏中MDSC和Th17比例
2.3 MDSC促进Naïve CD4+T细胞向Th17细胞分化
流式细胞术结果显示,与活化组相比,诱导组Th17细胞比例明显增加(t=8.888,P<0.05),说明IL-6和TGF-β可促进活化的Naïve CD4+T细胞向Th17细胞分化。与诱导组相比,共培养组Th17细胞比例明显增加(t=19.36,P<0.05),说明MDSC促进Naïve CD4+T细胞向Th17细胞分化。见图3。

图3 流式细胞术检测各组Th17细胞比例
2.4 吉西他滨下调EAM模型小鼠血清中IL-17A浓度和IL-17A mRNA水平
ELISA法检测结果显示,与对照组比较,EAM组血清中IL-17A浓度明显上升(t=74.36,P<0.05);与EAM组比较,EAM+吉西他滨组小鼠血清中IL-17A浓度明显下降(t=35.52,P<0.05)。见图4。
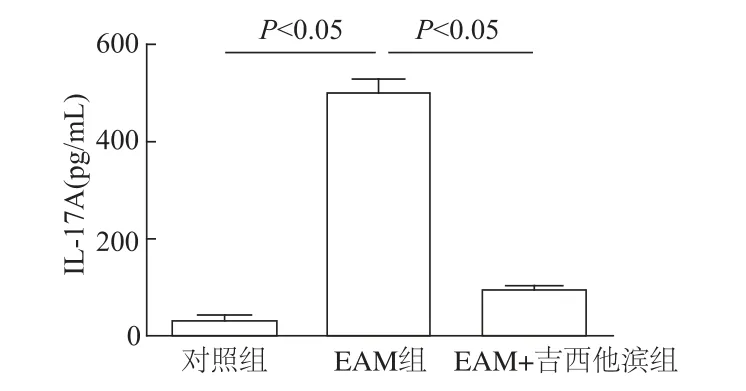
图4 ELISA法检测各组小鼠血清IL-17A浓度
qRT-PCR检测结果显示,与对照组比较,EAM组心肌组织中IL-17A mRNA表达量明显上升(t=32.00,P<0.05)。与EAM组比较,EAM+吉西他滨组IL-17A mRNA水平明显降低(t=23.27,P<0.05)。见图5。

图5 qRT-PCR检测各组IL-17A mRNA表达水平
3 讨论
心肌炎特征表现为心肌细胞变性坏死和相关炎性细胞的浸润。心肌炎和其后遗症扩张性心肌病是年轻人心力衰竭发生猝死的主要原因[13]。既往研究表明,CVB3是北美和欧洲引起病毒性心肌炎最常见的病原体之一[14-15]。EAM在组织学上与病毒性心肌炎相似,所以研究EAM可以为临床治疗病毒性心肌炎和评价预后疗效提供依据。本研究表明,吉西他滨可抑制EAM小鼠心肌炎症,但具体机制还不清楚。既往研究表明,T细胞尤其是辅助性T细胞,在心肌炎症的发生中起着重要作用[16];Th17细胞是CD4+T细胞分化的表型,分泌IL-17A和IL-6等炎症因子进而促进炎症的进展。Th17细胞在系统性红斑狼疮、类风湿性关节炎和多发性硬化等自身免疫疾病的发展中起重要作用[17-18]。既往研究表明,在EAM急性期,Th1和Th17细胞增殖并且促进炎症进展[19]。本研究结果表明,与EAM组比较,EAM+吉西他滨组Th17细胞明显降低,说明吉西他滨抑制Th17细胞从而抑制心肌炎。
MDSC是具有免疫抑制功能的未成熟骨髓细胞的异质群体,在小鼠中,MDSC在表型上定义为CD11b+Gr1+细胞,其进一步分类为G-MDSC和MMDSC,前者如CD11b+Ly6G+Ly6Clow细胞,后者如CD11b+Ly6G-Ly6Chi细胞[20]。MDSC在胶原诱导的关节炎和类风湿性关节炎的发病中发挥显著的促炎作用[21]。本研究结果显示,EAM组小鼠心脏组织中MDSC比例较对照组明显增加,说明MDSC促进EAM的进展。MDSCs在Th17极化条件下以高效方式增强幼稚CD4+T细胞前体向Th17细胞的分化,如Th17细胞数量显著增加,IL-17A 浓度升高[22-23]。本研究结果显示,MDSC与诱导的Th17细胞共培养可以促进Naïve CD4+T细胞向Th17细胞分化,并且吉西他滨可降低小鼠脾脏中MDSC和Th17比例,由此推测吉西他滨可能通过抑制MDSC进而抑制Th17细胞,从而抑制心肌炎,但其具体机制有待于进一步研究。
