Wfs1基因敲除小鼠肝脏芯片数据的生物信息学分析
2019-04-29胡瑞玮陈淑芹白宁宁张菁高新雨严寒方启晨
胡瑞玮,陈淑芹,白宁宁,张菁,高新雨,严寒,方启晨
(上海交通大学附属第六人民医院糖尿病研究所,上海200233)
WFS1基因于1998年由Inoue等首次发现,定位于染色体4p16,由8个外显子组成,长33.4 kb[1]。WFS1基因编码产物主要为内质网上的跨膜糖蛋白wolframin,该蛋白由890个氨基酸组成,相对分子质量约100 kD,含9个跨膜区,在心脏、脑、胰腺等组织有较高水平表达[2]。WFS1基因突变可导致Wolfram综合征,临床症状主要表现为尿崩症、糖尿病、视神经萎缩和耳聋,糖尿病通常为首发症状[3]。Wolfram综合征患者的寿命中位数为30岁,60%在35岁以前死亡[4]。目前WFS1基因突变的致病机制尚未完全阐明,因此,本研究对Wfs1基因敲除小鼠肝脏的芯片数据进行生物信息学分析,以探讨WFS1基因突变可能的致病机制。
1 资料与方法
1.1 资料和数据
从美国国立生物技术信息中心的Gene Expression Omnibus(GEO)数据库(https:∥www.ncbi.nlm.nih.gov/geo/)下载基因表达谱芯片数据GSE55143。该数据由Punapart等[5]于2014年上传至GEO数据库。该数据集使用Mouse Gene 1.0 ST(Affymetrix公司,美国)表达谱芯片。从中选取野生型和Wfs1敲除小鼠(16~18周龄雄性C57BL/6小鼠)肝脏组织RNA的全基因表达谱进行差异表达基因分析,两组各有8份重复数据。
1.2 数据处理及差异表达基因分析
通过GEO数据库基于R语言的交互式网络分析工具GEO2R(http:∥www.ncbi.nlm.nih.gov/geo/geo2r/),分析GSE55143中野生型和Wfs1敲除小鼠肝脏组织中的差异表达基因。将P<0.05、|logFC|>log21.5[logFC为log2(fold change)]作为差异表达基因筛选标准。
1.3 差异表达基因的富集分析
采用上海伯豪生物技术有限公司的在线富集分析网站(http:∥enrich.shbio.com/index/ga.asp)对差异表达基因进行GO(Gene Ontology)分析以及KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集分析。采用Fisher精确检验,挑选标准为差异表达基因数目≥4,P<0.05,错误发现率(false discovery rate,FDR)<0.05。
1.4 差异表达基因的蛋白质相互作用网络分析
将所有差异基因导入到STRING 10.5(Search Tool for the Retrieval of Interacting Genes/Proteins)[6]在线工具中(https:∥string-db.org/),并用Cytoscape软件进行可视化[7],获得蛋白质相互作用网络图,置信度阈值为0.4,以连接度大于10作为核心基因筛选标准。
2 结果
2.1 差异表达基因的筛选
通过GEO2R对GSE55143中野生型和Wfs1敲除小鼠肝脏组织RNA的全基因表达谱进行差异表达基因分析,筛选出198个差异表达基因。其中,与野生型相比,Wfs1敲除小鼠肝脏组织中有96个上调基因,102个下调基因。
2.2 差异表达基因的GO分析
为进一步了解这些差异表达基因的功能,对上调及下调基因进行GO富集分析,得到生物学过程、分子功能、细胞组分这3个方面的分析结果。按富集程度由高到低排序,取前5位列于表1中。富集程度定义:(某个词条中的差异基因数目/总的差异基因数目)/(数据库该词条中总的基因数目/数据库中总的基因数目)。上调基因主要涉及有机阴离子跨膜转运体活性等生物学过程和分子功能,而下调基因主要涉及芳香化酶活性等分子功能。
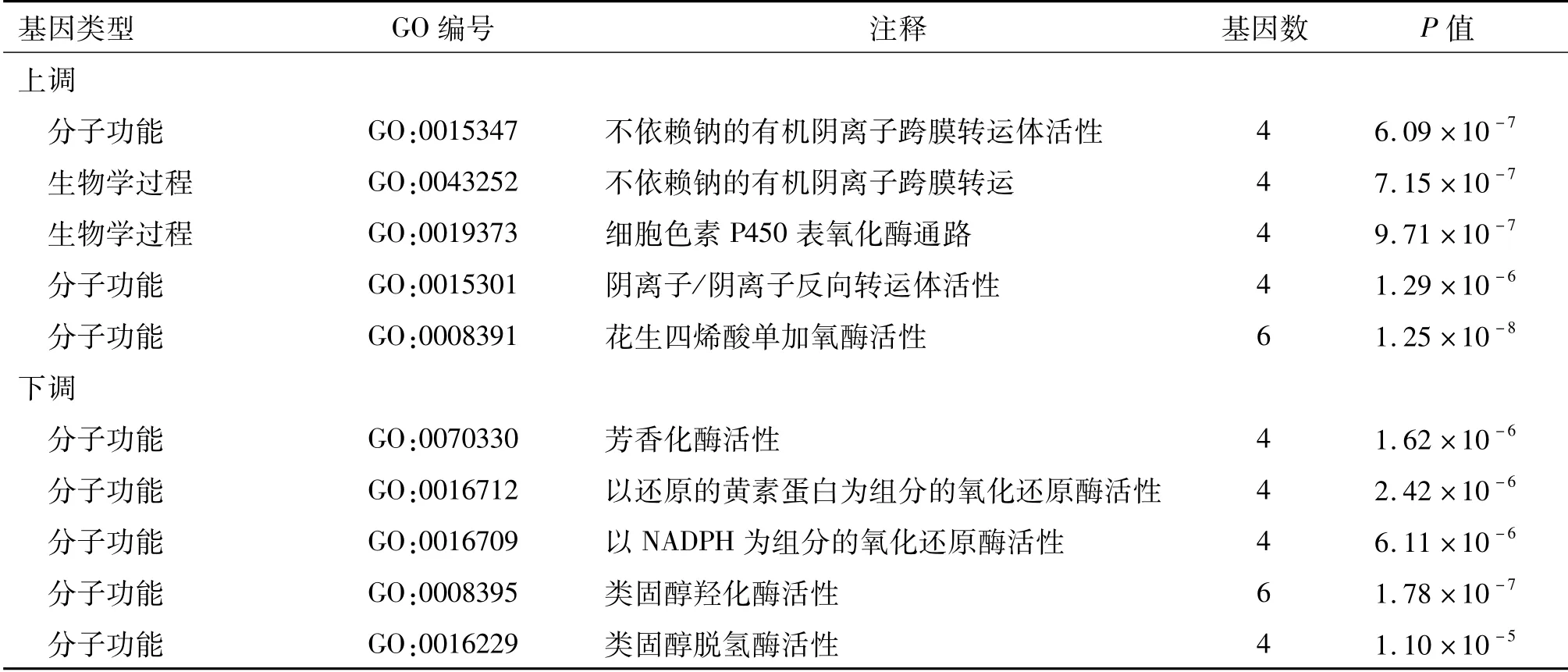
表1 差异表达基因的GO富集分析结果
2.3 差异表达基因的KEGG分析
对上调及下调基因进行KEGG通路富集分析后发现,上调基因有17条通路富集,而下调基因有9条通路富集。按富集程度由高到低排序,取前5位列于表2中。
2.4 差异表达基因的核心基因筛选
通过STRING及Cytoscape软件对差异表达基因进行分析,获得蛋白质相互作用网络图(图1)。结果显示蛋白质相互作用网络中共有180个节点,最大连接度为35,最小为1,共有26个核心基因。圆形节点和连线分别代表基因编码的蛋白质和蛋白质间的相互作用,相互作用蛋白的数目和相互作用的综合评分则分别通过圆圈大小和连线粗细表示。以相互作用蛋白的数目排序,前10位基因为Hsd3b5、Cyp2b9、Abcg2、Cyp4a12a、Cyp2b13、Lepr、Acaca、Cyp17a1、Cyp7a1、Cyp2c38。

表2 差异表达基因的KEGG富集分析结果
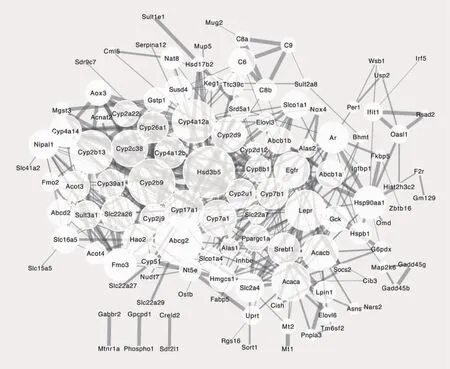
图1 蛋白质相互作用网络图
3 讨论
Wfs1基因敲除小鼠表现为血浆胰岛素水平低下,葡萄糖耐量受损[8]。然而,只有雄性Wfs1敲除小鼠表现出明显的高血糖以及体重减轻[9]。杂合子小鼠在体重和血糖水平方面与野生型之间并无显著差异[5]。此外,Wolfram综合征患者绝大多数都是纯合突变或是复合杂合突变[4]。代谢组学分析发现,与野生型小鼠相比,Wfs1敲除小鼠胰腺和肝脏有更明显的代谢改变[10]。肝脏是主要的代谢器官,发挥重要的生理及生化功能。因此,本研究对雄性Wfs1敲除小鼠的肝脏组织芯片数据进行挖掘,筛选出198个差异表达基因,其中有96个上调基因,102个下调基因。通过GO、KEGG富集分析,以及STRING、Cytoscape软件对差异表达基因进行分析后发现,差异表达基因主要集中在脂肪酸生物合成和初级胆汁酸生物合成这两个方面。
脂肪酸生物合成通路表达增高主要体现在乙酰辅酶A羧化酶1基因Acaca(t=2.704,P=1.47×10-2,logFC=0.715)、乙酰辅酶A羧化酶2基因Acacb(t=2.201,P=4.13×10-2,logFC=0.633)表达的上升。乙酰辅酶A羧化酶1催化乙酰辅酶A生成丙二酰辅酶A,参与脂肪酸合成;而乙酰辅酶A羧化酶2催化乙酰辅酶A生成的丙二酰辅酶A发挥对肉碱棕榈酰转移酶1的抑制作用,从而抑制乙酰辅酶A进入线粒体进行β-氧化[11]。ACACA和ACACB基因的表达受到碳水化合物反应元件结合蛋白(carbohydrate response element-binding protein,ChREBP)、固醇调节元件结合蛋白-1(sterol regulatory binding protein-1,SREBP-1)等多种转录因子的调控[11]。高血糖可以增加ChREBP的N-乙酰葡萄糖胺修饰[12],从而提高ChREBP的蛋白稳定性和对下游靶基因的转录活性[13]。胰岛素和胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)可以通过磷脂酰肌醇-3-激酶/蛋白激酶B通路,激活SREBP-1蛋白的转录活性[14]。Wfs1敲除小鼠胰岛素分泌障碍[15],但IGF-1表达增高[16]。本研究发现ChREBP、SREBP-1的编码基因Mlxipl(t=2.651,P=1.65×10-2,logFC=0.303)、Srebf1(t=3.748,P=1.52×10-3,logFC=0.680)在Wfs1敲除小鼠中均表达增高,提示在Wfs1敲除小鼠中,高血糖和IGF-1等代谢变化可能通过ChREBP、SREBP-1等转录因子促进脂肪酸合成通路表达增高。
初级胆汁酸由两条途径合成,经典的合成通路通过胆固醇7α-羟化酶(CYP7A1编码蛋白)这一限速酶发起,旁路途径由胆固醇 27α-羟化酶(CYP27A1编码蛋白)发起,合成胆酸与鹅去氧胆酸这两种初级胆汁酸[17]。本研究发现Wfs1敲除小鼠初级胆汁酸合成相关基因表现出下调。Cyp7a1(t=-2.546,P=2.05×10-2,logFC=-0.754)及其下游的固醇12α-羟化酶基因Cyp8b1(t=-4.836,P=1.41×10-4,logFC=-1.106)在Wfs1敲除小鼠中均明显下调;而旁路途径中,Cyp27a1在Wfs1敲除小鼠肝脏中无明显变化(t=-0.319,P=7.54×10-1),但该通路下游的胆固醇25α7羟化酶基因Cyp7b1(t=-5.929,P=1.43×10-5,logFC=-2.330)表现出了明显的下调[18]。近30年的研究表明,胆汁酸除了参与机体对食物的消化吸收外,其作为信号分子可以激活肝脏和胃肠道中特定的核受体,从而对胆汁酸、葡萄糖、脂肪酸、脂蛋白等的合成、代谢、转运发挥调控作用[19]。2型糖尿病患者餐后血浆胆汁酸的浓度、组成与健康对照相比均发生明显变化[20]。胆汁酸可作用于法尼酯衍生物X受体(farnesoid X receptor,FXR)和G蛋白偶联胆汁酸受体1(G-protein coupled bile acid receptor 1,Gpbar1/TGR5)等多种受体发挥作用[19]。肝脏FXR受体可通过小分子异源二聚体伴侣抑制肝X受体介导的SREBP-1c的转录,或通过改变细胞内胆固醇含量间接调控SREBP-1c,从而抑制脂肪生成和脂肪酸合成[21]。胆汁酸在糖代谢中也发挥着重要作用。胆汁酸结合于肠道L细胞上的TGR5受体,从而促进胰高血糖素样肽-1(glucagon-like peptide 1,GLP-1)的分泌;而结合FXR受体则对葡萄糖刺激产生的GLP-1分泌发挥抑制作用[22]。糖尿病大鼠摄入牛磺胆酸后,血浆胰岛素及GLP-1水平升高,空腹血糖水平及葡萄糖耐量均有明显改善[23]。有研究表明,GLP-1受体激动剂可以增加Wfs1敲除小鼠的胰岛素分泌,改善血糖水平,并降低胰岛中内质网应激及氧化应激相关标志物的水平[15]。
综上所述,本研究通过生物信息学的方法,对Wfs1敲除小鼠肝脏组织的芯片数据进行分析,结果提示Wfs1敲除可能影响肝脏胆汁酸合成,从而进一步影响糖脂代谢。针对胆汁酸的相关研究,或许能为WFS1突变患者的治疗提供新思路。
