精子DNA碎片化指数与体外受精-胚胎移植结局的关系
2019-04-29李天赋夏西洋卫海高亭亭龙伟周文柏陈莉
李天赋,夏西洋,卫海,高亭亭,龙伟,周文柏,陈莉
(南京医科大学附属常州妇幼保健院1.生殖医学中心,2.中心实验室,江苏 常州213003)
据WHO统计,全球约有6 000万人无法生育,占育龄人口的15%左右,其中约45%是由男性因素造成[1]。随着辅助生育技术的发展,对男性不育的认识也逐渐加深,传统的精液分析已不能满足临床需求,更多评估男性生育力的指标得到专家的重视。精子作为遗传信息的载体,其完整性对生育后代具有重要意义,精子DNA损伤作为一个反映精子质量的新指标,逐渐应用于临床[2]。精子DNA损伤是精子染色质结构异常的一个重要特征,是造成男性不育、复发性自然流产以及辅助生殖技术治疗失败的重要原因之一[3-4]。本研究拟通过测定精子DNA碎片化指数(DNA fragmentation index,DFI),分析精子DNA损伤对体外受精 胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)结局的影响。
1 对象与方法
1.1 研究对象
选取2017年3月至2018年3月在常州市妇幼保健院生殖中心就诊夫妇为研究对象。女方入组条件:①年龄≤35周岁;②确诊为输卵管因素导致不孕;③无其他妇科疾病;④其他各项常规检查无异常(如性激素6项、子宫附件B超、免疫抗体指标、病原体感染指标等)。男方入组条件:①年龄≤38周岁;②精液常规检查无明显异常;③排除梗阻性无精子症、Y染色体微缺失、生殖系统感染等疾病。所有研究对象夫妻双方染色体核型检测均正常,且均为首次进行IVF-ET治疗。
1.2 标本收集与处理
要求男方禁欲3~7 d后在医院取精室通过手淫方法留取精液。置于室温液化,记录精液体积,取部分液化后精液做精液常规、形态及精子DFI检测。常规取2 mL充分液化精液采用ISOLATE梯度液(美国IrvineScientific公司)进行密度梯度离心法处理:吸取1 mL上层离心液加入离心管底部,然后吸取1 mL下层离心液缓慢加于上层离心液之上。吸取液化后的精液缓慢加于最上层,每一步骤注意界面清晰。放入离心机以475×g离心15 min后,吸取底部的白色沉淀加入3 mL配子培养液(G-IVF PLUS,Vitrolife公司)中混合均匀,再以370×g离心9 min,弃上清液,留0.5 mL沉淀混匀,延管壁缓慢加入适量配子培养液,进一步使用上游法优选精子。
1.3 精子DNA损伤检测
采用流式细胞仪和精子核完整性染色试剂盒(浙江星博生物科技公司),通过精子染色质结构分析试验(SCSA)进行DFI检测。①平衡样品线:于流式细胞仪的样品管中加入400μL的B液和1.2 mL C液混合成平衡缓冲液,上样,使其在流式细胞仪的样品线运行15 min,以确保染色液与进样管相平衡。②显微镜下观察精子并计数。③根据计数的精子浓度,取一定量精子用A液稀释至100μL,终浓度为(1~2)×106个/mL的精子细胞。④在流式细胞仪的进样管中加入100μL上述稀释好的样本。⑤加入200μL的B液(细胞置于冰上操作),准确计时30 s之后,加入600μL C液。⑥将已经染好色的样品加入样品室,立即启动样品流。⑦检测精子的流动速度2 min后开始收集数据,至少有5 000个细胞的测定值加以记录和统计。
精子核经过酸处理液处理后,再经吖啶橙染色。异常精子核染色质为单链,与吖啶橙结合发橙黄色或红色荧光;正常精子核染色质为双链,与吖啶橙结合发绿色荧光。若红光(值)比例增高,说明精子核完整性程度降低。利用统计软件计算DFI值[红色荧光/(红色荧光+绿色荧光)]。以DFI值<15%、15%~30%、>30%将患者分成正常组、低损伤组、高损伤组。
1.4 女方IVF方案
从月经周期的第21天(排卵后1周或者服用避孕药后19天)开始注射短效醋酸曲普瑞林(达必佳),给药后第14-16天开始加用促性腺激素药物(果纳芬)进行促排卵,整个促排卵过程需要9~12 d,直到卵泡成熟,然后注射人绒毛膜促性腺激素(hCG),36~38 h后取卵。
1.5 胚胎实验室和临床结局观察指标
统计获卵数,于取卵后当天进行体外受精,16~18 h后观察受精情况,见到两个原核细胞为正常受精,受精率=受精数/获卵数;体外受精后第3天观察胚胎卵裂情况,计算卵裂率=卵裂数/受精数。统计优质胚胎数,得到优胎率=优质胚胎数/卵裂数。受精后第5天观察囊胚情况,统计囊胚形成率=可用囊胚数/卵裂数。本研究所有入组方案,均进行冻胚移植,移植第35天,进行B超检查确定是否妊娠,妊娠率=妊娠数/每组人数,追踪病例至妊娠结束,统计流产率=流产数/妊娠数。
1.6 统计学分析
应用SPSS22.0软件进行统计学分析,3组计量资料符合正态分布,以±s表示,3组间获卵数、正常受精率、卵裂率、优胎率、囊胚形成率比较均选用单因素方差分析,两两比较采用LSD-t检验;妊娠率、流产率比较采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 一般情况比较
共收集158对患者,根据纳入标准,并力争减少组间差异,最终纳入90对病例。3组之间男女双方年龄、男方精液常规指标、女方获卵数无明显差异(P>0.05)。见表1。
2.2 胚胎实验室指标与临床结局比较
3组间受精率、卵裂率均无明显统计学差异(P>0.05);与正常组相比,高损伤组的优胎率和囊胚形成率明显降低(P<0.05),低损伤组的囊胚形成率明显降低(P<0.05)。移植第35天B超及回访追踪妊娠结局显示,与正常组相比,高损伤组的妊娠率明显降低(χ2=4.356,P<0.05);而3组间的流产率则无明显差异(χ2=0.078,P>0.05)。见表2、表3。
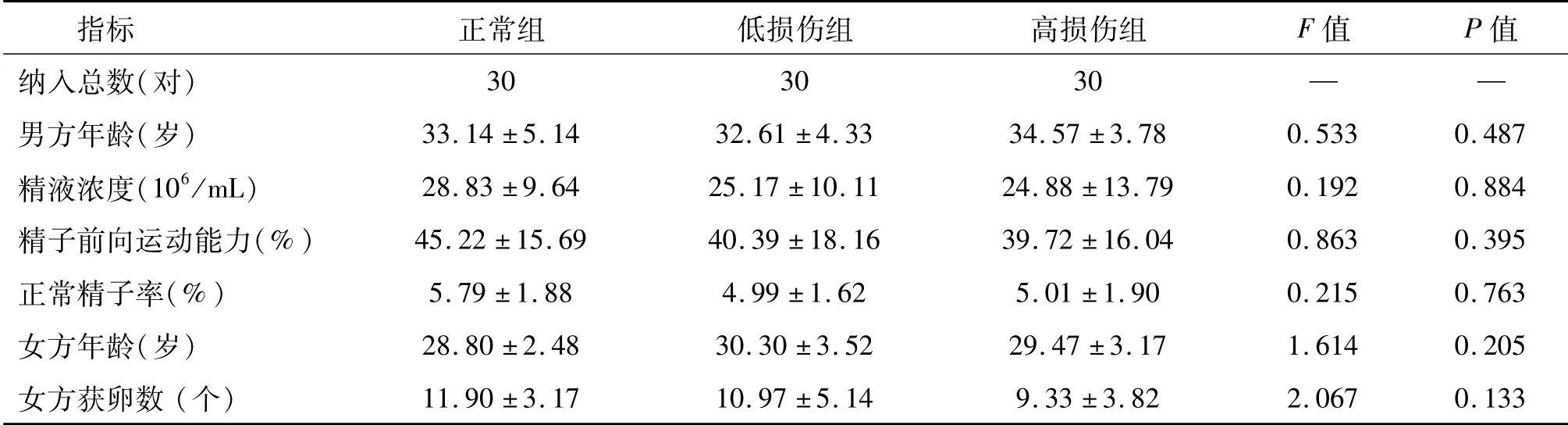
表1 3组患者一般情况比较

表2 3组实验室观察指标比较
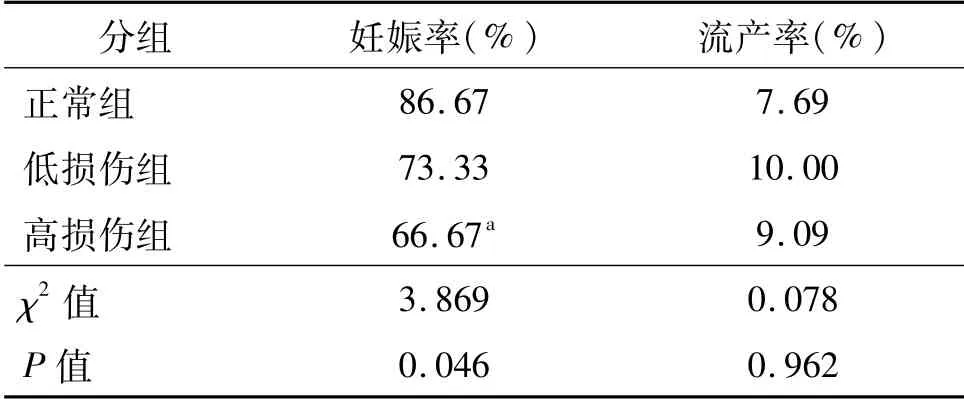
表3 3组临床结局指标比较
3 讨论
精子DNA承载了男性的遗传物质,其染色质结构关系到精子的受精能力、胚胎发育情况以及临床妊娠能否顺利进行[5]。精子DNA损伤导致的精子染色质结构异常,是引起男性不育、辅助生殖治疗失败、反复流产的重要原因。造成精子DNA损伤的因素很多,各种原因导致的精子形成过程中的细胞凋亡、氧自由基产生、氧化应激反应以及染色质包装异常等[6-8],都可能影响精子DNA的完整性。另外,环境污染、全身其他系统疾病、生活方式、药物使用等也会引起精子DNA的损伤[9]。
目前检测精子DFI的实验方法很多,主要包括:末端转移酶介导的dUTP末端标记法(TUNEL)、精子染色体扩散实验(SCD)、精子染色质结构分析试验(SCSA)、单细胞凝胶电泳(SCGE)、荧光原位杂交技术(FISH)、基因芯片技术等。SCD法方便快捷,但受实验人员主观操作影响较大,且无法评估受损程度;TUNEL法敏感性高,结果准确,但操作复杂,成本较高且缺乏临床标准化流程;SCSA具有较高敏感性和可重复性,各临床中心目前大多使用此法,但最近有学者指出该方法存在设门随意、计算方法有误等问题[10]。本研究使用的是目前各大生殖中心普遍采用的SCSA法,该方法检测方便、检测结果可以被其他中心认可,目前仍是精子DFI检测的首选方法。
一项荟萃分析指出,检测精子DNA损伤的方法与受精率、卵裂率等实验室指标无明显相关[11]。有学者发现,精子DNA损伤与男性生育能力呈负相关性,影响自然生育能力,但与受精率、妊娠率无明显相关性[12-13];同时有多项研究表明,DFI与受精能力、胚胎发育、临床妊娠结局以及辅助生殖技术治疗效果呈显著相关[14-15]。正常精子率作为男性精液检查一项重要项目,与DFI的关系也存在争议[6,16-17]。本研究发现,与正常组相比,低损伤组和高损伤组的精液浓度、前向运动能力、正常精子率均无明显差异。同时,3组间的受精率、卵裂率也无统计学差异,原因可能与胚胎发育初期主要受卵子DNA调控有关[18]。而优胎率、囊胚形成率、妊娠率这几项指标,高损伤组明显低于正常组,说明父源性DNA在胚胎发育过程中逐渐开始发生作用,并最终影响了临床结局。本研究中3组的流产率无明显差异,可能与每组流产数过低有关。
综上所述,精子DNA损伤指标DFI对临床判断男性生育能力、预判辅助生育结局具有一定的指导意义,因此建议各医院男科以及生殖中心开展此类检查。同时期待有更标准化的DFI检测技术流程,以降低检测过程中人为因素造成的DFI偏差所带来的临床不良结局。
