小鼠休眠胚胎与正常胚胎冻融后体内外发育潜力的比较
2019-04-28陈超磊芦天罡倪和民盛熙晖王相国齐晓龙邢凯刘云海郭勇
陈超磊,芦天罡,倪和民,盛熙晖,王相国,齐晓龙,邢凯,刘云海,郭勇
(北京农学院动物科学技术学院,北京 102206)
胚胎休眠现象最早发现于一些野生哺乳动物中,是指动物交配受精后,受精卵发育至胚泡阶段后游离于着床部位,但不立即发生着床,而是延缓一定时间后再植入处于容受态的子宫,继续完成其后的着床发育的现象。由于着床是处于窗口期的胚胎与处于容受态子宫的相互作用的过程,研究胚胎的休眠现象是研究胚胎着床机理的重要内容之一,并可为辅助生殖技术提供必要的参考。目前,对于小鼠休眠胚胎的研究都集中在揭示胚胎休眠现象的分子机理以及与之相关的胚胎着床的分子调控上,例如张劭俣等[1]对程序化冷冻的小鼠休眠胚胎和正常休眠胚胎进行了基因芯片扫描,结果发现存在228个差异表达基因,其中50个基因表达上调,178个基因表达下调,卢文谨等[2]研究发现LYZ1 蛋白在休眠模型小鼠胚胎中为抵御外界不利环境而上调;刘迪等[3-4]研究发现C3,Hba-α基因很可能参与了胚胎抗冻过程的相关调控等等。但在休眠胚胎应用方面的研究较少。小鼠休眠胚胎是一个很好的研究应用模型。当前,休眠胚胎尽管可以保存一定的时间,但非常有限。而实际生产应用则需要能够长期保存即冷冻保存,以达到保存的目的。研究休眠胚胎的冷冻效果是休眠胚胎研究走向应用的重要步骤,可为改进大家畜的辅助胚胎工程技术提供一定参考。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级ICR系小鼠30只,6 ~ 8周龄,体重25 ~ 30 g;雄鼠8周龄以上,体重30 ~ 35 g,动物均购自北京维通利华实验动物科技有限公司【SCXK(京) 2014-0008】, 实验操作在北京农学院屏障动物实验室内进行【SYXK(京) 2015-0004】。
1.1.2 实验试剂
甘油(glycerol),孕酮(progesterone,P4),牛血清白蛋白(BSA),抗羊脾细胞抗血清(anti-sheep whole serum),豚鼠补体(guinea pig complement serum),碘化丙啶(propidium iodide,PI),聚乙烯醇(polyvinyl alcohol,PVA),bisbenzimide(Hoechst33342),胚胎冷冻液购自ICPbio Reproduction,胎牛血清(FBS)为美国Sigma公司产品,葡萄糖、NaCl等无机试剂均为国产优级纯产品。
1.2 方法
1.2.1 胚胎的获取
休眠胚胎的获取:妊娠小鼠见栓的第4天上午 9:00 时摘除双侧卵巢保留输卵管,连续3 d颈部皮下注射 0.1 mL孕酮(0.2 mg/mL),见栓第8天收集休眠胚胎;孵化期胚胎的获取:于见栓第5天12:00时冲出受孕母鼠子宫内的胚胎。
1.2.2 冷冻方法
将获取的胚胎先用PBS (pH7.4)清洗两遍,然后依次用含1/3的冷冻液,1/2的冷冻液,2/3的冷冻液的PBS清洗,随后在冷冻液中清洗三遍,然后用0.25 mL的塑料细管按冷冻液(2.5 cm)→空气(1.0 cm) →冷冻液(2.5 cm)→空气(1.0 cm)→含有胚胎的冷冻液(3.0 cm)→空气(1.0 cm)→冷冻液(2.5 cm) → 空气(1.0 cm)→冷冻液(2.5 cm)制备冻存胚胎细管。提前在冷冻仪内放入液氮, 把装好的细管放入程序冷冻仪中,以1℃/min的速度降到-5℃时,使其在平台期平衡10 min,然后迅速取出细管并在两端制冰,再平衡10 min。然后以0.3℃/min的速度直至降到-35℃。随后置于液氮保存备用。
1.2.3 解冻与培养方法
从液氮中取出冷冻细管,室温轻晃动8 s左右,置于35℃水中15 s左右取出,用酒精棉处理细管之后用吸水纸擦干,剪掉细管两端,冲出胚胎,按三步脱除甘油法脱去冷冻液。胚胎解冻后分别置于小鼠胚胎培养液小滴中,石蜡油覆盖,在CO2培养箱中培养,培养24 h后在显微镜下观察和记录各组胚胎发育情况,显微照像记录。
1.2.4 移植方法
首先将假孕母鼠(正常母鼠与结扎公鼠交配)麻醉。于背腰侧消毒杀菌后剪开皮层,取出一侧子宫,用眼科镊子夹住子宫与输卵管的结合部使子宫与鼠体成45度角,另一用4号针头入子宫腔,上下轻轻移动以确认针头未扎入子宫腔内壁,迅速沿针眼将移植枪扎入将卵吹入子宫内。子宫轻推回小鼠体内,进行术后缝和,伤口消毒。注意保温,观察并记录出生情况。
1.2.5 双重荧光染色
(1) 染料准备
染料储液:1 mg染料+1 mL双蒸水;染料工作液:4 μL染料储液+10 μL 95%乙醇+36 μL 2.3%柠檬酸钠。
(2) 双重荧光染色步骤
清洗胚胎:首先用含0.1% PVA的PBS清洗胚胎3次,每次间隔3 min,确保清洗干净无血清残留;结合抗体:将胚胎放入含抗血清的PBS(5 μL抗血清+25 μL PBS)小滴中反应30 min,使其充分结合抗体;随后将胚胎用含10% FBS的PBS中处理5 min,以便结束抗体反应;清洗胚胎:用含0.1% PVA的PBS清洗3次;结合补体和染色:将胚胎置于含有补体和两种染料的PBS(5 μL补体+2 μL PI+2 μL Hoechst 33342+21 μL PBS)小滴中避光反应90 min;压片与观察:清洗胚胎,洗掉多余染料和杂质。吸出胚胎移至事先做好的载玻片微滴,用凡士林支撑4周,盖玻片压片,在荧光显微镜下观察,在蓝色滤光片下内细胞团呈蓝色,滋养层细胞呈粉色。
1.3 统计学方法

2 结果
2.1 胚胎冷冻结果
从表1中可以看出休眠胚胎的回收率极显著高于孵化期胚胎(72.1% vs 50.2%,P< 0.01)。各组胚胎冷冻后形态见图1,2。
2.2 胚胎冻融后体外复苏培养结
从表2中可以看出休眠胚胎的继续发育率极显著高于孵化期胚胎(94.2% vs 73.9%,P< 0.01)。各组胚胎培养后形态见图3。
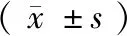

组别Groups解冻胚胎数(枚)No. of thawed embryos回收数(枚)No. of recovery回收率(%)Recovery rate of embryo形态完整数(枚)No. of recovery embryos可用率(%)Available rate of embryo休眠胚胎Dormant embryo36528880.9a26372.1a孵化期胚胎Hatched embryo31923874.6a16050.2b
注:表中同列字母不同表示差异有显著性(P< 0.05);字母相同表示差异无显著性(P>0.05)。(下表同)
Note. Different letters indicate significant differences among them(P< 0.05), the same letters indicate no significant differences among them (P> 0.05).(The same in the following tables)

表2 胚胎冻融培养后发育率Table 2 Development rates of embryos after frozen-thawing
2.3 胚胎冻融后移植结果
从表3中可以看出休眠胚胎的产子率显著高于孵化期胚胎的产仔率(40.8% vs 30.1%,P< 0.05)。
2.4 胚胎细胞计数结果
从表4中可以看出,休眠胚胎的内细胞团细胞数显著高于孵化期胚胎的(27.83 vs 19.53,P< 0.05),两种胚胎的滋养层细胞数无差异。冻融,培养后休眠胚胎的内细胞团数显著高于孵化期胚胎的(25.18 vs 14.68,P< 0.05),滋养层细胞数也显著高于孵化期胚胎(114.09 vs 73.88,P< 0.05)。冻融,培养前后休眠胚胎内细胞团(ICM)数和滋养层细胞(TE)数差异均不显著,培养后孵化期胚胎的内细胞团和滋养层细胞数都显著低于冷冻前的。各组胚胎双重染色照片见图4。

图1 小鼠正常胚胎(A)与休眠胚胎(B)(×20)Figure 1 Normal(A) and dormant(B) embryos of mice (×20)
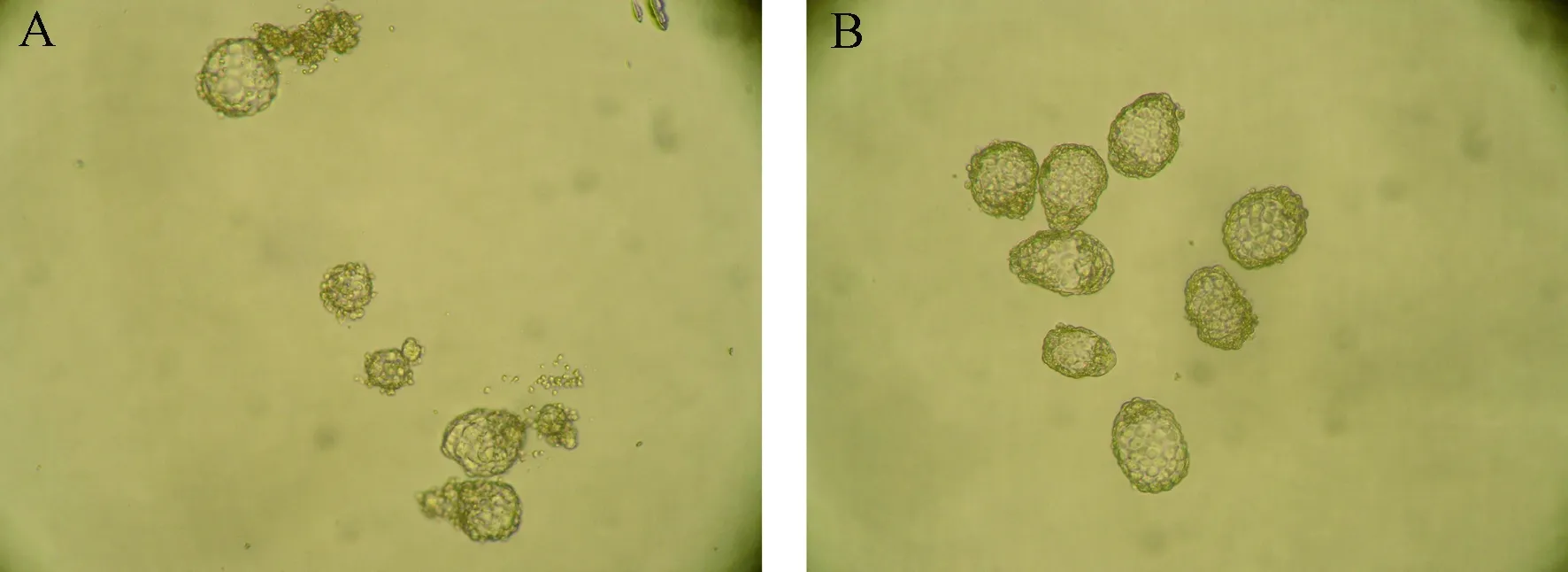
图3 解冻后培养1 d后的小鼠孵化期胚胎(A)和休眠胚胎(B)(×10)Figure 3 Hatched (A) and dormant(B) embryos at one day after thawing (×10)
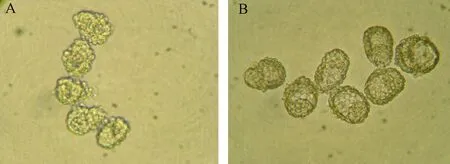
图2 解冻后小鼠孵化(A)和休眠(B)胚胎Figure 2 Hatched (A) and dormant(B) embryos of mice after thawing (×20)

图4 小鼠孵化胚胎(A)和休眠胚胎(B)双重染色(×60)Figure 4 Double staining of mouse hatched(A) and dormant(B) embryos(×60)

表3 胚胎冻融后移植产子率Table 3 Procreation rate of mice after embryo transplantation
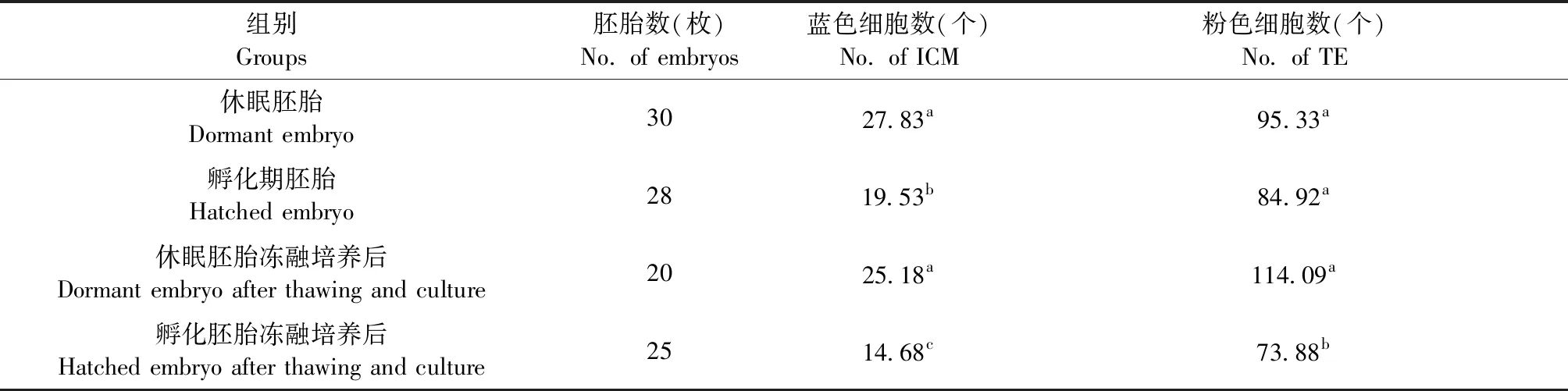
表4 胚胎冻融前后的细胞数Table 4 Number of cells in the embryos before and after freeze-thawing
3 讨论
研究发现哺乳动物大量的胚胎损失发生在着床前后,因而胚胎着床一直是研究哺乳动物生殖调控机理的关键[5-7]。胚胎在发育过程中受多种激素、生长因子以及各种酶的影响。20世纪60年代,科学家发现哺乳动物为了更好地繁衍生息而进化产生胚胎延迟着床现象[8],胚胎延迟现象的发现及深入研究,不仅有助于人们更为深入的了解胚胎着床过程的分子调控机制;同时,延迟着床模型的广泛应用,也提供了一种新的研究着床窗口,分子网络开启与关闭的有效手段,对不孕症的治疗、相关药物的开发及动物的繁殖成功率的提高等都有重要的现实意义。因此针对哺乳动物的休眠胚胎进行较广泛的相关生物学研究具有一定的理论意义和潜在应用价值[9-10]。
休眠胚胎和正常孵化期胚胎的回收率均较低,分析其原因可能两者同时处于孵化阶段没有透明带的保护,在操作过程中很易破碎或黏附在细管管壁上。Marti等[11]认为冷冻对细胞膜、胞质及细胞连接有损害。Tao等[12]认为,胚胎骨架可增加胚胎的结构完整性,较好地耐受冻融过程中渗透压的改变。顾美超等[13]研究表明小鼠休眠胚胎的亚细胞超微结构比其正常孵化胚胎更具抗冻性。Hmatani等[14]通过检测休眠和激活的胚胎中的2万个基因表达情况,发现其中有229个基因表达存在差异。这些基因主要参与细胞周期调控、信号转导和能量代谢等通路。从冻融回收胚胎的形态完整数和形态完整率方面来看,休眠胚胎显然优于正常孵化胚胎。分析其原因,可能是较孵化期胚胎休眠胚胎在休眠期间一方面通过积累更多的营养物质,另一方面通过不断调节自身的结构及能量代谢来适应外界不利环境,进而能够较快的恢复正常形态并且继续发育。
国内外报道的小鼠囊胚或孵化囊胚冷冻后移植产仔率在30% ~ 45%之间[15-16]。本实验中休眠胚胎的冻融后移植产仔率为40.8%,显著高于孵化期胚胎的30.1%,说明休眠胚胎经过冻融后体内发育潜力要优于正常活化胚胎。分析其原因可能与冷冻方法,操作者的胚胎移植技术方法,冻融的胚胎时间等等有关。对于冻融结局的影响,除了种属、冷冻保护剂和冷冻方法外,胚胎的发育阶段尤为重要。因为在胚胎的不同发育阶段,其代谢变化伴随着细胞浆和冷冻保护剂之间的相互作用而变化。因此,不同发育阶段的胚胎对同一种冷冻方法的作用结果有一定差别[17]。
从双重染色结果来看[18],休眠胚胎的ICM细胞数极显著高于孵化期胚胎的ICM细胞数。而TE细胞数则差异不显著。表明休眠胚胎在延迟着床过程中内细胞团有一个持续增殖过程,而滋养层细胞则处于基本稳定。这与Given等[19]的研究结果一致,其通过测定小鼠胚胎延迟着床后一定时间内的DNA合成,结果发现在一定时间内内,ICM细胞的DNA合成一直处于较高水平,而TE细胞的DNA合成则在卵巢摘除手术24 h后有一个大幅度的降低,并在其后维持在较低水平。由于内细胞团将会发育成胎儿,因而内细胞团的定量测定能够比较准确地地预估囊胚的植入潜能,不断增大的内细胞团数目与胚胎的着床率有一个近乎线性的增长关系,即内细胞团的发育与其移植后胎儿的发育能力呈正相关[20]。而囊胚的直径和滋养层细胞数与着床率无直接关系[21]。所以这一结果可以从一个侧面说明休眠胚胎在胚胎质量上要优于孵化期胚胎。
休眠胚胎冻融培养前后的ICM和TE细胞数均无差异,而孵化胚胎ICM和TE细胞数都显著高于解冻培养后的相关值,说明冷冻处理对孵化期胚胎破坏较大,在染色过程中发现各细胞之间连接较为松散,容易造成丢失,并且在冻融后的培养过程中细胞恢复和发育潜力较休眠胚差。本实验中休眠胚胎与正常胚胎的ICM/TE比值分别为0.3和0.22,此结果要小于前人的 0.6,这是因为胚胎处于围着床期时,内细胞团数的增加会减慢并出现一个凋亡的波峰,结果是内细胞团数占总细胞数的比例会随着囊胚的不断扩张、孵化和开始着床而不断下降[22]。 Vander等[23]发现小鼠5 d扩张囊胚的总细胞数与内细胞团和滋养层细胞的比率(ICM/TE)呈负相关,以上结果都与本实验结果相一致。
综上所述,通过对小鼠正常孵化胚胎和休眠胚胎冻融后体内外发育潜力的比较,我们发现休眠胚胎抵御冷冻的能力以及冻融后体外和体内发育潜力均优于孵化期胚胎。休眠胚胎的抗冻能力不仅与其细胞结构和细胞连接有关,其中还涉及许多尚不明确的细胞调控通路,尚需进一步深入研究。
