二苯乙烯苷抑制NADPH氧化酶对小鼠脑缺血/再灌注损伤的保护作用
2019-04-28薛威唐虹孙雨倩江勤黄大可董六一
薛威,唐虹,孙雨倩,江勤,黄大可,董六一*
(1. 安徽医科大学药理学教研室 抗炎免疫药理学教育部重点实验室 国家中医药管理局中药药理三级实验室; 2. 安徽医科大学临床医学院; 3. 安徽医科大学基础医学院,合肥 230032)
脑卒中是具有高发病率和死亡率的神经系统疾病之一,严重威胁人类健康,80%的脑卒中是缺血性的[1-2]。脑缺血后,再灌注会进一步加重脑组织损伤,据报道,缺血再灌注(ischemia reperfusion, I/R)损伤的一个关键机制是氧化应激[3-4]。氧化应激的主要原因是ROS的积累,过度的ROS诱导细胞膜和线粒体膜的损伤,以及DNA的降解,最终促使细胞凋亡[5]。NADPH氧化酶(NADPH oxidase,NOX)是脑I/R损伤中活性氧(reactive oxygen species, ROS)的主要来源。中枢神经系统表达的NOX有 NOX1、NOX2、NOX4,而NOX4在脑I/R损伤中扮演着最为重要的角色[6]。参与氧化应激的主要ROS包括超氧阴离子、过氧化氢和羟基自由基,而NOX4主要产生过氧化氢[7]。因此,降低NOX4的水平对于脑I/R损伤具有很大的治疗意义。
二苯乙烯苷(tetrahydroxystilbene glucoside,TSG)是中药何首乌中特有的具有显著药理活性的水溶性有效成分,研究表明其具有抑制粥样硬化、防治老年性痴呆、抗肿瘤、保护脑组织等多种功能[8-10]。吴晓玲等[11]研究发现:TSG可以提高大鼠体内SOD含量和降低MDA含量减轻脑组织氧化应激损伤。梅劲春等[12]发现:用TSG治疗大鼠糖尿病肾病后,氧化应激指标ROS及MDA水平降低,SOD水平升高,肾间质纤维化减轻。这些研究结果提示,TSG可清除氧自由基,可有效对抗氧化应激损伤,具体的作用机制有待进一步阐明。本研究主要探讨TSG是否通过抑制NOX4的活性从而减轻小鼠脑I/R后的氧化应激损伤作用。
1 材料与方法
1.1 材料
1.1.1 实验动物
5周龄SPF级雄性KM小鼠,体重22 ~ 24 g,购于安徽医科大学省级实验动物中心【SCXK(皖)2011-002】,饲养与实验均在安徽医科大学实验动物中心屏障环境中进行【SYXK(皖)2011-007】,并按实验动物使用的3R 原则给予人道的关怀。温度范围22 ± 3℃,湿度范围:40% ~ 70%,照明周期:12 h明/12 h暗,自由摄水进食。
1.1.2 药品与试剂
二苯乙烯苷(纯度:98%,批号:20170502,南京道斯夫生物科技有限公司,中国),水合氯醛(批号:T20150610,国药集团化学试剂有限公司,中国),0.9%氯化钠注射液(批号:170705074,上海华源制药股份有限公司,中国),RIPA蛋白裂解液(Beyotime Institute of Biotechnology,中国),PMSF(Sigma公司,美国),BCA蛋白浓度测定试剂盒(Beyotime Institute of Biotechnology,中国),SDS-PAGE凝胶配制试剂盒(Beyotime Institute of Biotechnology,中国),预染蛋白marker(Thermo Fisher Scientific公司,美国),兔来源NOX4一抗、兔来源cleaved caspase-3/9 一抗、内参β-actin(CST公司,美国),辣根酶标记山羊抗小鼠lgG二抗和山羊抗兔lgG二抗(北京中杉金桥生物技术有限公司,中国),SuperSignal West Femto高灵敏度发光试剂盒(Thermo Fisher Scientific公司,美国)。
1.1.3 仪器设备
超低温冰箱(Sanyo Electric CO. Ltd,日本),TGL-16H高速离心机(珠海黑马医学仪器有限公司产品,中国),DIAX-900内切式组织匀浆机(Heidolph公司,德国),TE300 型倒置显微镜(Nikon 公司,日本),SpectraMax190酶标仪(Molecular Devices,USA),石蜡切片机(Leica,德国),WD-9405B水平摇床(北京市六一仪器厂,中国),Bioshine ChemiQ4600荧光及化学发光成像系统(上海欧翔科学仪器公司,中国),JES-FA20000 spectrometer(JEOL)型ESR波谱仪(日本电子,日本)。
1.2 方法
1.2.1 小鼠急性脑缺血再灌注损伤模型建立
将100只实验小鼠随机分成5组:假手术组、模型组、二苯乙烯苷剂量组(3、6、12 mg/kg),每组20只,给药体积为0.01 mL/g。适应性喂养5 d后,进行手术造模。所有小鼠术前禁食不禁水12 h。小鼠放入麻醉箱中给予1.33%(一个肺泡浓度)的异氟烷麻醉15 min后固定,分离双侧颈总动脉,并穿以6号线。在结扎之前将给药组小鼠通过尾静脉注射TSG一次,随即结扎双侧颈总动脉30 min后再经尾静脉注射给药一次,结扎2 h后,松开丝线进行再灌,24 h后处死小鼠。假手术组仅做颈动脉分离,不做结扎处理,且假手术组和模型组仅给予等量的生理盐水。
1.2.2 病理组织学检查
小鼠脑缺血再灌注后,处死取脑,每组取4个小鼠脑组织置于4%多聚甲醛中固定。经石蜡包埋制成切片,进行苏木精-伊红(HE)染色,BX-51型正置显微镜观察小鼠脑组织病理变化。
1.2.3 脑组织氧自由基检测
小鼠造模成功后,颈椎脱臼处死,取出大脑(去除小脑和脑干,每组8个小鼠大脑),迅速将缺血区脑组织装入内径2 mm的薄壁聚乙烯塑料管中,并迅速放入液氮中待测。将JES-FA20000 spectrometer(JEOL)型ESR波谱仪谐振腔温度调整到130 K,从液氮中取出脑组织标本迅速放入ESR谐振腔内,测试ESR波谱,利用专用软件分析氧自由基信号情况。
1.2.4 DHE染色法检测脑组织中ROS水平
实验开始前,将-20℃保存的染色液(reagent B)放入冰槽里融化,稀释液(reagent C)置于室温预热。移出10 μL染色液(reagent B)到新的1.5 mL离心管,加入990 μL稀释液(reagent C),混匀后,配成染色工作液,避光待用。小鼠缺血再灌注后,断头取脑(每组4个小鼠大脑),用冰冻切片机切制成10 μm的冰冻切片,小心加上500 μL预冷的清理液(reagent A),铺满整个切片表面。移去切片上的清理液(reagent A)后,加上200 μL室温预热的染色工作液,在37℃湿润培养箱里,孵育20 min。避光除去染色工作液后,在整个切片表面加上500 μL清理液(reagent A),除去切片上的清理液(reagent A)后封片,即刻在荧光显微镜下观察。
1.2.5 Western blot检测蛋白表达水平
采用 Western blot分别检测小鼠缺血侧大脑皮层组织中NOX4通路相关蛋白和caspase-3/9 蛋白表达的变化(每组4个小鼠大脑)。利用Bioshine ChemiQ 4600荧光及化学发光成像系统显影后,使用Image J分析软件计算蛋白条带灰度值。
1.3 统计与分析

2 结果
2.1 TSG对小鼠脑I/R损伤后脑组织病理学变化的影响
在显微镜下观察发现(图1),假手术组小鼠脑皮质神经元细胞排列整齐,形态正常且细胞数较多。模型组小鼠脑皮层神经元细胞数量减少,疏松呈网状(黄色箭头所示),胞核深染(红色箭头所示)等病理性改变。TSG高、中剂量治疗组能够明显减轻小鼠脑皮层神经元的病理性损伤,增加神经元细胞数量,改善神经元细胞形态,减轻核固缩。TSG低剂量组神经元的病理性损伤未得到明显改善。
2.2 TSG对小鼠脑I/R损伤后脑组织中氧自由基代谢的影响
结果见表1,与假手术组相比,模型组小鼠脑组织中氧自由基生成明显增加,其氧自由基信号值与假手术组比较呈显著性差异(P< 0.01);与模型组比较,TSG 12.0、6.0、3.0 mg/kg 可显著抑制小鼠脑组织氧自由基生成,其氧自由基信号值显著下降(P< 0.01或P< 0.05)。

注:A.假手术组;B.I/R组;C.TSG(12.0 mg/kg)组;D.TSG(6.0 mg/kg)组;E.TSG(3.0 mg/kg)组。图1 TSG对小鼠脑I/R损伤后大脑皮层脑组织病理学损伤的影响(×200)Note. A: Sham group. B: I/R group. C: TSG(12.0 mg/kg)group. D: TSG(6.0 mg/kg)group. E: TSG(3.0 mg/kg)group.Figure 1 Effects of TSG on pathological damages in brain tissues after I/R injury in the mice(×200)
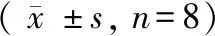
表1 二苯乙烯苷对小鼠脑I/R损伤后脑组织氧自由基代谢的影响Table 1 Effects of TSG on metabolism of oxygen free radicals in brain tissue after cerebral I/R injury in the
注:##P< 0.01 vs假手术组;*P< 0.05,**P< 0.01 vs模型组(I/R)。
Note.##P<0.01, vs the sham group.*P< 0.05,**P< 0.01, vs the model (I/R) group.
2.3 TSG对小鼠脑I/R损伤后脑组织中ROS水平的影响
DHE 染色结果显示,小鼠脑缺血再灌注后,与假手术组相比,模型组小鼠大脑皮质缺血区ROS水平显著增加, TSG (12.0、6.0、3.0 mg/kg) 剂量组小鼠脑皮质缺血区ROS水平较模型组显著降低。提示TSG 可抑制缺血再灌注损伤小鼠大脑皮质ROS的生成。(见图2)
2.4 TSG对小鼠脑I/R损伤后脑组织中NOX4蛋白表达的影响
小鼠脑缺血再灌注24 h后与假手术组相比,模型组小鼠大脑皮层缺血区NOX4蛋白表达显著上调(P< 0.01),TSG 12.0 mg/kg和6.0 mg/kg 可显著抑制小鼠大脑皮层缺血区NOX4蛋白的表达,减轻小鼠脑缺血再灌注引起的氧化应激损伤。结果提示TSG可抑制缺血再灌注损伤小鼠缺血区大脑皮质NOX4蛋白表达的增高。(见图3)
注: ##P < 0.01 vs假手术组;*P <0.05,**P < 0.01 vs模型组(I/R)。图3 TSG对小鼠脑I/R损伤后脑组织中NOX4蛋白表达的影响Note. ##P < 0.01 vs the sham group. *P < 0.05,**P <0.01 vs the model (I/R) group.Figure 3 Effects of TSG on the expression of NOX4 protein in brain tissue after I/R injury in the mice
2.5 TSG对小鼠脑I/R损伤后脑组织中凋亡相关蛋白表达的影响
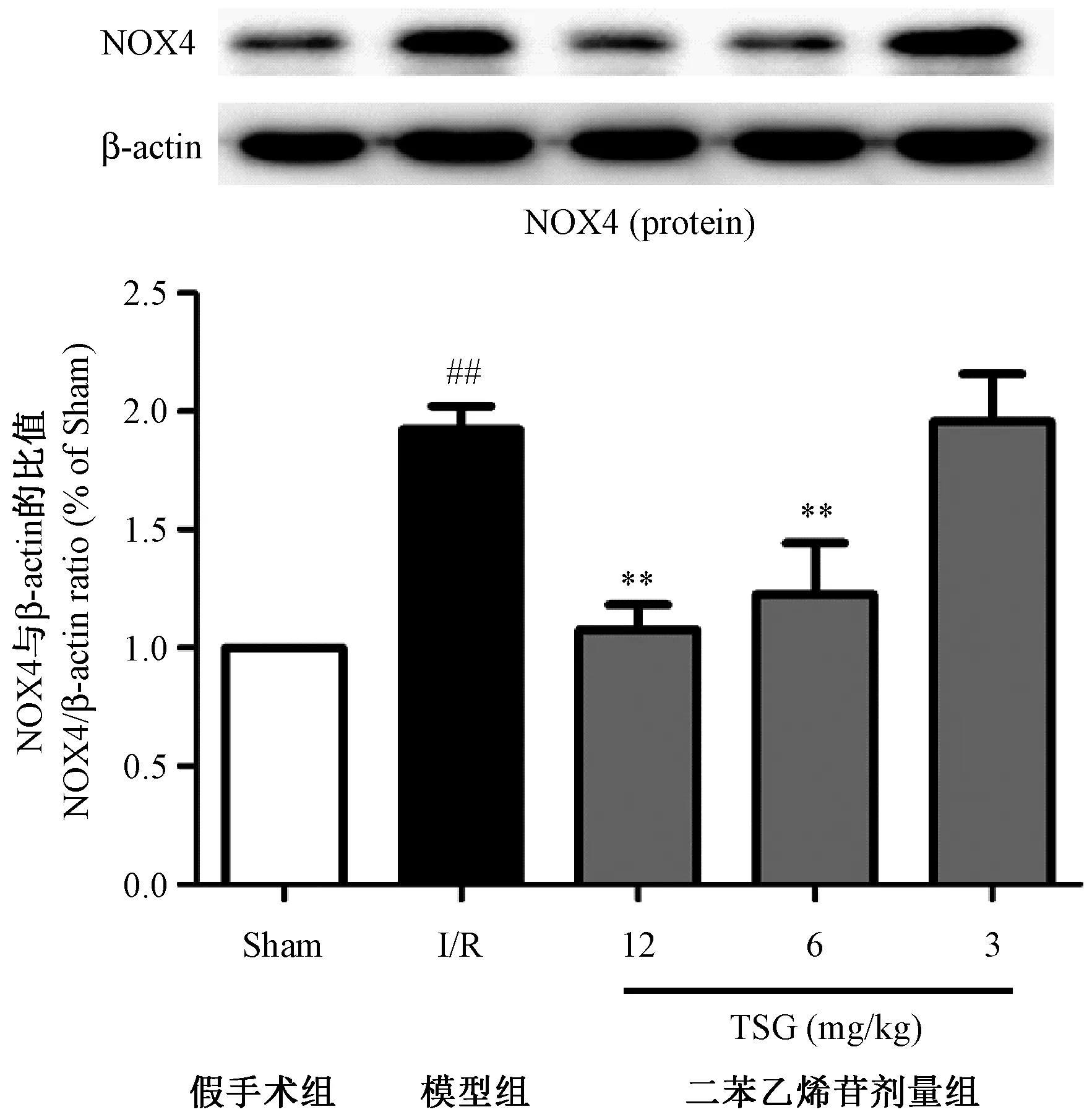
小鼠脑缺血再灌注24 h后,与假手术组相比,模型组小鼠缺血区皮层组织凋亡相关蛋白caspase-3/9活化增加,剪切后的caspase-3/9蛋白表达显著增多(P< 0.01),TSG 12.0 mg/kg可显著抑制小鼠缺血区皮层组织凋亡蛋白caspase-3/9的活化,从而抑制神经元细胞的凋亡。(见图4)
3 讨论
二苯乙烯苷(TSG)化学名为2,3,5,4-四羟基二苯乙烯-2-O-β-D-葡萄糖苷,其结构与白藜芦醇相似,仅二位多一个酚羟基并形成了糖苷,均属于二苯乙烯类[13]。在心脑血管方面,Liu等[14]发现TSG的酚羟基通过给出氢原子,自身形成二聚体,从而清除1,1-二苯基-2-三硝基苯肼(DPPH)自由基,进而发挥抗氧化作用。此外,TSG可以抑制脑I/R所导致的NMDA受体结合力及神经细胞内钙离子浓度的升高,具有脑保护作用。
大量研究表明,脑缺血后再灌注会进一步加重脑组织损伤,抑制再灌注损伤是治疗缺血性脑血管疾病的重要环节[15-16]。尽管缺血性损伤的病理生理学是复杂且多因素的,但广泛的研究表明氧化应激在I/R损伤中起着重要作用。本研究采用小鼠双侧颈动脉结扎模型观察TSG对脑I/R损伤的作用,结果显示,TSG可以减轻脑I/R造成的脑组织病理性损伤,同时可减少脑组织中氧自由基含量,提示TSG对小鼠脑I/R损伤有保护作用。
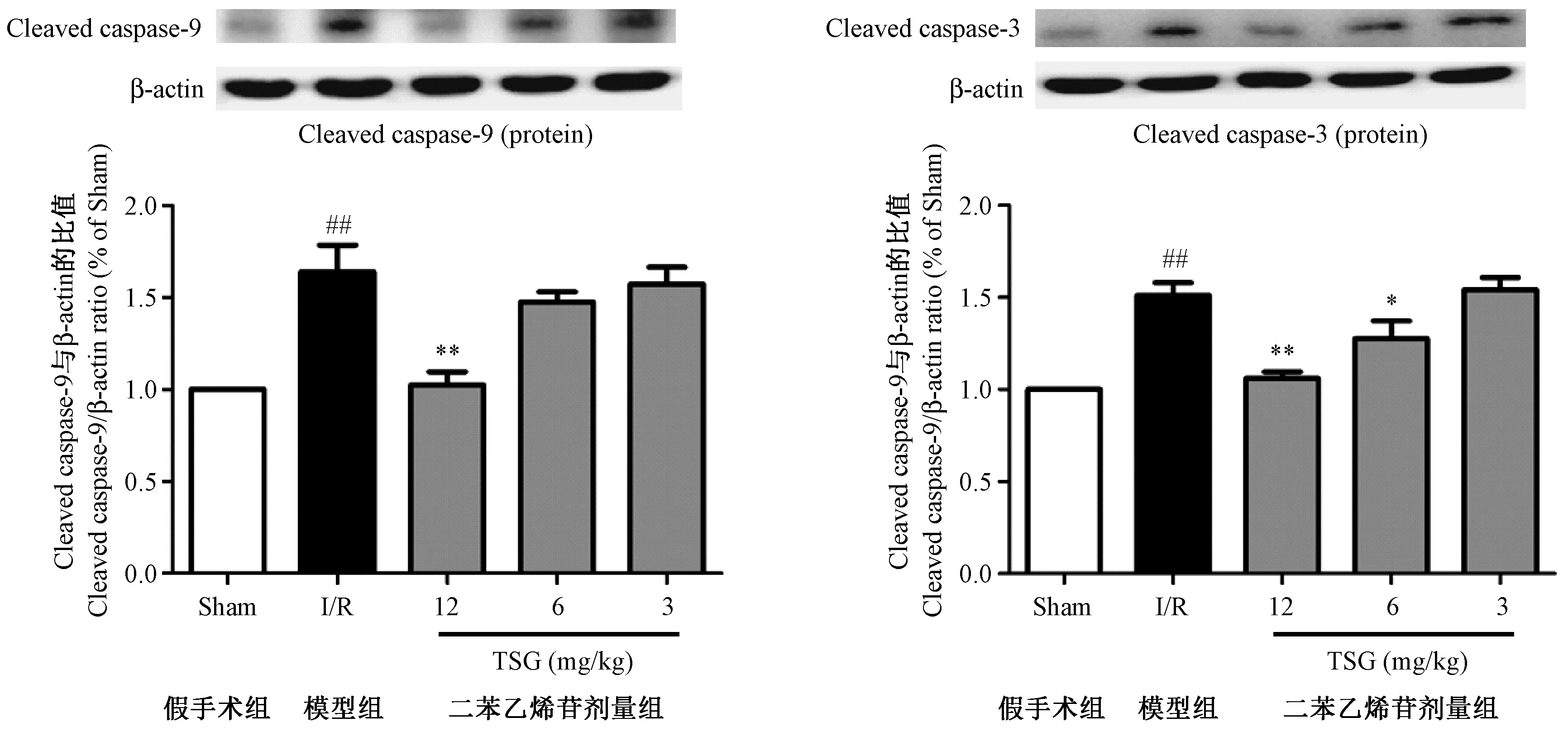
注: ##P <0.01 vs假手术组;*P < 0.05,**P < 0.01 vs模型组(I/R)。图4 TSG对小鼠脑I/R损伤后脑组织中cleaved caspase-3/9蛋白表达的影响Note.##P< 0.01 vs the sham group. *P < 0.05,**P < 0.01 vs the model (I/R) group.Figure 4 Effects of TSG on the expressions of cleaved caspase-3/9 proteins in brain tissues after I/R injury in the mice
脑缺血再灌注会引发一系列病理损伤,如兴奋性毒性,炎症反应和氧化应激,最终导致不可逆的神经元损伤[17],在这些病理事件中,氧化应激已经成为治疗脑血管疾病的主要挑战[18]。大脑中ROS生成涉及许多生物过程,主要来源包括线粒体呼吸链,黄嘌呤氧化酶和环氧合酶,最近的研究表明,NOX也是重要的ROS生产者。Serrano等[19]研究发现:NOX表达和活性在缺血性中风后的神经组织中升高。Qin 等[20]最近研究发现:NOX抑制剂可减少缺血区神经元细胞凋亡、缩小梗塞面积、减轻相应区域功能损伤。本研究结果显示,小鼠脑I/R后缺血区NOX4蛋白表达显著上调,TSG可显著抑制小鼠大脑皮层缺血区NOX4蛋白的表达,减轻小鼠脑I/R引起的氧化应激损伤。上述研究结果均提示了NOX在脑I/R的发病机制中起关键作用,抑制NOX活性可能是减轻脑I/R的有效途径。
Caspase 蛋白家族是细胞凋亡的重要参与者, 其中caspase-9是线粒体内源性凋亡途径的启动者,而caspase-3是凋亡的最终执行者[21]。Caspases-9的活性增高并自我剪切形成cleaved caspase-9,激活下游的caspase-3。凋亡早期caspase-3活化为cleaved caspase-3,裂解相应胞质胞核底物,切割核小体间的DNA,从而诱导细胞凋亡[22]。本研究结果表明,TSG可以显著抑制小鼠脑I/R引起的cleaved caspase-3/9 过度表达,其作用机制可能是下调了NOX4蛋白的表达,抑制ROS爆发性生成,从而抑制线粒体膜通透性转换孔(mPTP)开放和线粒体膜电位(MMP)降低,避免线粒体释放细胞色素C等凋亡因子到胞质激活Caspase系列蛋白。
总之,NOX4是脑I/R损伤中ROS的主要来源,下调NOX4可能是预防氧化应激损伤的有效途径。本研究结果显示,TSG对小鼠脑I/R损伤的保护作用可能与下调NOX4蛋白的表达有关,具体的作用机制我们将做进一步深入研究。
