重组人血管内皮抑制素联合mFOLFOX化疗方案对晚期肝癌患者疾病控制率及生存率的影响
2019-04-18陈国芹吕水林刘艳霞
陈国芹 吕水林 刘艳霞
1 河南省许昌市中心医院药学部临床药学科 461000; 2 许昌市中心医院泌尿外科; 3 许昌市食品药品检验检测中心中药室
肝癌是由黄曲霉素摄入、肝炎病毒感染、环境污染等因素引起的恶性肿瘤疾病。手术切除病灶为目前临床治疗肝癌首选方案,但该病起病较为隐匿,早期多表现为乏力、肝区疼痛、消瘦、腹胀等,并无明显特异性,导致多数患者确诊时已是晚期,有统计数据显示在晚期肝癌患者中仅有20%左右适合实施手术,而对于失去手术治疗机会的患者需采取系统治疗,以缓解患者临床症状,延长其生存时间[1]。有学者指出采用mFOLFOX化疗方案治疗晚期肝癌,可减轻瘤负荷,改善患者临床症状,延长其生存时间[2]。亦有学者指出重组人血管内皮抑制素可调控蛋白水解酶活性及肿瘤细胞表面血管内皮生长因子表达,抑制肿瘤新生血管生成,进而拮抗肿瘤生长[3]。本文将mFOLFOX化疗方案与重组人血管内皮抑制素联合应用于晚期肝癌患者,探讨其对疾病控制率及生存率的影响,现报道如下。
1 资料和方法
1.1 一般资料 选取我院2013年1月—2015年3月收治的65例晚期肝癌患者,按照随机数字表法分为两组:对照组32例,男20例,女12例,年龄40~73岁,平均年龄(54.53±5.57)岁,肝功能分级:A级15例,B级10例,C级7例;观察组33例,男19例,女14例,年龄41~74岁,平均年龄(55.62±5.48)岁,肝功能分级:A级16例,B级12例,C级5例。两组肝功能分级、年龄、性别等基线资料比较,差异无统计学意义(P>0.05),且本文经医院学术委员会审核同意。
1.2 选择标准 (1)纳入标准:符合葛均波等主编的《内科学》中肝癌诊断标准[4];知情同意本研究。(2)排除标准:对本研究所用药物成分存在禁忌者;伴有严重传染性疾患者;肾、脑功能衰竭者;合并严重精神系统疾患者。
1.3 方法 两组患者均给予护胃、止吐等常规处理。对照组第1天静脉滴注100mg/m2奥沙利铂(江苏奥赛康药业股份有限公司,国药准字H20064296),输注时间2~6h;化疗第1天静脉滴注400mg/m2亚叶酸钙(重庆药友制药有限责任公司,国药准字 H20010615),滴注2h;持续泵入2.6mg/m25-氟尿嘧啶(上海旭东海普药业有限公司,国药准字H31020593),泵入时间46h;持续治疗2个周期(14d为1个周期)。观察组在对照组基础上静脉滴注7.5mg/(m2·d)重组人血管内皮抑制素(山东先声麦得津生物制药有限公司,国药准字S20050088)+500ml生理盐水,滴注时间3~4h,治疗1个周期后休息1周开始下1个周期(持续治疗14d为1个周期),共治疗2个周期。
1.4 观察指标 (1)治疗2个周期后统计对比两组疾病控制率。疗效评估标准:治疗2个周期后靶病灶最大径之和增加20%及以上为进展;靶病灶最大径之和缩小不足30%为稳定;靶病灶最大径之和缩小为30%及以上为部分缓解;靶病灶基本消失,肿瘤标志物恢复正常,且至少维持1个月为完全缓解[5]。疾病控制率=(稳定+部分缓解+完全缓解)/总例数×100%。(2)治疗结束后随访6个月、1年、2年,统计比较两组生存率。(3)观察对比两组骨髓抑制、恶心呕吐、胸闷等毒副反应发生情况。
1.5 统计学方法 通过SPSS19.0软件对数据进行分析,计数资料以〔n(%)〕表示,行χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 疾病控制率 观察组疾病控制率较对照组高,差异具有统计学意义(P<0.05)。见表1。
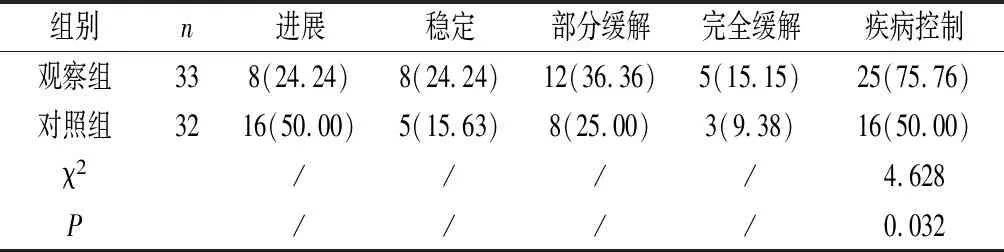
表1 两组疾病控制率对比〔n(%)〕
2.2 生存率 两组6个月生存率对比,差异无统计学意义(P>0.05);观察组1年、2年生存率均较对照组高,差异具有统计学意义(P<0.05)。见表2。
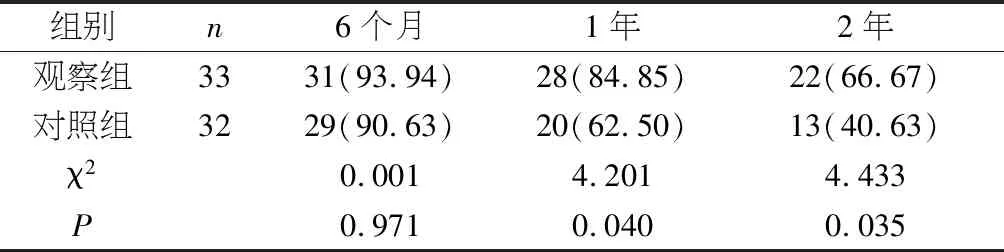
表2 两组生存率对比〔n(%)〕
2.3 毒副反应 两组毒副反应发生率比较,差异无统计学意义(P>0.05)。见表3。

表3 两组毒副反应发生率对比〔n(%)〕
3 讨论
肝癌为临床常见多发恶性肿瘤类型,流行病学相关调查显示其发病率居我国肿瘤疾病发病率第4位[6]。该病具有恶性程度高、侵袭性高、病情进展迅速、病死率高等特点,对于晚期肝癌患者若不采取任何治疗措施,其5年存活率仅为5%左右,对患者生命安全造成极大威胁。肝癌是富血管恶性肿瘤,其丰富的血管为临床治疗提供了新靶点,因此寻找一种科学、合理的治疗方案,修复异常肿瘤血管系统、拮抗肿瘤血管形成,对延长患者生存周期,改善其生存状况具有重要意义。
相关研究指出化疗药物联合使用可增加20%~35%治疗效果[7]。mFOLFOX化疗是集合奥沙利铂、5-氟尿嘧啶、亚叶酸钙三种化疗药物优势的一种化疗方案,其中5-氟尿嘧啶是自海参中提炼而成的一种抗癌药物,静脉给药后可迅速分布于体液中,干扰DNA合成,拮抗肿瘤生长;奥沙利铂可通过结合肿瘤细胞DNA,抑制肿瘤细胞合成、修复,进而控制病灶组织生长;且其可与5-氟尿嘧啶协同增效;亚叶酸钙为抗肿瘤辅助药物,与奥沙利铂、5-氟尿嘧啶联合使用可相互补充、互增药效,但化疗药物联合使用仍难以延长患者生存时间,整体预后不佳,仍需联合其他药物进行辅助治疗。重组人血管内皮抑制素为新型抗肿瘤血管形成药物,可通过阻滞成纤维细胞生长因子生成,降低内皮细胞活力,抑制内皮细胞迁移,上调抗血管新生基因,下调微血管内皮细胞生长相关基因,进而拮抗肿瘤新生血管生成,阻断病灶组织的营养供给,促进肿瘤细胞凋亡;且该药物可使内皮细胞滞留于G1期,阻止其分裂,并抑制内皮细胞黏附移行,将血管形成路径阻断;此外其可于血管消退之前对异常的肿瘤血管系统进行修复,促进异常血管功能及结构恢复,使其趋向于正常化,为药物及氧的运输提供便利,有助于提高化疗的敏感性[8];与mFOLFOX化疗方案中的5-氟尿嘧啶等联合使用可杀伤患者机体内HepG-2细胞,促进HepG-2细胞凋亡,发挥最佳抗肿瘤效果。本文结果显示,观察组疾病控制率高于对照组,1年、2年生存率高于对照组,提示对晚期肝癌患者给予mFOLFOX化疗方案与重组人血管内皮抑制素联合治疗,可提高患者1年及2年生存率,控制病情恶化;同时本文结果显示两组毒副反应发生率均较低,旨在说明重组人血管内皮抑制素配合mFOLFOX化疗方案治疗晚期肝癌,并不会增加毒副反应发生率,原因在于重组人血管内皮抑制素抑制作用特异性较强,其以肿瘤血管内皮细胞为主要靶点,对正常组织影响小,几乎不会引起胃肠道及骨髓抑制等不良反应,安全性高。
综上所述,重组人血管内皮抑制素与mFOLFOX化疗方案联合应用于晚期肝癌患者效果显著,可提高疾病控制率及1年、2年生存率,且安全性高,值得推广应用。
