不同氮源对刺芹侧耳谷氨酰胺合成酶的酶活力及基因表达影响
2019-04-17尚俊军茅文俊鲍大鹏
汪 滢, 尚俊军, 茅文俊, 王 莹, 鲍大鹏, 李 燕
(上海市农业科学院 食用菌研究所, 上海 201403)
杏鲍菇(Pleurotuseryngii)又名刺芹侧耳。杏鲍菇栽培作为一项现代高新农业产业,对调整农业产业机构,推动农业可持续发展,促进农业增效、农民增收具有重要意义[1]。目前,刺芹侧耳在我国已实现工厂化栽培,是一种深受欢迎的珍稀食用菌。工厂化栽培刺芹侧耳采用人工培植的培养料,氮源是其中主要的营养成分。氮的吸收和同化对刺芹侧耳菌丝生长和子实体的发育有着直接的影响[2],因此对刺芹侧耳氮素的利用研究有着极其重要的意义。

程向阳等[7]利用RACE技术从刺芹侧耳基因组中克隆得到刺芹侧耳谷氨酰胺合成酶编码基因(PE-GS)的cDNA全长,并利用RT-PCR对其表达进行了初步的研究,发现PE-GS基因在子实体阶段的表达量相比菌丝体阶段上调。本研究利用硫酸铵、硝酸钠和尿素等不同类型的氮源在不同浓度下培养刺芹侧耳菌丝,测定了刺芹侧耳对不同氮源的利用情况,比较并分析不同氮源对PE-GS基因的表达特性和GS酶活力的影响。通过对PE-GS的表达特性研究有助于揭示其功能特点,为食用真菌氮素代谢的分子水平研究提供理论依据。
1 材料与方法
1.1 供试菌株与培养
刺芹侧耳国森一号菌株由上海市农业科学院食用菌研究所保藏并提供。
1.2 培养条件
PDA培养基:土豆200 g,葡萄糖20 g,琼脂20 g,蒸馏水1000 mL。
PDB培养基:土豆200 g,葡萄糖20 g,蒸馏水1000 mL。
基本无氮培养基:KH2SO41.5 g,MgSO4·7H20 0.75 g,葡萄糖20 g,维生素B120 mg,蒸馏水1000 mL。
不同类型的氮源培养:在基本无氮培养基中分别添加当量浓度为30 mmol/L的(NH4)2SO4、NaNO3、尿素(Sangon 中国上海),作为3种不同类型的氮源培养刺芹侧耳菌丝。
不同浓度的氮源培养:在基本培养基中分别添加(NH4)2SO4、NaNO3、尿素作为氮源,氮素当量浓度从低到高依次为2.5、5.0、10.0、20.0和40.0 mmol/L。
菌种于PDA培养基上保存。刺芹侧耳菌种在PDB中25℃培养获取新鲜菌丝体。取新鲜的刺芹侧耳菌丝,用无菌的无纺布过滤收集全部菌丝,菌丝用无菌蒸馏水反复冲洗数次后,用均质仪(Waring 美国)打碎刺芹侧耳菌丝转接入100 mL基本培养基中25℃下150 r/min摇床培养7 d后,收集菌丝。
1.3 菌丝收集
用无菌的无纺布过滤收集菌丝,菌丝用无菌蒸馏水反复冲洗数次后,用无菌吸水纸吸干水分,迅速移放液氮中冷冻15 min,移至-70℃冰箱保存备用。
1.4 生物量测定
将基本培养下培养得到的刺芹侧耳菌丝置于液氮中冷冻15 min至冻结完全后,在真空冷冻干燥机 (Labogene 美国)中充分干燥15 h至水分分离完全,采用分析天平 (Mettler Toledo 美国)统计不同样品的生物量。
1.5 GS酶活测定

1.6 总RNA提取及cDNA合成
刺芹侧耳总RNA提取采用Trizol法[9]。按照Trizol试剂(赛百胜生物技术有限公司,中国北京)的说明书提取刺芹侧耳样品的总RNA。参照PrimeScriptTMRT rtagent Kit with gDNA Eraser试剂盒(TaKaRa,中国大连)的说明书,去除基因组DNA,并反转录成cDNA,-20℃保存备用。
1.7 Real Time RT-PCR
1.7.1 引物设计。选择刺芹侧耳β-actin基因(GenBank登录号:HQ699070)作为内参基因[10],根据刺芹侧耳PE-GS基因(GenBank登录号:KJ466899)的cDNA基因片段和β-actin基因cDNA基因片段设计合成RT-PCR引物(表1)。
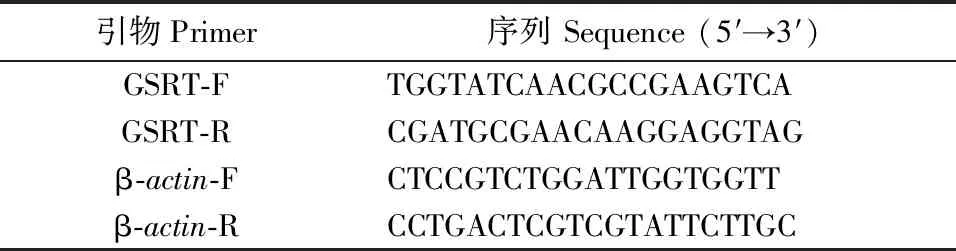
表1 Real Time RT-PCR所使用的引物
1.7.2 重组标准品质粒的制备。应用表1中的引物,以刺芹侧耳cDNA作为模板,进行PCR扩增。50 μL PCR反应体系包含(20 μL):50 ng DNA,10×PCR反应缓冲液 2 μL,2 mmol/L Mg2+,0.2 mmol/L dNTP,上下游引物各0.25 μmol/L,2U TaKaRa ExTaq(TaKaRa,中国大连)。反应条件:94℃预变性2 min;94℃变性30 s,52℃退火30 s,72℃延伸30 s,共30个循环;最后于72℃补平5 min。PCR反应在ABI VeritiTM96 PCR仪上进行。PCR 产物的克隆使用pGEM-T试剂盒(Promega,美国),按照说明书进行操作。测序由上海生工生物工程股份有限公司完成。按照质粒快速提取试剂盒(捷瑞生物工程有限公司,中国上海)的说明书纯化质粒。
1.7.3 刺芹侧耳PE-GS基因表达的Real Time RT-PCR分析。刺芹侧耳PE-GS基因表达的定量分析采用Real Time RT-PCR法。测定纯化质粒的OD值,将PE-GS和β-actin重组标准品质粒10倍梯度稀释后,应用SYBR Premix ExTaqTM试剂盒(TaKaRa,中国大连),分别以系列稀释的质粒为模板在Applied Biosystems StepOneTM实时荧光定量PCR仪(Applied Biosystems,美国)上,以表1所列引物进行定量PCR扩增反应,从而可以同时得到目的基因和内标基因的标准曲线和回归方程。合成反应总体积为20 μL,包括Premix ExTaqTM10 μL,10 μmol/L正反向引物各0.4 μL,ROX reference Dye(50×) 0.4 μL,ddH2O 6.8 μL,模板DNA(50 ng/μL)2 μL。反应条件:95℃预变性20 s,然后95℃变性5 s,60℃退火15 s,72℃延伸15 s,共40个循环。
2 结果与分析
2.1 生物量统计
通过对不同处理菌丝干重的测定发现,分别以硫酸铵、硝酸钠和尿素为单一氮源时,刺芹侧耳菌丝都能够生长,但菌丝生长量存在明显的差异(图1)。刺芹侧耳菌丝对3种氮源的利用程度为:尿素>硫酸铵>硝酸钠。以尿素和硫酸铵为氮源时,氮源浓度增加时,菌丝生物量明显增长,而以硝酸钠为单一氮源培养时,菌丝生物量较低,且硝酸钠浓度的增加,菌丝生物量增加不明显。这和马璐[11]、王振河[12]等的研究结果一致,即刺芹侧耳对有机氮的利用高于无机氮,无机氮中刺芹侧耳对铵态氮的利用高于硝态氮。
2.2 GS酶活力测定
3种氮源分别在不同浓度下培养刺芹侧耳菌丝,其菌丝体GS酶活表现差别较大(图2)。相同氮素浓度下培养下,GS酶活性从大到小顺序为:硝酸钠、尿素、硫酸铵。且以硝酸钠为氮源,相比硫酸铵和尿素,其酶活性大小的差距逐渐增大。以硫酸铵和尿素为氮源时,GS的酶活力随氮源浓度的升高而降低。
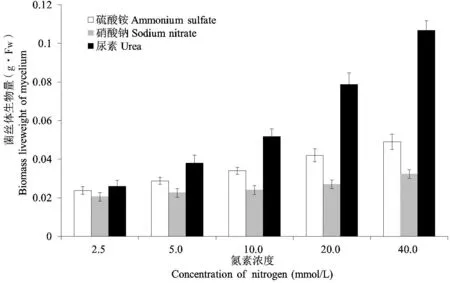
图1 3种不同类型的氮素在不同浓度下对刺芹侧耳菌丝体的生物量的影响

图2 3种不同类型的氮素在不同浓度下对GS酶活的影响
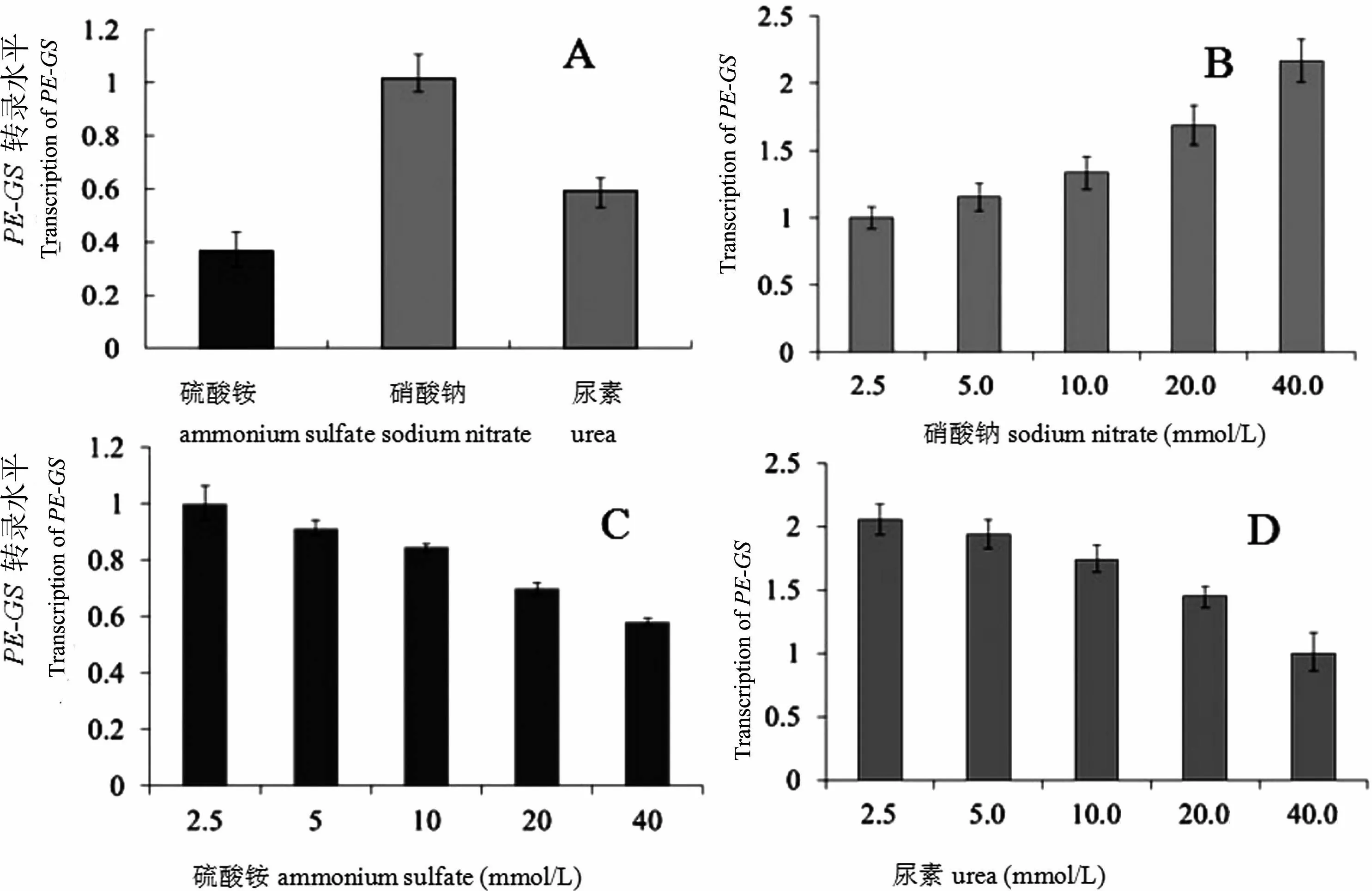
A:3种不同的氮素(30 mmol/L)对PE-GS基因表达的影响;B:不同浓度的硫酸铵(mmol/L)对PE-GS基因表达的影响;C:不同浓度的硫酸铵(mmol/L)对PE-GS基因表达的影响;D:不同浓度的尿素(mmol/L)对PE-GS基因表达的影响
图3不同培养条件下PE-GS基因表达量的变化
Figure 3 Transcription ofPE-GSunder different culture conditions
2.3 不同氮源浓度下PE-GS基因表达水平
2.3.1 不同氮源类型对PE-GS基因表达水平的影响。从图3-A中可以看出,相同浓度下硫酸铵、硝酸钠和尿素对PE-GS基因表达水平影响并不一致,强弱顺序为:硝酸钠>尿素>硫酸铵,说明PE-GS基因的表达水平受到氮源形式的影响,在氮源较易利用的情况下表达水平下调,反之则上调。

3 讨论

目前,杏鲍菇的测序基本完成,通过序列对比,挖掘更多的GS基因。利用基因干扰、敲除、过表达,深入研究杏鲍菇中的营养代谢(氮素代谢)相关基因,为食用菌的高产打下基础,是我们下一步的研究计划。
4 结论

