皮肤组织工程进化与三维组织打印技术的机遇及挑战
2019-04-17太光平蔡敬民
太光平, 吴 克, 蔡敬民
(1. 生物增材制造安徽省教育厅重点实验室 先进生物制造中心, 合肥 230601; 2. 合肥学院 生物与环境工程系, 合肥 230601)
组织工程皮肤是创面处理非手术治疗的主要手段。本文综述皮肤组织工程产品的发展,总结现有工程种子细胞和新型生物打印墨水材料, 重点介绍新型三维组织打印技术及多能干细胞在三维打印皮肤组织工程中的应用。
1 皮肤组织工程产品发展
19世纪80年代,美国EW Lee博士最先尝试合成类皮肤替代物[1]。到20世纪50—70年代人们开始探索应用合成聚氨酯及去细胞化组织作为烧伤患者创面的保护屏障[2-3]。而里程碑式的进展是Green在1975年首创的角朊细胞培养方法, 以及自体上皮细胞片培养技术 CEAs(Cultured epithelial autografts)[4]。后期开发设计的多种新型人工皮肤, 特别是含活细胞人工皮肤,显示较好的促伤口愈合结果。根据人工皮肤的组成或功能特性,可以分为化学合成类与天然脱细胞支架类人工皮肤、含细胞类与不含活细胞类人工皮肤[5-6]、异体活细胞类和自体活细胞类人工皮肤[7]及临时性或永久性人工皮肤[7-8]。
早期的商业类产品主要是化学合成类与天然脱细胞支架类人工皮肤。如Alloderm, Matriderm® 及 Hyalomatrix[6,10]。其中, Matriderm®是一种牛源性非交联冻干材料, 用于皮肤伤口的临时覆盖。后期研发的商业类产品添加有异体新生儿包皮成纤维细胞,如Apligraft、Stratagraft、Dermagraft 等同种异体细胞人造皮肤, 移植后其最终逐渐被排异,而只有添加了自体细胞的人工皮肤如EpiCel、ReCel类人工皮肤[5]其自体成纤维细胞和上皮细胞能够永久地融合入患者皮肤伤口。图1显示21世纪人工皮肤替代产品的发展及重要历史节点。
1.1 无细胞的人工合成皮肤
最早具有代表性的化学合成类人工皮肤为Biobrane,由合成尼龙网和交联猪真皮组成。临床研究表明,Biobrane 优于烧伤临床常规的磺胺嘧啶银制剂[10]。其他人源天然脱细胞支架人工皮肤包括Alloderm和Dermamatrix,比动物源性的脱细胞人工皮肤好,其避免了动物(猪)源性病毒感染的风险[11]。这一类人工皮肤中值得一提的是由Burke等在1981年开发的Integra[12-13]。Integra是由层状多孔的化学交联的牛胶原蛋白和鲨鱼硫酸软骨素组成, 其上层由有机硅层覆盖。 Integra 处理的伤口在2~3周内显示良好的血管化。尽管该类皮肤替代品相对便宜,但其组织相容性有限,临床效果较后期研发的天然脱细胞支架人工皮肤差。
1.2 含活细胞人工皮肤
通过增加同种异体活细胞(主要为上皮细胞或成纤维细胞)的合成皮肤在烧伤伤口治疗中显示更快上皮化。这类包括添加异体或自体皮肤细胞的皮肤替代品。
1.2.1 异体活细胞人工皮肤
TransCyte[14]是最早开发的, 添加了新生儿成纤维细胞的Alloderm,含成纤维活细胞分泌沉积的生长因子和细胞外基质成分。TransCyte获得FDA许可用于烧伤治疗。该类皮肤还包括 ICX-Skin (英国), 也添加有新生儿成纤维细胞[15]。而Dermograft使用了可吸收聚乙二醇-聚乳酸共聚物支架及新生儿成纤维细胞,其可保存在-80℃, 当植入伤口后,成纤维细胞开始增殖并分泌多种生长因子, 而聚乙二醇酸支架可在移植后3~4周被机体自然吸收[16]。 Apligraft代表了一种 “复合人工皮肤”, 其主要基于牛 I型胶原及新生儿成纤维细胞和上皮细胞。Apligraft 保质期短, 仅为5天,在1998年也被FDA批准用于慢性静脉性溃疡和糖尿病腿部溃疡的治疗[6-7]。
1.2.2 自体活细胞类人工皮肤
Bell 在1981年首创一款基于自体活细胞的人工皮肤PermaDerm,使用了胶原蛋白并添加自体成纤维细胞和上皮细胞[17]。PermaDerm在大鼠模型上移植后9天内可形成基底膜,可覆盖比原供体面积大66倍的烧伤创面[18]。其他产品还有应用透明质酸基质,联合应用自体表皮及成纤维细胞的人工皮肤Orcel,以及简单地把培养自体上皮细胞附着在石蜡纱布的EpicelTM[19-22]。虽然以上几大类别的人工皮肤产品都已经有了多种商业化产品,但临床效果参差不齐,各个产品功效与临床实际要求仍然有一定距离。尤其是缺乏多种天然皮肤重要的功能单元及细胞成分: 如汗腺细胞、黑素细胞和朗格汉细胞等, 脂肪组织和神经感受细胞基本不存在。因此, 这些人工合成皮肤产品无法提供温度控制、免疫调节和压力感受功能。另一个限制因素是制造成本较高,如无细胞类人工合成皮肤Alloderm和Integra的市场价格约为每平方厘米15~30 美元,异体成纤维细胞类人工合成皮肤TransCyte和DermaMatrix的销售价格为每平方厘米30~60美元,而含自体活细胞人工复合皮肤EpicelTM覆盖每1% 的体表烧伤面积的成本超过13 000美元[5]。临床和市场迫切需要价格更便宜, 功能更好的促伤口愈合的新型活细胞人工合成皮肤。设计新型皮肤替代品,增加皮肤功能细胞种类(比如血管内皮细胞和毛囊细胞),添加特定的细胞外基质(III型胶原及透明质酸),引进新兴3D生物打印技术,是高精准打印皮脂腺和毛囊,打印微血管网等皮肤功能单元成分,实现人工制造仿自然复合人工皮肤组织工程产品的必经之路。
2 三维生物打印技术在皮肤组织工程中的应用
基于3D打印技术的再生医学及组织工程,已经成为继人类基因组大规模测序完成之后,生命科学及健康领域中最活跃的发展领域之一。3D生物打印以计算机三维模型为图纸,利用特制生物墨水,装配种子细胞,最终打印具有活性的人体细胞组织和器官,可在将来大面积填补器官移植的缺口。
经典3D打印机根据打印材料的不同分为化学聚合、光敏聚合、黏合剂黏合;不同的打印技术路线分为挤出式、激光打印和喷墨打印等。3D生物打印目前应用较多的主要有3种:包括喷墨、挤出式和激光辅助细胞打印[24]。每种技术都有自己的优点和局限性。图2比较了主要3D生物打印技术的分辨率及生物墨水材料/细胞微观尺度。
1)喷墨生物打印技术能够快速地把含细胞的墨滴精确地打印到设计的位置。其特征是能高速地把活体细胞一层一层地打印,主要优势是可实现高速度, 但是由于喷墨的打印头不能挤出高黏度材料, 所以不适用于高密度细胞的打印[25]。
2)挤出式生物打印在商用3D生物打印机中得到了广泛的应用[26-28]。生物墨水材料通过喷嘴挤出。基于挤出的原理异同分为: (a) 气动式,其中分无阀和有阀; (b) 机械式挤出,包括螺杆驱动式挤出和电磁微阀式挤出,挤出喷头支持的打印墨水黏度范围较小。与紫外光照/化学和热交联结合后。挤出式生物打印系统可实现接近5~50 μm的分辨率。其缺点包括挤出式应用的机械应力会损伤细胞,影响细胞活力。在皮肤组织生物打印领域,Lee[29-30]报告了3D打印多层人皮肤成纤维细胞和上皮细胞,使用了由气体驱动的气动微型喷嘴式挤出的逐层组装工艺。Cubo[31]应用挤出式3D生物打印,打印由人原代上皮细胞和原代成纤维细胞构建的复合人工皮肤,移植裸鼠后显示良好的组织化学结构。
3)激光辅助生物打印(Laser assisted bioprinting;LaBP)技术也已应用于人工皮肤打印。Michael[32]应用胶原做打印墨水,打印包括小鼠成纤维细胞和人源性永生化上皮细胞至Matriderm®脱细胞基质上制备复合人工皮肤,该杂合人工皮肤移植裸鼠后显示类似皮肤的组织化学结构;Koch 等[33-34]应用激光诱导转移 (Laser-induced forward transfer, LIFT)技术打印人工皮肤, 增殖和凋亡活性分析表明98%的成纤维细胞和约90%的人间充质干细胞能够在激光转移打印步骤中存活。基于激光打印提供了优良的高分辨率,但目前打印速度相对缓慢,每小时仅能打印1 cm2皮肤组织。与挤出式生物打印技术相比, 激光辅助打印是非接触式打印, 不会对细胞产生机械应力导致的细胞损伤及活力下降。此外, 激光辅助打印可以打印高黏性墨水材料,但激光的生物打印机器成本较高。
该领域最新发展的是原位皮肤打印。Hakimi等[23]开发了一种手持式3D 生物打印机, 能够在小鼠和猪伤口模型中直接打印皮肤,细胞能在伤口原位形成皮肤片。

图1 皮肤组织工程的发展及关键技术进化重要时间点[23]

图2 主要生物打印技术的分辨率及生物材料细胞微观尺度比较[2,12]
注:喷墨、激光辅助和挤出式生物打印机制与分辨率进行了比较。扫描电子显微镜(a)、(b)、(c)、(d) 的照片版权属于原作者经授权使用[8,18]
当前三维生物打印人工皮肤还处于技术摸索阶段。目前报道的三维生物打印人造皮肤尚未添加皮脂腺、毛囊细胞和微血管网等皮肤功能单元成分。
4)皮肤生物打印需要将不同打印技术的优势结合起来,在满足高分辨率的同时兼顾高通量的要求。Cadau 等[35-36]报道了一个新的NGB 激光生物打印机,应用了激光打印喷头和喷墨打印喷头,该系统实现10 μm 的分辨率。该激光打印头和喷墨打印头打印的皮肤模型已经用于化合物的高通量毒理筛选及化妆品成分的功能筛选。Kim等[37]则开发了一种挤出和喷墨联合双打印头系统,挤出模块用于打印成纤维细胞,喷墨模块用于高速均匀打印上皮细胞。同时采用聚己内酰胺复合的胶原打印墨水,该打印系统打印的人工皮肤移植14 d后能形成良好的表皮层。同时,该双喷头系统的使用大大地降低了打印材料墨水的用量,从而降低了皮肤制造成本。
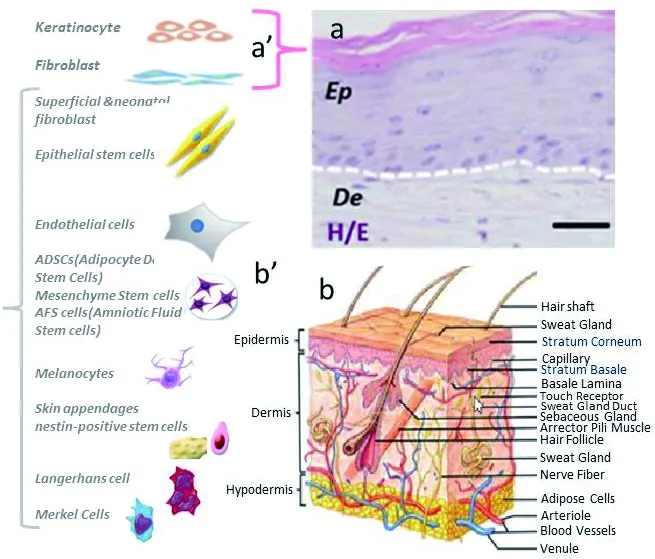
图 3 现有3D打印人工皮肤细胞类型及潜在可应用的功能性细胞类型[31]
注:a为3D打印人工皮肤的组织学使用了a′原代成纤维细胞和原代人上皮细胞; b′为潜在的可用于皮肤打印的种子细胞; b为皮肤细胞模型图。Epp (Epithelia) De (dermis) 标尺: 100 μm
3 皮肤组织应用材料及技术
3.1 皮肤生物打印墨水材料
生物打印墨水制约着3D 打印分辨率和生物打印构建组织质量。生物打印墨水材料为种子细胞提供物理和生化微环境信号,可影响细胞极性, 控制细胞迁移。
脱细胞外基质dECM (decelullar extracellular matrix)含有丰富的细胞生长分化信号, 有利于组织再生修复,基于脱细胞外基质的墨水缺点是机械性能差, 该特性可通过添加聚己内酰胺进行优化,已用于生物3D打印[38]。
其他潜在的皮肤生物打印墨水材料包括最近开发的具有高导电性的多聚糖生物打印材料,可利用其导电特性对培养的细胞或组织实施电刺激,用以促进干细胞分化和伤口愈合[39]。其他材料包括特种相转换水凝胶[40]和产氧水凝胶[41]已经用作生物打印材料,其可对打印组织结构的细胞微环境实现操控。而其它已广泛应用于传统组织工程的生物相容性材料,如低熔点琼脂糖、Pluronic® F-127、壳聚糖、温敏性、热敏性、pH值敏感性水凝胶等,可单独应用或者混用可开发为潜在的皮肤生物打印墨水材料[42]。
3.2 皮肤组织工程种子细胞的选择
原代自体成纤维细胞、永生化成纤维细胞系已在传统皮肤组织工程中得到了广泛的应用。但原代自体细胞来源受限,永生化成纤维细胞系其临床价值有限。比如已报道的激光及挤压式皮肤三维生物打印实验中, 使用了小鼠 NIH3T3 成纤维细胞和人源性永生化HaCat上皮细胞,其主要用于3D打印系统功能的验证,无临床应用价值。因此开发选择适合3D打印并有临床价值的种子细胞仍然需要进一步探索。
3.2.1 应用浅表新生儿成纤维细胞减少瘢痕的形成
成纤维细胞是真皮层的主要成分, 具有合成胶原、分泌生长因子、启动伤口愈合的功能。真皮区域可进一步分为上层真皮和下层网状真皮。已发现上层真皮与下层真皮中成纤维细胞有异质性[43-44]。在培养的人工皮肤中加入上层真皮成纤维细胞后显示瘢痕形成减少。上层真皮显示高III 型/I 型胶原比例, 下层真皮显示低III型/I 型胶原比例。此外,有证据提示,选择性使用新生儿浅层真皮成纤维细胞可能有利于皮肤再生并且减少瘢痕的形成。同时,同种异体新生儿上皮细胞由于其人类白细胞抗原分化程度低,从而可减少移植后的免疫排斥反应性[45-46]。另一个有趣的现象是,口腔黏膜伤口的愈合是已知的唯一成人无疤痕愈合典型。尽管人口腔或伤口处始终存在一定程度的微生物,该无疤痕愈合机制目前仍然不清楚[47]。同时文献显示基于口腔上皮细胞及成纤维细胞的人工皮肤组织显示良好的基底膜形成及上皮细胞分化,其中其创面高水平的透明质酸水平与高水平III型胶原是否与创面无瘢痕愈合有关仍需研究[48]。
3.2.2 干细胞来源的种子细胞用于皮肤生物打印
传统的组织工程皮肤只提供了最基本的两类细胞(上皮细胞及成纤维细胞)。由于技术限制,难以添加更复杂的皮肤附属器官细胞,如皮肤色素细胞和血管网内皮细胞。而随着干细胞技术的进步,比如可利用干细胞或iPSCs (induced pluripotent stem cells)分化获取上述功能细胞以促进创面愈合,使恢复微血管形成成为可能。
脂肪源性干细胞ADSCs(Adipocyte-derived stem cells)能够分泌血管生成因子,可增加微血管形成。Trottier等[49]采用传统的3层皮肤模型, 证明ADSCs可替代成纤维细胞重建人工皮肤, ADSCs培养基可刺激皮肤成纤维细胞胶原合成和细胞迁移, 分泌血管内皮生长因子, 从而加速伤口愈合。
羊水源性干细胞AFS(Amniotic fluid-derived stem cells) 也可作为成纤维细胞的替代细胞。 Skardal等[50]发现与MSC治疗的伤口相比, AFS细胞治疗伤口的微血管密度和毛细血管直径有明显增加。AFS容易分离,染色体稳定, 同时AFS细胞不会诱发免疫排斥,是一种潜在的人工皮肤种子细胞。
另一类潜在种子细胞为诱导性多能干细胞(iPSCs),iPSCs的应用克服了传统组织工程中细胞数量这一瓶颈,使得体外提供无限制细胞数量成为可能。皮肤成纤维细胞可重新编程逆向分化成为 iPSCs干细胞[51]。而iPSCs可以再重新分化为角质细胞和成纤维细胞[52]、汗腺细胞[53]及其他任何相关功能细胞用于重建人工皮肤[54-55]。
4 三维生物打印网络化血管人工组织
构建组织工程血管样网络以确保营养供应,促进打印组织与宿主融合仍然为组织工程领域的主要难题。De等[56]报道构建基于内皮细胞的血管化微球体可以为血管化三维组织工程提供新策略。应用成纤维细胞及脂肪组织衍生的间充质干细胞ADSC作为支持细胞,内皮细胞可在微球体内自发形成毛细血管样网络。Hendrickx[57]则用一种定制的水凝胶促进组织工程结构毛细血管网络的形成。Hreimendahl[58]报道了应用牺牲材料的方法打印设计的血管网络。
5 生物打印组织工程产品标准
生物打印技术与干细胞分化技术的结合使打印高度仿真人造皮肤成为可能。尚有许多临床前试验及临床批文需要完成,所有成分组件包括细胞、生物墨水和生物打印机系统都必须满足安全、无菌、质控方面的要求和监管。工艺必须纳入(Good manufacturing practice)规范管理, 生物打印机软硬件及系统所有组件必需是临床级而非目前实验室级别[59-60]。最近, 美国测试与材料学会ASTM (American society for testing and materials) 发布了材料添加剂制造标准[61]。美国食品和药物管理局FDA发表了关于三维打印的指导原则,对医疗设备和产品使用添加成分提出要求。同时, ASTM国际委员会、国际标准化组织技术委员会和英国标准研究所也出台了组织工程产品要求标准[62]。中国食品药品监督管理局尚无关于三维打印产品的规范性文件。目前执行的仍然是国食药监械[2007]76号国家《组织工程医疗产品研究及申报相关要求》。其对组织工程产品中的生物技术部分(包括活细胞、生物活性成分等)参照《药品注册管理办法》,对生物制品的相关要求目前还包括不低于300例的包含Ⅰ期、Ⅱ期、Ⅲ期临床试验等[63]。
6 存在的问题及展望
目前在开发皮肤替代品和新兴技术方面,尽管传统工艺皮肤组织工程进步很大, 但当前组织工程皮肤仍有问题待解决,如血管化和必要的皮肤附属器和色素沉着等难题。随着高精度的3D 生物打印技术的成熟, 更多的新型细胞或干细胞分化皮肤附件细胞可用于皮肤3D生物打印;创新材料比如具有导电特性的生物打印材料,可支持快速血管化, 并促进创面皮肤愈合。
