人参内生菌Burkholderia sp. GE 17-7制备人参皂苷Rg3的研究
2019-04-17李俊莹武伦鹏康辰凯
李俊莹, 武伦鹏, 康辰凯, 付 玉
(1. 鞍山师范学院 化学与生命科学学院, 鞍山 114007; 2. 国家参茸产品质量监督检验中心, 延吉 133002)
人参系五加科人参属植物(PanaxginsengC.A. Mayer),被称为“百草之王”,是中国东北三宝之一。人参与西洋参、三七等是近亲,是我国传统的名贵药材,据记载已有4000多年的使用历史。人参皂苷是人参中起主要药理学活性的物质。不同的人参皂苷,显示出的性质和功能也存在较大差异。研究表明,人参稀有皂苷能够对内分泌系统、中枢神经系统、免疫系统、心脑血管系统等都有重要的药理作用[1-7]。其中,人参稀有皂苷Rg3主要作用于细胞增殖周期的G2/M期,诱导肿瘤细胞凋亡,抑制肿瘤细胞浸润和转移,对肺癌、黑色素瘤和肝癌细胞等有明显抑制作用[8-13]。
虽然稀有人参皂苷具有很强的抗肿瘤活性,但这些皂苷天然含量极低,如人参皂苷Rg3在白参中的含量仅为0.000 3%,在红参中的含量约为0.03%,而Rh2在天然人参中并不存在,仅在红参中含有约0.001%。因此,从人参中直接提取这些抗肿瘤稀有皂苷显然不符合实际。目前,制备稀有人参皂苷的方法主要有化学法和生物转化法,相对于污染环境、专一性差的化学法,环境友好、专一性强的生物转化法表现出了更强的竞争力。
内生菌是一类存在于植物组织中而不引起侵染症状的重要微生物资源。在地球已知的接近30种高等植物中,每个物种都与多种内生菌共生[14]。早在100多年前,植物内生微生物已经被发现。但长期以来,内生菌的存在一直被忽略。直到20世纪30年代,由于牲畜食用了感染内生真菌的牧草引发中毒,带来畜牧业严重损失后,植物内生菌才作为一种新的微生物受到了国内外学者的广泛关注。内生菌不仅在生物防治和促进增长寄主植物等方面显示很强的生态功能[15-17],也在分解有机物方面表现出强大的功能[18]。
Park等[19-20]从1~4年生人参根部分离鉴定了200多种人参内生真菌并对其多样性进行了分析;Wu等从辽东楤木(Araliaelata)根中分离到能够产生三萜人参皂苷Rb2和Re的内生真菌[21],他们还从15年生人参根部中分离得到产生人参主皂苷Rb2和Rc的内生菌[22]。Cho等[23]从5年生园参根中分离出36种人参内生细菌并经行了鉴定,其中有3种内生菌对立枯丝核菌有抑制作用。姜云等[24]利用研磨法和组织块法对4年生人参根、茎、叶不同器官中共分离获得152株内生细菌和46株内生真菌,发现有3种菌对灰霉病有明显的抑制作用。曲红光等[25]分离了6年生人参内生细菌18株,其中有3株内生细菌代谢产物粗提物对人宫颈癌细胞Hela具有较好的抗肿瘤活性。林星辰等[26]利用人参内生菌B69菌株抑制人参根腐病。目前,对人参内生菌的研究主要集中在内生菌的分离、代谢产物的抗癌及拮抗作用方面,关于人参内生菌微生物转化制备稀有人参皂苷的研究很少。崔磊等[27]利用党参内生菌D19转化人参根总皂苷为稀有人参皂苷F2和C-K;郭从亮等[28]利用一种植物内生菌Coniochaetasp.对三七总皂苷中人参皂苷Rb1进行了特异性转化。本课题组前期从17年生野山参中分离、筛选获得一株产β-葡萄糖苷酶的内生真菌Burkholderiasp. GE 17-7,本研究旨在研究其转化原人参二醇型和原三醇型人参主皂苷,探讨其水解人参主皂苷制备稀有皂苷Rg3的特异性。
1材料与方法
1.1实验材料
菌株Burkholderiasp. GE 17-7由17年生的鲜人参根分离得到,目前由延边大学分析测试中心尹成日课题组保藏并提供,具体分离方法参照文献[29];人参标准品20(S)-Rb1、20(S)-Rb2、20(S)-Rc、20(S)-Rd、20(S)-Re、20(S)-Rg1、20(S)-Rg2、20(S)-Rg3、20(S)-Rh1、F1和C-K采购自成都曼思特生物科技有限公司;薄层层析板Silica gel60-F254购自德国Merck公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐购自美国Sigma公司;乙腈(色谱纯)、甲醇(色谱纯)购自美国TEDIA公司;其他试剂及药品均为国产分析纯。
1.2菌株Burkholderia sp. GE 17-7的活化
将菌株Burkholderiasp. GE 17-7从冻存管中取出,加入PDB液体培养基中摇培,取100 μL涂布于PDA平板培养基上,放于30℃下生化培养箱中培养3 d,观察菌落形态后纯化,进行下一步实验。
1.3微生物转化人参主皂苷
菌株Burkholderiasp. GE 17-7放到摇瓶中液体培养,达到生长对数期后,分别与人参主皂苷Rb1、Rb2、Rc、Rd、Re和Rg1水溶液按照体积比为1∶1混合,放到30℃的空气浴振荡器中150 r/min下培养3 d。每隔5 h取出部分培养液,低温浓缩后用乙醚溶液萃取,饱和正丁醇处理后旋干,得到了反应产物并用薄层色谱法(TLC)、高效液相色谱法(HPLC)和核磁共振法(NMR)进行分析。
1.4分析方法
1.4.1TLC色谱条件
材料:硅胶60板;展开剂:氯仿-甲醇-水按体积比为10∶5∶1;显色剂:10%的硫酸乙醇溶液。通过与标准品的Rf值比对,定性分析样品中人参皂苷的种类和变化。
1.4.2HPLC色谱条件
色谱柱:BDS HYPERSIL C18柱(250 mm × 4.6 mm,5 μm);流速:1.0 mL/min;柱温:250℃;洗脱液:水(A)和乙腈(B)进行二元洗脱;梯度条件是:0~13 min,A∶B(77∶23,V/V);13~33 min,A∶B(46∶54,V/V);33~45 min,A∶B(32∶68,V/V);55~60 min,A∶B(0∶100,V/V);60~63 min,A∶B(77∶23,V/V)。每一个人参皂苷都通过与皂苷标准谱图的保留时间一一对应,其含量主要通过峰面积来计算。
1.4.3NMR条件
利用瑞士Bruke Av 300核磁共振波谱仪对单体皂苷进行核磁共振检测。探头:5 mm BBO;溶剂:Pyridine-d5 (氘代吡啶)。进行包括13C NMR检测。
2结果与分析
2.1TLC色谱分析结果
利用人参内生菌Burkholderiasp. GE 17-7生物转化原人参二醇型主皂苷[包括20(S)-Rb1、20(S)-Rb2、20(S)-Rc和20(S)-Rd]和原三醇型人参主皂苷[包括20(S)-Re和20(S)-Rg1]。从TLC图中可以看出,菌株GE 17-7能有效转化原人参二醇型皂苷Rb1和Rd,且终产物为Rg3。菌株GE 17-7对原人参二醇型皂苷20(S)-Rb2和20(S)-Rc、原三醇型人参皂苷20(S)-Re和20(S)-Rg1均无转化效果(图1)。

S1、S2、S3:人参皂苷标准品
图1菌株GE 17-7水解人参皂苷Rb1(1)、Rb2(2)、Rc(3)、Rd(4)、Re(5)和Rg1(6)的TLC图
Figure 1 TLC chromatograms of metabolites of ginsenoside Rb1(1), Rb2(2), Rc(3), Rd(4), Re(5), and Rg1(6) converted by the strain GE 17-7
2.2HPLC色谱分析结果
从HPLC图可知,菌株GE 17-7在与人参皂苷Rb1反应5 h后,人参皂苷Rb1的峰面积明显减少,产生与标准品保留时间相同的Rd和Rg3峰(图2-c)。反应15 h后,人参皂苷Rb1和Rd的峰完全消失(图2-d)。产生的单峰(图2-c)和人参皂苷标准品Rg3的HPLC谱图(图2-a)比对,出峰保留时间相同。说明终产物为人参稀有皂苷Rg3。
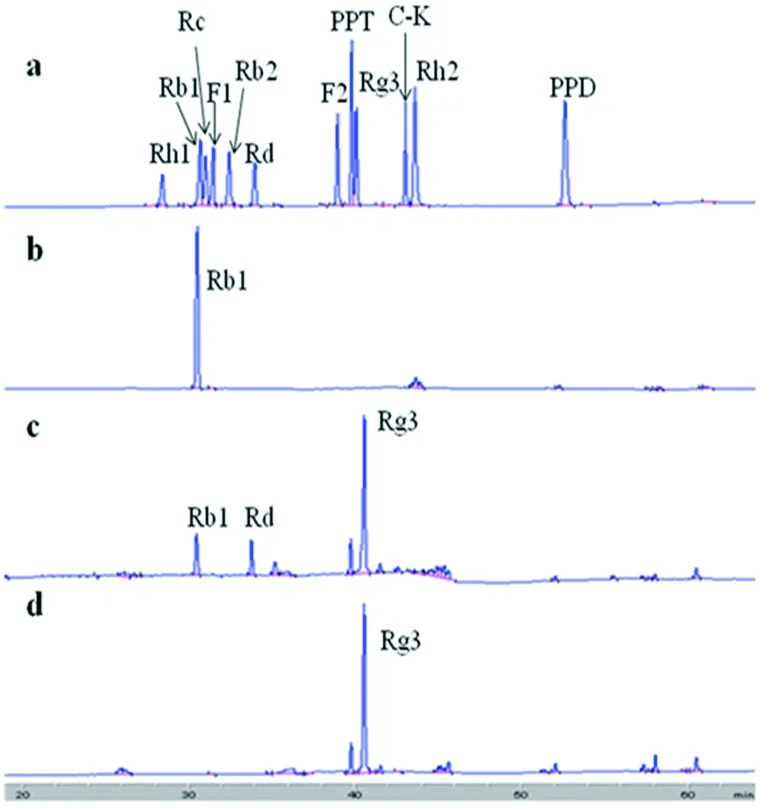
a:人参皂苷标准品;b:反应底物;c:转化5 h后的产物;d:转化15 h后的产物
图2菌株GE 17-7转化人参皂苷Rb1的HPLC的图
Figure 2 HPLC analysis of metabolites of ginsenoside Rb1 converted by strain GE 17-7
2.3 NMR分析结果
将HPLC分离出的最终转化产物采用瑞士Bruke Av 300核磁共振波谱仪进行检测,共出现42个碳信号峰,其中104.9和105.9为两个糖端基碳信号峰,δ126.2和δ130.6分别为C-24和C-25的双键碳信号峰,与手性碳原子C-20相连接的C-17,C-21和C-22分别出现在δ54.6,26.9和35.7,而其他13C-NMR数据与文献[30]基本一致,故终产物为人参稀有皂苷20(S)-Rg3。
3讨论
人参皂苷是人参的主要活性成分,总皂苷含量约为4%。人参皂苷属于三萜类皂苷,按其皂苷元的结构不同可分为3种类型:一类是齐墩果烷型,在自然界含量最少;另两类是达玛烷型的人参二醇型皂苷(PPD)和人参三醇型皂苷(PPT)。一般人参中人参二醇型皂苷占总皂苷的45%~60%,人参三醇型皂苷占人参皂苷总量的12%~20%,齐墩果酸型皂苷占7%~10%。由于人参二醇型和人参三醇型皂苷占人参皂苷的大多数,并且人参二醇型皂苷和人参三醇型皂苷内含有的皂苷种类比较多,因此目前关于这两种类型皂苷的报道很多。
原人参二醇型[20(S)-protopanaxadio1,包括人参皂苷Rb1、Rb2、Rc、Rd、Rg3、Rh2等]和原三醇型人参皂苷[20(S)-protopanaxatrio1,包括人参皂苷Re、Rg1、Rg2、Rh1等]都属于四环三萜达玛烷型皂苷,不同之处在于二醇型皂苷母核上有3个羟基取代(C3、C12和C20),成苷的位置主要在C3和C20,糖基多为葡萄糖、阿拉伯糖和木糖;而三醇型皂苷母核上有4个羟基取代(C3、C6、C12和C20),糖苷键主要在C6和C20,糖基多为葡萄糖、鼠李糖和木糖。人参皂苷的结构因糖基侧链的不同,显示出的性质和活性也有很大差异[31-35]。

表1 菌株GE 17-7转化人参皂苷Rb1的代谢产物人参皂苷20(S)-Rg3的13C-NMR数据(75 MHz, 溶剂: 氘代吡啶)
结合图3原人参二醇型皂苷结构,可以很明确地看出人参内生菌Burkholderiasp. GE 17-7未选取底物母核结构为4个羟基取代(C3、C6、C12和C20)的原人参三醇型,而是选取了母核上有3个羟基取代(C3、C12和C20)的原人参二醇型,同时通过菌株GE 17-7对人参皂苷Rb2和Rc的水解结果,我们就可以看出其只对C-20位上O-β-D-吡喃葡萄糖基-(1→6)-β-D-吡喃葡萄糖具有水解专一性。菌株GE 17-7将人参皂苷Rb1先水解到C-20位O-β-D-吡喃葡萄糖基-(1→6)-β-D-吡喃葡萄糖苷键,转化为人参皂苷Rd。再水解到C-20位O-β-D-吡喃葡萄糖基-(1→6)-β-D-吡喃葡萄糖苷键,形成终产物人参皂苷Rg3。转化路径:人参皂苷Rb1→人参皂苷Rd→人参稀有皂苷Rg3。
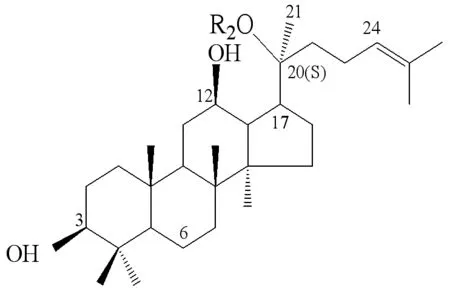

GinsenosideR1R2R3Rb1-Glc2-1Glc-Glc6-1Glc-HRb2-Glc2-1Glc-Glc6-1Arap-HRc-Glc2-1Glc-Glc6-1Araf-HRd-Glc2-1Glc-Glc-H20(S)-Rg3-Glc2-1Glc-H-HRh2-Glc-H-HCompound K-H-Glc-HCompoud Y(C-Y)-H-Glc6-1Arap-HM12(PPD)-H-H-HF2-Glc-Glc-H
图3 20(S)-人参二醇型皂苷的结构
Figure 3 The structure of 20 (S)-panaxadiol ginsenosides
4 结论
本研究利用从17年生野山参中分离、筛选获得一株人参内生真菌Burkholderiasp. GE 17-7生物转化人参主皂苷。通过薄层色谱法、高效液相色谱法等方法对人参主皂苷(Rb1、Rb2、Rc、Rd、Re和Rg1)的转化产物进行分离纯化,采用波谱解析及理化常数对其进行结构鉴定。结果表明人参内生真菌Burkholderiasp. GE 17-7能够特异性制备人参稀有皂苷20(S)-Rg3,为工业制备人参稀有皂苷提供了新的微生物资源。
