植物乳杆菌噬菌体Lpla 的分离鉴定及抗噬菌体菌株的筛选
2019-04-12齐蕊名于美玲姜艳平徐义刚唐丽杰李一经乔薪瑗
齐蕊名,于美玲,姜艳平,崔 文,张 希,王 丽,徐义刚,唐丽杰,李一经,乔薪瑗*
(东北农业大学动物医学学院,黑龙江 哈尔滨 150030)
乳杆菌是公认的食品级微生物[1],是蔬菜、肉、鱼和乳制品发酵食品中天然的微生物成分,也是人和动物胃肠道内的益生菌。自2001年获得植物乳杆菌WCFS1(Lactobacillus plantarum WCFS1)序列后,其成为乳酸菌研究的模式菌株之一[2]。植物乳杆菌代谢产生具有抑菌活性的细菌素[3],还可形成生物被膜[4],是一类安全的天然食品防腐剂。L. plantarumWCFS1与传统发酵菌株协同发酵,在发酵乳中活性稳定,可抑制后酸化和腐败真菌[5-6],提高食品的营养价值,增加其适口性[7-8]。蔬菜发酵时,植物乳杆菌可产生单宁,使其更适用于植物发酵[9]。植物乳杆菌还对金属铅和镉具有吸附作用[10]。植物乳杆菌噬菌体可导致宿主菌的裂解,并引起菌体死亡,活菌数下降,导致发酵失败,进而造成严重的经济损失[11]。
早在1983年,就已从肉制品发酵剂中分离到植物乳杆菌噬菌体[12]。Yoon等[13]首次从蔬菜发酵制品中分离得到L. plantarum噬菌体SC921。Lu Zhongjing等[14]从腌制黄瓜中分离得到1 株L. plantarum噬菌体φJL-1。Lanza等[15]第一次从橄榄发酵液中分离出植物乳杆菌噬菌体。研究结果证实,蔬菜发酵液中存在较为丰富的植物乳杆菌噬菌体[16]。此外,还有研究人员从玉米青贮和奶制品中分离出植物乳杆菌噬菌体[17-19]。有文献曾对近60 a以来发现的231 个乳杆菌噬菌体进行总结,根据形态特征,其中有109 株噬菌体属于长尾病毒科,有76 株噬菌体属于肌尾病毒科,仅有1 株噬菌体属于短尾病毒科[20]。
乳杆菌在发酵工业中应用广泛,但噬菌体对乳杆菌的感染却可能导致发酵失败,从而造成严重的经济损失,而且,目前对乳杆菌噬菌体的研究较少[20]。所以,本研究从发酵食品中分离植物乳杆菌噬菌体,研究其生物学特性、理化特性及吸附特性,为制定出有效的噬菌体防控策略提供理论依据。同时筛选抗乳杆菌噬菌体的抗性菌株,为进一步应用于生产实践提供支持。
1 材料与方法
1.1 材料与试剂
1.1.1 样品与菌株
分离样品为泡菜,购买于超市;L. plantarumWCFS1由本实验室保存。
1.1.2 试剂与培养基
DNaseI、RNaseA、绿豆核酸酶、T4 DNA连接酶美国NEB公司;e-Taq、限制性核酸内切酶、Trans2K DNA Marker、Trans15K DNA Marker 宝生物工程(大连)有限责任公司;细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司;丝裂霉素C 哈尔滨医科大学附属第四医院;MRS肉汤培养基 青岛高科技工业园海博生物技术有限公司。
1.1.3 引物
ERIC1、ERIC2为乳杆菌基因组扩增肠杆菌基因间重复一致性(enterobacterial repetitive intergenic consensus,ERIC)序列的引物,用于进行快速指纹图谱分析[21]。引物M13、G1和1254为随机排列的寡核苷酸序列,用于乳杆菌基因组随机扩增多态DNA-聚合酶链式反应(random amplified polymorphic DNA-polymerase chain reaction,RAPD-PCR),检测DNA片段多态性[22]。引物由生工生物工程(上海)股份有限公司合成,引物序列见表1。

表1 引物序列Table 1 Primer sequences used for PCR amplification of target DNA fragments
1.2 仪器与设备
H-7650透射电子显微镜 日本日立公司;DNP-9162电热恒温培养箱 上海精宏实验设备有限公司;Mastercycler nexus PCR仪 德国Eppendorf公司;MA120 DNA电泳仪 美国Bio-Rad公司;PB-10 pH计 德国Sartorius公司;Medifuge小型台式离心机 美国Thermo Fisher Scientific公司;XL-1超速离心机 美国Beckman Coulter公司。
1.3 方法
1.3.1 噬菌体的分离纯化
参照张倩等[23]实验方法,通过双层平板法分离噬菌体,并用连续单斑穿刺法进行纯化。不同之处为培养基使用添加10 mmol/L CaCl2和10 mmol/L MgSO4的MRS肉汤培养基(MCM),指示菌为L. plantarumWCFS1,32 ℃静置培养24 h,半固体MCM培养基为0.4% MCM琼脂培养基。噬菌体加15%的甘油,贮存于-80 ℃。
1.3.2 噬菌体感染宿主菌透射电镜观察
通过负染色法,透射电镜观察噬菌体Lpla感染L. plantarumWCFS1的吸附和释放阶段。具体步骤为:取100 µL过夜培养的L. plantarumWCFS1菌液与100 µL纯化的噬菌体裂解液混匀,32 ℃温育。在15 min和2 h时分别取少量滴于铜网上,10 min后用2%磷钨酸染液(pH 7.0)染色10 s,然后将铜网放于干燥滤纸上,自然干燥后用Hitaclli7100型透射电镜观察。
1.3.3 噬菌体的形态观察和结构蛋白分析
参照文献[24]中λ噬菌体颗粒提取方法浓缩噬菌体Lpla。负染色法透射电镜观察噬菌体形态结构,方法同1.3.2节。利用12%分离胶的十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析噬菌体结构蛋白的组成。
1.3.4 噬菌体包装机制的分析
参照Quiberoni等[25]描述的方法,用酚氯仿法抽提噬菌体基因组,用DNaseI、RNaseA、绿豆核酸酶判定噬菌体基因组性质。将一部分噬菌体DNA用限制性内切酶HindIII、XbaI和NheI进行酶切,另一部分噬菌体DNA用T4连接酶进行连接后再酶切,酶切产物均在70 ℃处理5 min后进行琼脂糖凝胶电泳分析。
1.3.5 噬菌体生物学特性的测定
1.3.5.1 最佳感染复数(multiplicity of infection,MOI)的测定
具体步骤参照张倩等[23],首先测定对数生长期(OD600nm=0.5)的L. plantarum WCFS1菌浓度,再按MOI为0.001、0.01、0.1、1、10接入噬菌体Lpla,32 ℃培养过夜后测定Lpla滴度。
1.3.5.2 一步生长曲线的测定
将噬菌体Lpla以最佳MOI感染对数生长期的L. plantarum WCFS1,32 ℃温育10 min,离心,弃上清液,再将沉淀重悬于预热的MCM培养液中,静置培养于32 ℃,每15 min取适量混悬液并测定Lpla滴度。
1.3.5.3 噬菌体稳定性的检测
检测不同温度、pH值、乙醇、紫外线和糖类对噬菌体Lpla裂解的影响,参照文献[22,25]所描述的方法。
1.3.5.4 噬菌体的吸附性质
参照Quiberoni等[25]所描述的实验方法测定温度、Ca2+和Mg2+和宿主菌生理状态对Lpla吸附的影响。
1.3.6 抗噬菌体菌株的筛选
参照Guglielmotti等[26]的次级感染方法:将噬菌体Lpla以最佳MOI感染对数生长期的宿主菌,32 ℃培养48 h后涂板于MRS固体培养基上,待单菌落长出后连续纯化3 代。将纯化后的菌株和Lpla连续3 代共同培养于MCM液体培养基中,若所得菌株均能正常生长,且斑点实验均不形成透明空斑,则该菌株被确定为抗性菌株。
1.3.7 抗噬菌体菌株的鉴定
1.3.7.1 基因型鉴定
用细菌基因组DNA提取试剂盒提取L. plantarum WCFS1及抗性菌株基因组。以基因组为模板,以ERIC-1、ERIC-2为引物,利用Ex Taq酶进行ERIC-PCR;分别以M13、G1和1254为引物进行RAPD-PCR[22]。将PCR产物进行琼脂糖凝胶核酸电泳。
1.3.7.2 表型鉴定
观察L. plantarum WCFS1及抗性菌株的菌落形态。通过革兰氏染色法观察各菌株的形态;参照伯杰氏菌种鉴定手册,利用微量生化反应管测定抗性菌株的生化特性。
1.3.7.3 稳定性测定
将抗性菌株与噬菌体Lpla共同连续培养40 代,每5 代用双层平板法检测噬菌体,测定噬菌斑效率(effieiency of plaquing,EOP)。EOP为以抗性菌为指示菌测得的噬菌体滴度/以敏感菌为指示菌测得的噬菌体滴度。
1.3.7.4 溶原性测定
将抗性菌株接种于MRS液体培养基,在OD600nm为0.1~0.2时添加丝裂霉素C(0.5 μg/mL),静置培养8 h后10 000×g离心5 min,取上清液,再用双层平板法检测是否存在噬菌体。
1.3.7.5 发酵性能测定
将敏感菌株和抗性菌株分别按2%的接种量接种于12%脱脂乳中,42 ℃培养24 h。每2 h取样,通过平板计数法测定菌株的生长曲线[27]。用0.1 mol/L NaOH溶液滴定至pH 8.4,测定酸化活性,表示为乳酸质量分数[28]。敏感菌株和抗性菌株均分为两组,一组添加1×108个噬菌体Lpla,另一组不添加噬菌体。
1.4 数据及图像处理
使用SPSS 19.0软件进行统计分析,比较组间差异性。P<0.05,差异显著,有统计学意义;P<0.01,差异极显著。使用Photoshop软件进行添加标尺等图像处理。
2 结果与分析
2.1 噬菌体的分离纯化
从泡菜中分离到L. plantarum噬菌体,命名为Lpla。噬菌斑呈透明圆形、边缘清晰,直径为1.08 mm,为烈性噬菌体的噬斑特征(图1)。

图1 Lpla噬菌斑Fig. 1 Plaques of phage Lpla
2.2 噬菌体感染宿主菌形态观察
Lpla与L. plantarum混合15 min时,菌体表面聚集了一定数量的噬菌体(图2B、C)。混合培养2 h时,细菌细胞壁溶解,边缘模糊(图2D)。表明Lpla可吸附并裂解L. plantarum WCFS1。

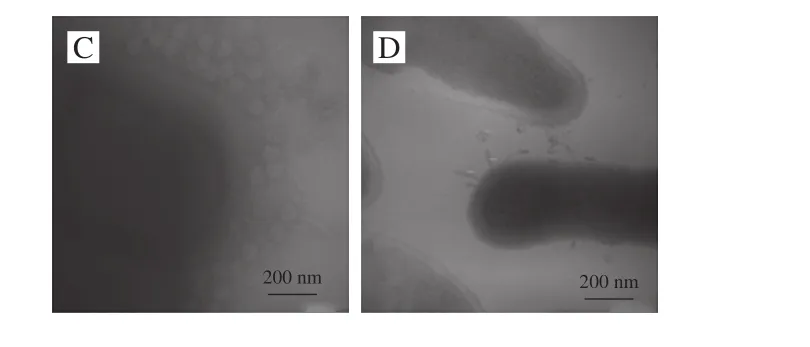
图2 Lpla侵染L. plantarum透射电镜图Fig. 2 Transmission electron micrograph of L. plantarum infection with Lpla
2.3 噬菌体颗粒的形态观察和结构蛋白分析
通过透射电镜观察,噬菌体Lpla具有多面体头部,直径约为72 nm;具有非收缩性可弯曲的尾部,长约126 nm;尾部有尾鞘和复杂的基板(图3A),根据形态将其归为有尾噬菌体目,长尾噬菌体科,B1类。SDSPAGE分析Lpla有5 个主要结构蛋白,其中一个分子质量约为45 kDa,其余条带较弱,分子质量分别约为 70、35、20 kDa和15 kDa(图3B)。
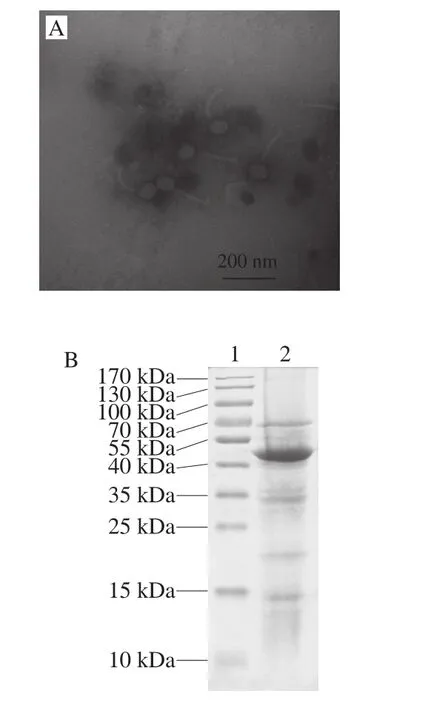
图3 Lpla透射电镜形态(A)及结构蛋白SDS-PAGE图谱(B)Fig. 3 Transmission electron micrograph of Lpla (A) and SDS-PAGE analysis of Lpla structure proteins (B)
2.4 噬菌体包装机制分析
噬菌体Lpla基因组可被DNaseI酶解、不被RNaseA和绿豆核酸酶酶解,说明Lpla基因组为双链DNA。Lpla基因组经HindIII、XbaI和NheI酶切,泳道3、5、7分别与4、6、8相比,酶解产物的条带数没有变化,说明噬菌体Lpla为pac-型包装方式(图4)。
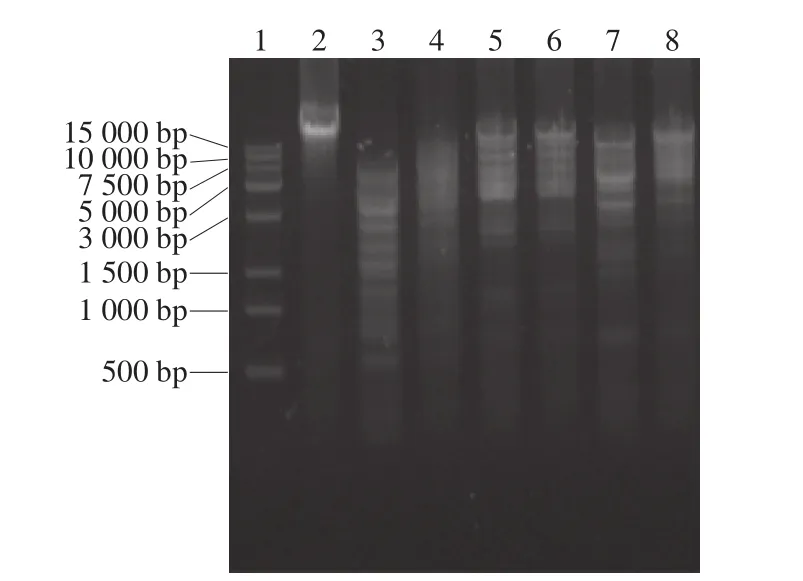
图4 噬菌体Lpla基因组酶切电泳图谱Fig. 4 Electropherogram of Lpla genome digestion with restriction endonucleases
2.5 噬菌体的生物学特性
2.5.1 噬菌体最佳MOI
当M O I为0.1时噬菌体L p l a滴度最高,可达(7.2±0.2)×108PFU/mL,与其他组相比差异极显著(P<0.01)(表2)。

表2 最佳MOI的测定Table 2 Optimal multiplicity of infection of phage Lpla
2.5.2 噬菌体一步生长曲线
由一步生长曲线可知噬菌体Lpla潜伏期为15 min,裂解期为180 min,裂解量为43 PFU/cell(图5)。
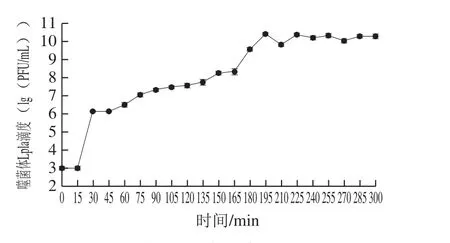
图5 噬菌体Lpla的一步生长曲线Fig. 5 One-step growth curve of Lpla
2.5.3 噬菌体的稳定性
将噬菌体Lpla经10%乙醇溶液处理20 min后,可致46%失活;处理40 min后,70%失活。经25%乙醇溶液处理10 min后,76%失活,处理40 min后,几乎全部失活。35%、50%和75%乙醇溶液分别处理噬菌体10 min即可全部失活(图6A)。Lpla在37 ℃处理后,不影响其活性;45 ℃处理10 min后,93%失活;在56 ℃处理2 min即可全部失活(图6B)。Lpla经紫外线照射10 min后,79%失活;紫外线照射20 min后,98%失活(图6C)。当pH值为2时,噬菌体Lpla滴度下降5 个数量级;当pH值为3时,噬菌体Lpla滴度下降1 个数量级;当pH值为4~12时,Lpla滴度基本不变(图6D)。葡萄糖、半乳糖、甘露糖、海藻糖、核糖、阿拉伯糖和果糖对Lpla均有较好的吸附作用(P<0.01)(表3)。
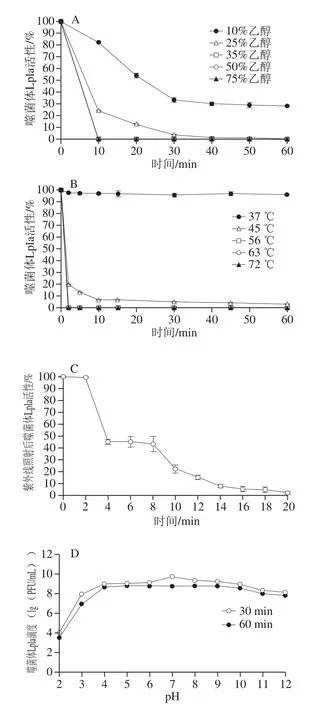
图6 噬菌体Lpla的稳定性Fig. 6 Evaluation of phage Lpla stability

表3 不同糖类对噬菌体的吸附作用Table 3 Adsorption of phage Lpla by different saccharides
2.5.4 不同理化因素对噬菌体吸附性质的影响
在4 ℃时,Lpla对宿主菌的吸附率最高,可达98.3%。25 ℃时,吸附率为44%,32 ℃时,吸附率为36.17%(图7A)。Lpla在MRS-Ca、MRS-Mg和MCM培养液中的吸附率均大于在MRS液体培养基中的吸附率,且MRS-Ca培养基效果最好(图7B)。同正常细胞相比,噬菌体Lpla对灭活宿主细胞的吸附率下降了20%(图7C)。

图7 物理条件及化学试剂对噬菌体吸附性质的影响Fig. 7 Effects of physical and chemical agents on phage Lpla adsorption
2.6 抗噬菌体菌株的筛选鉴定结果
采用次级感染法筛选L. plantarumWCFS1自发突变抗噬菌体菌株。挑取20 个单菌落,通过鉴定后,确定6 株为抗噬菌体菌株,分别命名为L. plantarumWCFS1(01~06)。
2.6.1 基因型分析
抗性菌与敏感菌L. plantarumWCFS1 ERIC-PCR图谱一致(图8A),说明抗性菌为敏感菌自发突变。引物M13、G1和1254扩增的抗性菌与敏感菌L. plantarumWCFS1 RAPD-PCR图谱一致(图8B),说明抗性菌与敏感菌具有遗传同源性,不是污染菌株。

表4 敏感菌与抗性菌的生化反应结果Table 4 Biochemical reactions of sensitive strains and phage-resistant mutants
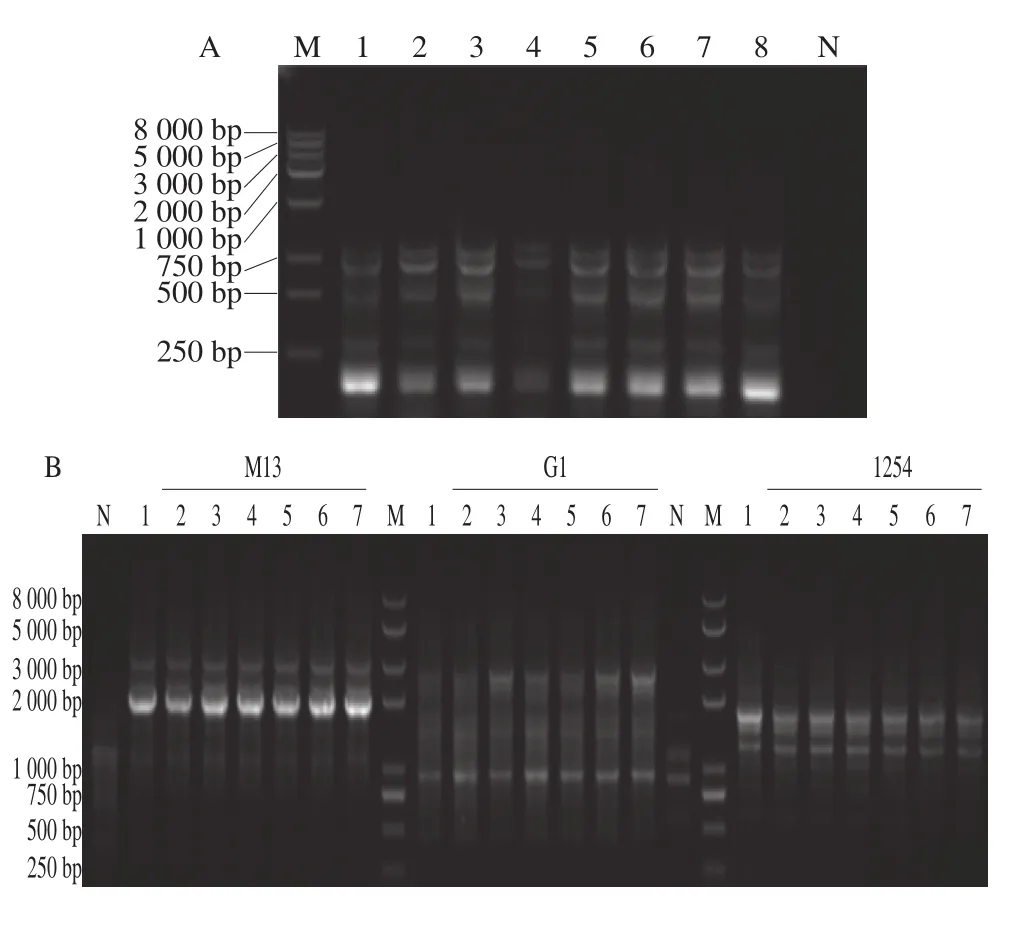
图8 敏感菌和抗性菌的DNA指纹图谱Fig. 8 DNA fi ngerprints of sensitive strains and phage-resistant mutants
2.6.2 抗噬菌体菌株表型特征

图9 敏感菌与抗性菌的形态特性Fig. 9 Morphology of sensitive strains and phage-resistant mutants
敏感菌L. plantarumWCFS1及抗噬菌体菌株的菌落均为乳白色、圆形、边缘不整齐和中间凸起的菌落(图9A、B)。经革兰氏染色,敏感菌和抗噬菌体菌株均为革兰氏阳性杆菌(图9C、D)。抗噬菌体菌株与L. plantarumWCFS1的菌落和菌体形态无明显区别,且抗噬菌体菌株与L. plantarumWCFS1生化反应结果一致(表4)。
2.6.3 抗噬菌体菌株的遗传稳定性
将L. plantarumWCFS1及抗噬菌体菌株共同连续培养40 代,均无噬菌体裂解现象。第40代,斑点实验Lpla可裂解L. plantarumWCFS1,形成空斑,却不裂解抗性菌株(图10)。说明抗性菌株具有遗传稳定性,且EOP小于10-5。

图10 L. plantarum WCFS1(A)与抗性菌L. plantarum WCFS1 01(B)斑点实验结果Fig. 10 Plaque test of sensitive strains (A) and phage-resistant mutants (B)
2.6.4 抗噬菌体菌株溶原性测定结果
经丝裂霉素C诱导的抗性菌株菌液上清中均未检测到噬菌体颗粒,不存在释放噬菌体的安全隐患。
2.6.5 抗噬菌体菌株发酵性能测定结果
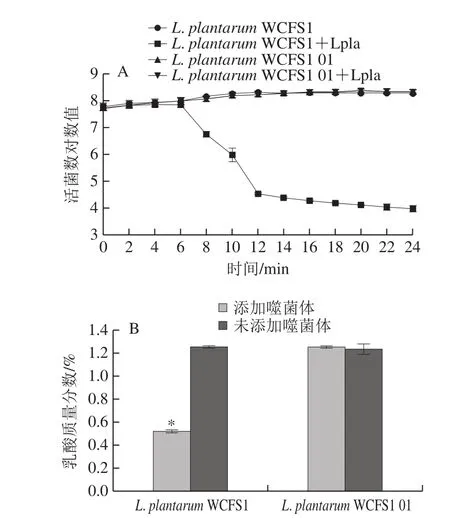
图11 敏感菌和抗性菌的生长曲线(A)和酸化活性(B)Fig. 11 Growth curves (A) and acidification activity (B) of sensitive strains and phage-resistant mutants
敏感菌与抗性菌在12%脱脂乳中培养,生长状态良好。敏感菌添加噬菌体Lpla培养时,活菌数明显下降,而抗性菌与噬菌体Lpla培养时,活菌数变化不明显(图11A),说明抗性菌在发酵时的生长特性与敏感菌一致。不添加噬菌体时,抗性菌与敏感菌的产酸量没有明显差异,说明抗性菌的产酸能力与敏感菌一致。添加噬菌体后,敏感菌的产酸量明显下降,抗性菌产酸量无明显变化(图11B)。
3 讨 论
近年来,乳酸菌噬菌体的相关研究发展迅速,但我国目前关于植物乳杆菌噬菌体的报道仍然较少。国外学者曾从肉制品发酵剂、青贮饲料、奶制品和腌制黄瓜中分离出植物乳杆菌噬菌体[26],但目前只获得6 株植物乳杆菌噬菌体的全基因组序列。
本研究分离得到的L. plantarum WCFS1噬菌体Lpla为烈性噬菌体,分析理化因素对Lpla裂解及吸附的影响,可为制定防治噬菌体感染的有效策略提供理论依据。噬菌体Lpla对热较为敏感,56 ℃处理2 min即可全部失活,但植物乳杆菌噬菌体P1在50 ℃处理30 min仍生长良好[19],噬菌体fri在70 ℃处理5 min才失活[29],说明Lpla的热稳定性比其他植物乳杆菌噬菌体弱。而与其他可耐受50%乙醇的乳杆菌噬菌体phiLdb[30]和Lcb[31]相比,Lpla对乙醇较为敏感,同时,Lpla对紫外线亦不耐受。而且,葡萄糖、半乳糖、甘露糖、海藻糖、核糖、阿拉伯糖和果糖均可吸附噬菌体。所以,生产过程中可通过添加上述糖类吸附噬菌体,从而抑制其对宿主菌的吸附。利用高温、紫外线和乙醇可以灭活生产环境中的噬菌体。本研究证实Lpla在25 ℃和32 ℃时吸附率下降,而植物乳杆菌最适生长温度为30~35 ℃,因此,在发酵过程中,可通过降低温度减少噬菌体吸附[32]。同时也可在生产中通过使用不添加Ca2+和Mg2+的生产介质,来降低Lpla的吸附率。
目前,在生产实践中,已通过优化生产环境和使用噬菌体抑制剂等多种措施来预防噬菌体的污染。但噬菌体污染现象在工业生产中仍普遍存在。因此,抗噬菌体菌株的筛选和构建具有重要的实践意义[22]。而次级感染法是一种可获得自发突变抗噬菌体菌株的方法,操作简便,不涉及遗传操作[26]。故本研究采用此方法筛选对噬菌体Lpla具有抗性的植物乳杆菌,抗性菌株与敏感菌株形态、生化特性及发酵性能无差别,基因型分析表明抗性菌株源于敏感菌,且抗性具有遗传稳定性,为其进一步应用于生产实践提供支持。
