翡翠贻贝副肌球蛋白的特性及在模拟胃肠液中的消化
2019-04-12张凌晶林丽云李钰金刘光明曹敏杰
邹 睿,张凌晶,2,钟 婵,翁 凌,2,林丽云,李钰金,刘光明,2,曹敏杰,2,*
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.水产品深加工技术国家地方联合工程研究中心,福建 厦门 361021;3.泰祥集团 山东省海洋食品营养研究院,山东 荣成 264309)
贻贝属于双壳类海洋软体动物、瓣鳃纲、贻贝科,有较高的营养价值和一定的药用价值。近年来,我国贻贝产量不断增长,2016年已达87.9万 t[1],尤其在山东、浙江、福建等沿海省份,贻贝已成为一种重要的经济贝类。
贝类肌肉中存在的副肌球蛋白(paramyosin,PM)是一种较为特殊的肌原纤维蛋白,常见于无脊椎动物中,在脊索动物中较为罕见[2]。研究表明,PM位于无脊椎动物粗肌丝的核心组成部分,与粗肌丝的伸缩运动有关,是一种重要结构蛋白[3-5]。无脊椎动物肌肉中PM含量的高低会显著影响其质构。有研究报道,在虾夷扇贝闭壳肌中,PM含量高的平滑肌质地更加脆硬[6]。
近年研究发现,诸如血吸虫、尘螨等多种寄生虫PM具有显著抗原特性,能够在人及牲畜体内引起较强的过敏反应[7-9]。Suzuki等[10]通过血清学实验也证实在软体动物中,除原肌球蛋白(tropomyosin,TM)外,PM也是一种主要的过敏原,且两者之间存在IgE交叉反应性。
贝类肌肉中PM丰度高,在肌原纤维中的相对含量可达20%~40%[11],但目前国内外对其研究仍较少。前期研究对来源于皱纹盘鲍的PM进行分离纯化并对其生物化学性质进行探讨[12]。本研究拟以我国高产的翡翠贻贝为研究对象,从其肌肉中分离纯化PM,并对PM在模拟胃肠液中的消化稳定性进行分析,以期为贝类深加工以及PM的后续研究提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
鲜活翡翠贻贝(每只带壳均质量(35±5)g)购买于厦门集美菜市场,放置冰盒内带回实验室,在4 ℃冷库内开壳后取其肌肉置于冰上,并于2 h内用于实验。
预染标准分子蛋白 美国New England Biolabs公司;猪胃蛋白酶(酶活力250 U/mg)、牛胰凝乳蛋白酶(酶活力40 U/mg) 美国Sigma公司;猪胰蛋白酶(酶活力250 U/mg) 上海麦克林生化科技有限公司;Protein A Sepharose 美国GE Healthcare公司;5 mL羟基磷灰石预装柱 美国Bio-Rad公司;HRP标记的羊抗兔IgG美国Pierce公司。其他试剂均为分析纯。
1.2 仪器与设备
PT 2500 E组织捣碎机 瑞士Kinematica公司;Avanti JA-25高速冷冻离心机 美国Beckman公司;G-BOX凝胶成像仪 英国Syngene公司;Fluor Chem Q化学发光成像仪 法国Alpha Innotech公司;Chirascan圆二色谱仪 英国Applied Photophysics公司。
1.3 方法
1.3.1 蛋白含量的测定
利用微量蛋白核酸测定仪对层析过程中样品的吸光度A220nm及A280nm进行测定。参照Bradford等[13]方法对用于模拟胃肠液消化实验的蛋白进行定量测定,并对样品蛋白浓度作适当调整。将40 μL样品与2 mL考马斯亮蓝G-250染料室温反应5 min后,测定其在595 nm波长处的吸光度,以牛血清白蛋白为标准蛋白建立标准曲线,每组实验重复测定3 次。
1.3.2 样品的制备与纯化
肌原纤维的提取参照Cao Minjie等[14]的方法,其他纯化步骤主要参考Suzuki等[10]方法,并作适当调整。将新鲜贻贝肌肉切碎后称质量,加入料液比1∶10(g/mL)的冰冷缓冲液A(10 mmol/L磷酸缓冲液(phosphate buffer saline,PBS),含0.5 mmol/L L-半胱氨酸和0.15 mol/L NaCl,pH 6.8),捣碎。4 ℃、8 000×g离心10 min,弃去上清液,取沉淀,重复此操作5~6 次。最后一次获得的沉淀中加适量缓冲液B(10 mmol/L PBS,含0.5 mol/L NaCl和0.1% β-巯基乙醇,pH 6.8)充分溶解后,4 ℃、12 000×g离心20 min,收集上清液,即得到肌原纤维蛋白。在上清液中加入MgCl2至终浓度1.5 mmol/L,4 ℃搅拌12 h后20 000×g离心30 min。收集上清液,进行15%~25%硫酸铵盐析,所得沉淀加适量缓冲液B溶解后并充分透析于缓冲液B。样品经0.22 μm滤膜过滤后上样于羟基磷灰石层析柱,用缓冲液B对未吸附部分进行流洗,吸附部分蛋白用10~200 mmol/L的缓冲液(含0.5 mol/L NaCl和0.1% β-巯基乙醇,pH 6.8)进行线性洗脱,最终得到纯化的PM。
1.3.3 质谱鉴定
将纯化的PM进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),考马斯亮蓝染色后对目标蛋白进行切胶回收,并用胰蛋白酶进行酶解,将酶解片段进行串联飞行时间质谱分析,一级质谱扫描范围为800~4 000 Da。在一级质谱结果中选择信噪比大于50的肽段进行二级质谱分析,所得数据于NCBInr数据库进行肽段序列检索。质谱鉴定过程委托上海生命科学研究院蛋白质组研究分析中心完成。
1.3.4 兔抗PM多克隆抗体的制备
制备抗体的PM来源于皱纹盘鲍,参考游银川等[12]方法从皱纹盘鲍肌肉中获得纯化的PM,并免疫新西兰大白兔制备兔抗PM多克隆抗体。将1 mg/mL纯化PM与等体积的弗氏完全佐剂充分混合后对成年新西兰雄兔进行皮下注射,完成初次免疫。间隔2 周后将PM与等体积弗氏不完全佐剂充分混合并对兔进行加强免疫。加强免疫3 次后,取少量兔耳动脉血清检测其效价及特异性,指标达到要求后进行颈动脉取血。取得的血液在4 ℃静置4 h后,4 ℃、8 000×g离心15 min,收集血清。免疫过程委托厦门大学药学院实验动物中心完成。
利用Protein A Sepharose亲和层析柱对血清中的IgG抗体进行纯化。将血清与0.1 mol/L三(羟甲基)氨基甲烷盐酸(tris(hydroxymethel) aminomethane-HCl,Tris-HCl,pH 8.0)缓冲液等体积混合后上样于Protein A Sepharose亲和层析柱,依次用0.1 mol/L Tris-HCl(pH 8.0)缓冲液和10 mmol/L Tris-HCl(pH 8.0)缓冲液对未吸附部分进行流洗,吸附部分用0.1 mol/L甘氨酸-HCl(pH 3.0)缓冲液进行洗脱并收集,立即用0.5 mol/L Tris-HCl(pH 8.8)中和,最终得到纯化的兔抗PM多克隆抗体。
1.3.5 PM的热变性温度及热稳定性分析
以梯度降低透析外液浓度的方式对纯化PM进行脱盐,最终将样品以超纯水充分透析。利用圆二色谱测定PM的热变性温度,以超纯水作为空白对照。扫描波长范围为185~260 nm,扫描温度为20~90 ℃。
通过水浴加热的方式对纯化PM的热稳定性进行分析。在500 μL离心管中加入等量PM,将样品分别置于30~100 ℃水浴锅中加热30 min,加热完毕后立即冷却至室温。以体积比3∶1向样品中加入4×SDS缓冲液,95 ℃加热10 min完成SDS化,低速离心后取上清液进行SDSPAGE分析。
1.3.6 PM的pH值稳定性分析
先配制一系列相同浓度(0.2 mol/L)、不同pH值(3~11)的缓冲液(含0.5 mol/L NaCl和0.1% β-巯基乙醇),再取等量的PM分别加入到不同pH值的缓冲液中,充分混匀后置于4 ℃孵育1 h。结束后立即95 ℃加热10 min完成SDS化,低速离心后取上清液进行SDS-PAGE分析。
1.3.7 贻贝肌肉蛋白的模拟胃肠液总消化
参照美国药典[15]的方法配制模拟胃、肠液,对贻贝肌肉蛋白进行体外模拟胃肠液总消化实验,参考万楚君等[16]方法,并在其基础上适当调整。新鲜贻贝肌肉经100 ℃加热10 min后切碎,以料液比1∶10(g/mL)加入0.25 mol/L NaCl溶液进行组织捣碎,后置于冰上间歇20 s,重复此操作4~5 次,直至肌肉被充分捣碎,Bradford法测得其质量浓度为8.5 mg/mL。所用消化酶分别为猪胃蛋白酶(250 U/mg)、猪胰蛋白酶(250 U/mg)及牛胰凝乳蛋白酶(40 U/mg),配制3 种酶使其质量浓度均为0.85 mg/mL。取300 μL肌肉匀浆样品与等体积不含胃蛋白酶的模拟胃液(pH 1.2)混合,加入60 μL胃蛋白酶,37 ℃反应60 min后,加入25 μL 浓度为1 mol/L的NaOH溶液调节pH 7.5。此后,在样品中加入60 μL胰蛋白酶并反应120 min,继续加入60 μL胰凝乳蛋白酶再反应120 min,然后将样品在95 ℃加热5 min,终止反应。
1.3.8 PM的模拟胃液消化
对PM的消化稳定性分析主要参考Huang Yuanyuan等[17]的方法。模拟胃液消化过程中所用酶为胃蛋白酶,活力及用量与上述贻贝肌肉总蛋白消化一致。将200 μL PM样品与200 μL不含胃蛋白酶的模拟胃液混匀后,加入40 μL胃蛋白酶,在37 ℃反应0、1、5、10、15、30、45、60 min时取出60 μL样品,加入5 μL NaOH溶液(1 mol/L)终止反应,然后进行SDS-PAGE分析。对照组加入等量不含胃蛋白酶的模拟胃液。
1.3.9 PM的模拟肠液消化
分别用胰蛋白酶和胰凝乳蛋白酶对PM进行模拟肠液消化稳定性分析,反应体系与模拟胃液消化一致,酶与PM质量比均为1∶50,反应时间分别为0、5、15、30、60、120、180、240 min,对照组加入等量不含酶的模拟肠液。
1.4 数据处理
采用Excel 2007软件对数据进行整理,Adobe Illustrator CS5软件处理图像。
2 结果与分析
2.1 PM分离纯化结果
由图1、2可知,贻贝肌原纤维蛋白中的PM经过饱和度15%~25%硫酸铵盐析后得到富集,再经过羟基磷灰石柱层析后,目标蛋白在PBS浓度为0.15 mol/L左右时被洗脱下来,SDS-PAGE结果显示为单一条带,分子质量约为99.5 kDa。

图1 翡翠贻贝PM的羟基磷灰石柱层析Fig. 1 Elution curve of PM from Perna viridis by hydroxyapatite chromatography

图2 PM的SDS-PAGEFig. 2 SDS-PAGE profile of PM
2.2 质谱鉴定结果
将纯化的PM经胰蛋白酶酶切后得到肽段的一级质谱图,其中每个峰代表一个肽段(图3)。将所得数据在NCBI上进行序列检索,得到26 个肽段,共计330 个氨基酸残基(表1)。

图3 翡翠贻贝PM肽质量指纹一级质谱图Fig. 3 PMF of purified PM digested by trypsin
如图4所示,翡翠贻贝PM的肽段与地中海贻贝PM序列[18]的一致性为100%,与太平洋牡蛎[19]及盘鲍PM[20]序列一致性分别为77%和72%,表现出较高的同源性,证明纯化的蛋白即为PM。分析地中海贻贝PM氨基酸组成时发现,其芳香族氨基酸含量极低,其中色氨酸(W)数量为1,酪氨酸(Y)数量为14,苯丙氨酸(F)数量为5,该蛋白在280 nm波长处的吸光度低。这也是在纯化PM时需在220 nm波长处进行蛋白检测的原因。

图4 翡翠贻贝PM与盘鲍(Haliotis discus discus)、太平洋牡蛎(Crassostrea gigas)以及地中海贻贝(Mytilus galloprovincialis)PM的序列比对Fig. 4 Peptide alignment of PM from Perna viridis with those from Haliotis discus discus, Crassostrea gigas and Mytilus galloprovincialis
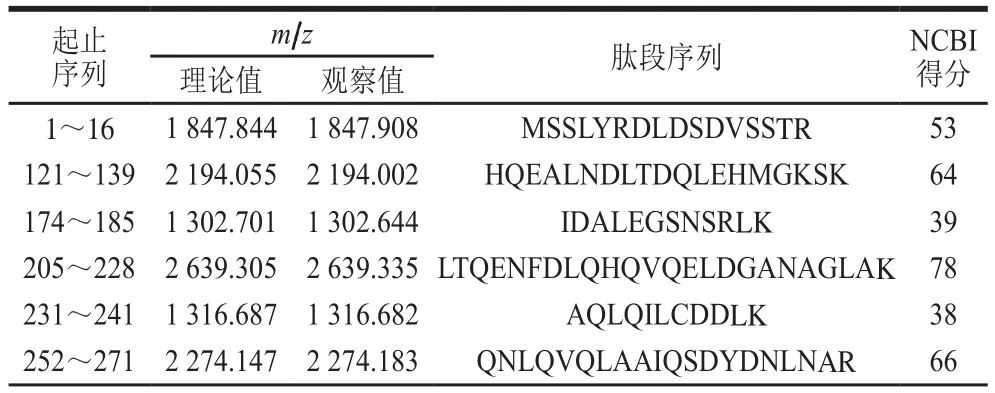
表1 翡翠贻贝PM质谱所得肽段序列Table 1 Peptide sequences of PM
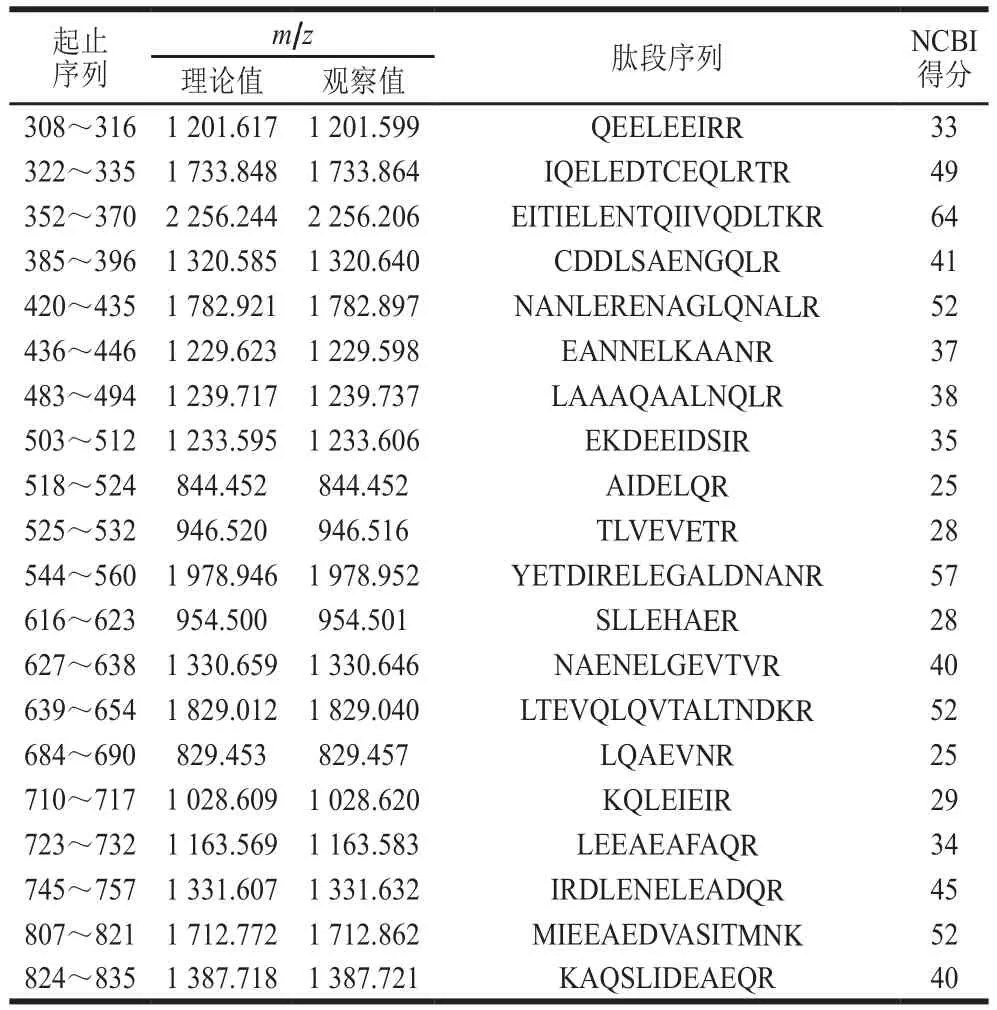
续表1
2.3 PM的二级结构及变性温度分析
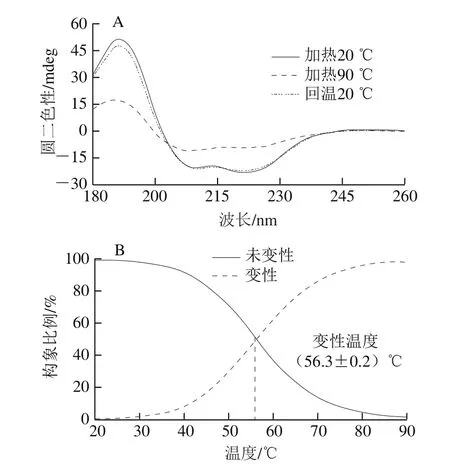
图5 加热对PM二级结构的影响(A)及其热变性温度(B)Fig. 5 Effects of temperature on secondary structure of PM (A) and its thermal denaturation temperature (B)
由图5可知,PM呈现典型的α-螺旋结构。加热会导致其正、负吸收峰值减少,温度回复之后其吸收峰值基本恢复至原值,表明在该加热过程中,其二级结构的变化是可逆的(图5A)。其热变性温度为(56.3±0.2)℃(图5B)。
2.4 PM的热稳定性及pH值稳定性分析
将贻贝PM经过30~100 ℃热处理30 min,低速离心后,对其上清液进行SDS-PAGE分析,由图6可知,蛋白条带浓度并没有发生明显变化,表明PM的热稳定性良好。

图6 PM的热稳定性分析Fig. 6 Thermostability of PM
由图7可知,PM在pH值为6~11范围内均能够保持较好的稳定性。但当pH值为5时,PM出现部分聚集沉淀现象,pH值低至3~4时,聚集沉淀现象更为明显,低速离心后上清液中的蛋白量明显减少,说明PM在中性条件下稳定性良好,但在酸性条件下不稳定。

图7 PM在不同pH值的稳定性分析Fig. 7 pH stability of PM
2.5 贻贝肌肉蛋白的模拟胃肠液总消化结果
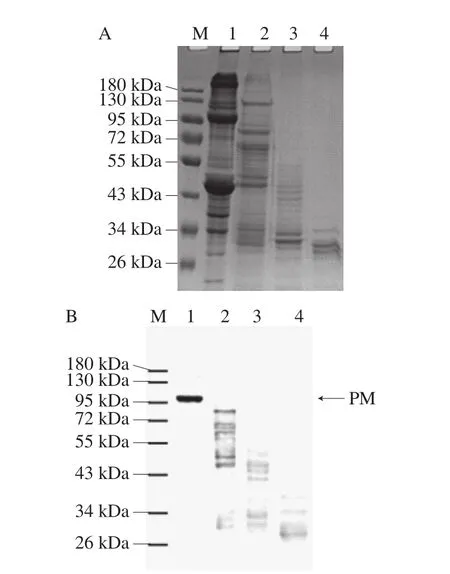
图8 贻贝肌肉蛋白模拟胃肠液消化的SDS-PAGE(A)和Western blot分析(B)结果Fig. 8 SDS-PAGE (A) and Western blot analysis (B) of simulated gastrointestinal digests of Perna viridis muscle proteins
从图8可以看出,贻贝肌肉蛋白经过不同的酶消化后,均发生不同程度的降解。经过胃蛋白酶消化后,大部分蛋白都已被降解,但分子质量在30~130 kDa的降解片段依然存在。经过胰蛋白酶消化后,绝大部分蛋白被降解成小分子片段。经胰凝乳蛋白酶消化后,这些片段被进一步降解,但最后仍有分子质量为30 kDa左右的部分小片段未被完全消化。利用兔抗皱纹盘鲍PM多克隆抗体对各阶段的消化产物进行Western blot分析发现,这些未降解的条带均来源于PM。
2.6 模拟胃液和肠液消化稳定性分析

图9 PM模拟胃、肠液消化的SDS-PAGE分析Fig. 9 SDS-PAGE analysis of simulated gastrointestinal digests of PM
由图9a可知,PM原始片段在1 min之内就被胃蛋白酶全部降解成分子质量约为80 kDa的片段。随着时间延长,该片段逐渐被降解成小分子片段。但在反应60 min后,80 kDa的片段仍没有被全部降解,并且在70 kDa及55 kDa的位置产生较稳定的片段,表明PM是一种比较耐胃蛋白酶消化的蛋白。
与模拟胃液消化结果相比,在模拟肠液消化过程中,PM会被降解成更多更小的片段。从图9b可以看出,PM的原始片段在短时间内就被胰蛋白酶全部降解,并且在55~72 kDa区间内产生降解片段。随着时间的延长,这些片段也被进一步消化,但即便反应240 min后,PM依然未被完全消化,在分子质量约为52 kDa处产生一稳定的片段,而最小可见蛋白条带的分子质量约为43 kDa。胰凝乳蛋白酶对PM的降解程度与胰蛋白酶较为相似,SDS-PAGE图中最小可见蛋白条带的分子质量约为45 kDa(图9c),表明PM对胰蛋白酶和胰凝乳蛋白酶也具有较高的耐受性。
3 讨 论
贝类、头足类等水产动物肌肉中的PM是一种典型的盐溶性蛋白,只溶于高盐缓冲液,在低盐环境下易析出。周茹等[21]对秘鲁鱿鱼肌原纤维蛋白的盐离子浓度依赖性进行研究,结果显示,当盐浓度≤0.4 mol/L时,肌原纤维蛋白中的PM以及其他蛋白的溶解性会随着盐浓度的升高而增大;在0.4~0.8 mol/L内,随着盐浓度的上升,原肌球蛋白与肌球蛋白重链的相对含量均呈现逐渐上升的趋势,而PM相对含量会略有减少。因此,为提高PM的纯化效果,本研究在Suzuki等[10]纯化PM的方法(PBS中的盐浓度为0.9 mol/L)基础上加以改进,将PBS盐浓度调整为0.5 mol/L,在保证PM有较高的溶解性的同时避免过多盐溶性杂蛋白的融入。
Suzuki等[10]对6 种软体动物肌肉的盐溶性蛋白进行100 ℃热抽提10 min后,发现PM含量大幅减少,而TM无明显变化,因此认为,PM热稳定性较TM差,会因热变性而形成沉淀。Zhu Beiwei等[22]在研究加热对鲍鱼肌肉质构和显微结构的影响研究中也发现,当温度升至50 ℃时,肌肉中PM含量随着温度的上升逐渐减少。而本研究对纯化翡翠贻贝PM的热稳定性分析结果显示,PM经过100 ℃加热30 min后并没有沉淀产生。圆二色谱分析也显示虽然在高温下PM的二级结构发生明显改变,但温度恢复后,其结构也随之恢复(图5),这表明在低于100 ℃的条件下,PM的二级结构变化是可逆的,该蛋白是一种耐热蛋白。实际上,PM是一种肌球蛋白结合型蛋白[23-25],而肌球蛋白对热非常不稳定,这也解释了为何肌肉蛋白抽提液中的PM会因为加热而变性沉淀,但纯化PM对热稳定。
分析PM在酸性环境下容易聚集沉淀的原因,是由于溶液pH值接近PM等电点,导致其分子所带电荷减少,分子之间的排斥力减弱,从而聚集产生沉淀。游银川等[12]利用双向电泳测得皱纹盘鲍PM等电点为5.4,通过生物信息学分析获得地中海贻贝(BAA36517.1,Mytilus galloprovincialis)PM等电点为5.0,这与本研究的结果相近。
对贻贝肌肉蛋白的模拟胃肠液总消化发现,经过胃蛋白酶消化后,肌肉中的主要结构蛋白(肌球蛋白重链、PM、肌动蛋白)均发生明显的降解,并产生大量降解条带。这些降解条带继而被胰蛋白酶和胰凝乳蛋白酶降解成分子质量更小的片段,但在反应结束后依然有少量未被完全消化,免疫印迹检测表明未消化的条带均来源于PM。本研究室前期研究报道了生鲜、煮制、干制、罐制4 种加工方式制备的皱纹盘鲍肌肉经模拟胃肠液消化后,所有蛋白被完全降解[16],与本研究结果有一定差异。除物种差异性外,分析原因可能是对鲍鱼的研究中所使用的胰蛋白酶活力(325 U/mg)、胰凝乳蛋白酶活力(59.3 U/mg)及反应时间(4 h)均高于本研究,因此酶解程度较本研究会更彻底。
对PM的模拟胃、肠液消化稳定性分析结果显示,PM在3 种酶的消化作用下分别呈现不同的降解趋势,该结果与张凌晶等[26]报道的太平洋牡蛎肌原纤维蛋白的模拟胃、肠液消化过程中PM的降解趋势较为相似。本研究中,胃蛋白酶、胰蛋白酶及胰凝乳蛋白酶单独消化均未能将PM完全降解。只有在3 种酶连续作用下其降解才较为有效,说明PM是贻贝肌肉中最难被消化的,这可能与PM稳定结构有关。圆二色谱(图5)分析显示PM的二级结构主要为α-螺旋,α-螺旋依靠氢键维持其稳定性。在组成蛋白质的氨基酸中,脯氨酸由于其亚氨基少一个氢原子,无法形成氢键,因此是α-螺旋结构的破坏者。分析地中海贻贝PM序列发现,该蛋白仅有1 个脯氨酸残基,因此,非常有利于其形成稳定的α-螺旋结构。有研究指出,PM在天然状态下由2 条单体互相缠绕形成双螺旋结构[25],这种二聚体形式也在一定程度上增加其对酶水解的抗拒性。但在胃蛋白酶、胰蛋白酶及胰凝乳蛋白酶3 种酶的连续作用下,因为酶切位点的增加,与单一酶水解相比,效率大大增加。
已有研究表明,在软体动物肌肉中,除主要过敏原TM外,PM也是一种过敏原。TM因其较高的热稳定性以及耐消化性,在免疫学领域一直备受学者们的关注[27-29]。PM与TM尽管在分子质量和一级结构序列上有较大差异,它们具有相似的热稳定性和pH值稳定性,还具有相似的IgE结合活性[10]、氨基酸组成[20,30]以及二级结构特征等[31-33]。因此,对贝类PM的研究有待进一步深入。
