酿酒酵母胱硫醚β-裂解酶的异源表达及催化生成糠硫醇
2019-04-12扎木苏杨华青孙宝国王成涛
扎木苏,杨华青,王 鑫,孙宝国,王成涛,*,卢 松
(1.北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京工商大学,北京 100048;2.阜丰集团内蒙古阜丰生物科技有限公司,内蒙古 呼和浩特 010030)
挥发性硫醇类化合物是多种食品(肉制品、水果、蔬菜、茶、咖啡及酒精饮料等)的重要风味成分[1-4],由于其极低香气阈值和独特香气特征[5-6],使其在食品风味形成中扮演着重要角色,成为一类应用广泛的食用香料[7-8]。糠硫醇、3-甲硫基丙醇等硫醇类化合物在中国白酒风味中发挥着特殊作用[9-11],具有强烈的葱香、肉香、烤香和芝麻香等香气特征,被认为是中国芝麻香型白酒的重要香气成分[12-13]。
近年研究发现,微生物来源的β-裂解酶参与硫醇类物质的合成,大部分的细菌具有β-裂解酶活力,可以催化裂解醛-半胱氨酸加合物合成硫醇[14-15]。Tominaga等[16]首次发现细菌和植物来源的C—S β-裂解酶可以催化裂解半胱氨酸加合物生成3-巯基-1-己醇(3-mercapto-1-hexanol,3MH)和4-甲基-4-巯基-2-戊酮(4-mercapto-4-methylpentan-2-one,4MMP)。Swiegers等[17]研究发现大肠杆菌中tnaA基因所编码的色氨酸激酶具有强C—S β-裂解酶活力,该基因超表达的工程菌可有效提升其葡萄酒中硫醇类物质含量。虽然多种细菌具有C—S β-裂解酶活力,但这些细菌通常不是食品级微生物,只有少数食品级微生物具有C—S β-裂解酶活力,如S. cerevisiae含有胱硫醚β-裂解酶(cystathionine β-lyase,Str3p),可裂解胱硫醚中的C—S键。Huynh等[18]研究面包酵母在生物转化制备硫醇中的应用。Thibon等[19]报道葡萄酒中酵母菌可催化半胱氨酸加合物生成硫醇类物质。研究发现,有些酵母来源的基因参与硫醇类物质合成,但这些基因及其编码酶在硫醇类物质合成中的作用仍不明晰。本课题组前期研究中,从芝麻香型白酒大曲中筛选获得1 株酿酒酵母(Saccharomyces cerevisiae)G20,发现菌株可利用半胱氨酸糠醛加合物合成糠硫醇,通过基因超表达和敲除发现Str3基因是糠硫醇合成关键基因[11,20],但其功能还未明晰。
本实验将来源于S. cerevisiae G20的Str3基因重组转化到E. coli BL21中进行超表达,正交设计试验优化重组蛋白Str3p诱导表达条件以提高其表达量,亲和层析纯化后研究Str3p催化生成糠硫醇的能力,该方面研究将为糠硫醇生物转化、发酵食品特征风味形成提供指导。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种和质粒
酿酒酵母(S. cerevisiae)G20由本实验室保存;pEASY-E1、大肠杆菌(Escherichia coli)Trans-T1感受态北京全式金生物技术有限公司;大肠杆菌BL21(DE3)北京天根生化科技有限公司。
1.1.2 培养基与试剂
LB液体培养基:酵母提取物5.0 g/L,胰蛋白胨10.0 g/L,NaCl 10.0 g/L,pH 7.0;LB固体培养基:酵母提取物5.0 g/L,胰蛋白胨10.0 g/L,NaCl 10.0 g/L,琼脂15.0 g/L,pH 7.0。
糠硫醇、L-胱硫醚 美国Sigma公司;半胱氨酸、糠醛、磷酸吡哆醛、咪唑、异丙基硫代半乳糖苷(isopropyl thiogalactoside,IPTG)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA) 北京半夏生物科技有限公司;PrimeSTAR Max Premix(2×)宝生物工程(大连)有限公司;酵母基因组提取试剂盒、高纯质粒小量制备试剂盒、多功能DNA纯化回收试剂盒 北京天根生化科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
PowerPac Basic电泳仪、C1000-Touch聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;小型高速离心机 美国Sigma公司;SPX-150B生化培养箱 上海博讯医疗生物仪器股份有限公司;BioSpectrum凝胶成像仪 美国UVP公司;气相色谱-质谱联用仪 美国Thermo Scientific公司。
1.3 方法
1.3.1 酿酒酵母Str3基因的克隆及重组菌E. coli BL21(pEASY-E1-Str3)的构建
以糠硫醇合成菌株S. c e r e v i s i a e G 2 0的全基因组为模板,设计引物S t r 3-f(ATGCCGATCAAGAGATTAGATACAG)和Str3-r(CTTACAATTTCGAACTCTT)克隆Str3基因,PCR条件:95 ℃变性5 min;95 ℃、30 s,53 ℃退火30 s,72 ℃、8 s,循环30 次;72 ℃延伸10 min。参考pEASY-E1使用说明,将纯化回收的目的片段与质粒pEASY-E1连接,电击转化至大肠杆菌Trans-T1感受态,菌液涂布于200 μg/mL氨苄青霉素LB抗性平板上。37 ℃培养12 h后挑取单菌落、培养,提取质粒经PCR(T7 Prmoter Primer和Str3-r验证阳性克隆)和测序验证,获取表达载体pEASY-E1-Str3。表达载体经热激转化至宿主菌E. coliBL21(DE3),于200 μg/mL氨苄青霉素LB抗性平板上筛选获得阳性重组子E. coliBL21(pEASY-E1-Str3)。
1.3.2 重组E. coliBL21(pEASY-E1-Str3)的Str3p表达
将培养过夜的重组大肠杆菌E. coliBL21(pEASYE1-Str3)按体积分数1%接种到200 mL LB液体培养基(含200 μg/mL氨苄青霉素)中,37 ℃、200 r/min培养至OD600nm值为0.4~0.6,加入终浓度为0.3 mmol/L的IPTG于16 ℃、150 r/min诱导9 h,菌液于4 ℃、6 000 r/min离心10 min,菌体经悬浮、洗涤(0.1 mol/L磷酸缓冲液,pH 7.4)后备用。
1.3.3 Str3p的纯化
1.3.3.1 粗酶液提取[20]
将1.3.2节离心收获的菌体重悬于破壁缓冲溶液(含50 mmol/L Tris,pH 8.0,100 mmol/L KCl,10%甘油,0.25 mmol/L Triton X-100,10 mmol/L咪唑,100 μmol/L磷酸吡哆醛)中,冰水浴超声(225 W,超声6 s,间隔3 s)处理10 min,细胞破碎液在4 ℃、12 000 r/min离心10 min,收集的上清液即为粗酶液。
1.3.3.2 HisSep Ni-NTA纯化Str3p[20]
层析柱经平衡缓冲溶液(20 mmol/L Tris,pH 7.0,250 mmol/L KCl,100 μmol/L磷酸吡哆醛和20 mmol/L咪唑)预平衡,设置流速1 mL/min,将上清液加入层析柱,并用30 mL平衡缓冲液(1 mL/min)进行冲洗,随后用洗脱缓冲液(20 mmol/L Tris,pH 7.0,250 mmol/L KCl,100 μmol/L磷酸吡哆醛,200 mmol/L咪唑)进行洗脱,收集洗脱液并于4 ℃保藏备用。
1.3.4 酶活力测定
参考曹珊珊等[21]的方法,并进行一定修改。设置反应体系为100 μL,在5 mmol/L的L-胱硫醚底物溶液(0.1 mol/L K2HPO4溶液配制,pH 7.4)中加入适量酶液(20 μg/mL),37 ℃水浴保温20 min,然后煮沸2 min终止反应,在反应液中加入100 μL 1 mmol/L的2,4-二硝基苯肼和1 mL 0.4 mol/L的NaOH溶液,室温静置30 min。于520 nm波长测定吸光度,以不加酶液的反应液为对照。以不同浓度的丙酮酸钠标准溶液和2,4-二硝基苯肼反应,绘制丙酮酸钠浓度和吸光度之间的标准曲线。
酶活力定义[21]:1 个酶活力单位(1 U)为37 ℃、pH 7.4、1 h能催化产生1 μmol/L丙酮酸的酶量。
1.3.5 蛋白含量测定
采用Bradford法[20-21]测定蛋白质含量并绘制牛血清白蛋白标准曲线。
1.3.6 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析
细胞破碎上清液和洗脱液经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)分析目的蛋白纯化结果,使用考马斯亮蓝R-250染色。
1.3.7 诱导条件对Str3p表达量的影响
将培养过夜的重组菌E. coliBL21(pEASY-E1-Str3)按体积分数1%接种到200 mL含有200 μg/mL氨苄青霉素LB液体培养基中,37 ℃、200 r/min培养至OD600nm值为0.4~0.6,诱导条件选取IPTG诱导浓度、诱导时间和温度作为影响蛋白表达量的主要因素,研究以上诱导条件对Str3p表达量的影响,同时采用正交设计试验法优化Str3p的表达量。
1.3.7.1 单因素试验
在1.3.7节的培养液中添加IPTG终浓度为0.1、0.3、0.5、0.7、0.9 mmol/L,于16 ℃、150 r/min诱导9 h,收集粗酶液测定酶活力;在培养液中加入终浓度0.5 mmol/L IPTG,控制温度16、20、25、30、37 ℃,150 r/min诱导9 h,收集粗酶液测定酶活力;在培养液中加入终浓度0.5 mmol/L IPTG,于20 ℃、150 r/min分别诱导5、7、9、11、13、15 h,收集粗酶液测定酶活力。
1.3.7.2 正交设计试验优化Str3p酶活力
根据单因素试验结果,选取影响Str3p表达量各因素中有意义的水平,以IPTG浓度、诱导温度和时间为3 个考察因素(表1),选取3 个水平并采用L9(33)正交表进行正交试验设计,确定最适诱导条件并验证。

表1 IPTG诱导条件优化L9(33)正交试验因素与水平Table 1 Factors and levels used in L9 (33) orthogonal array design for optimization of IPTG induction conditions
1.3.8 Str3p催化裂解半胱氨酸-糠醛加合物
半胱氨酸-糠醛加合物制备参考Huynh等[18]的方法。催化反应体系500 μL为:50 μg/mL Str3p、50 mmol/L磷酸缓冲液、pH 5.0~8.0、20 μmol/L磷酸吡哆醛、1 mmol/L EDTA、10 mmol/L半胱氨酸-糠醛加合物,30 ℃水浴保温1 h,以添加灭活蛋白的反应液为空白,检测糠硫醇产量。
糠硫醇的检测参考扎木苏等[20]的方法并稍作修改,取500 μL反应液,分别用0.5 mL二氯甲烷萃取2 次,合并萃取液后4 ℃、12 000 r/min离心10 min,取有机层(下层)液体,经0.22 μm有机滤膜过滤装入小瓶密封冷藏,待分析。
气相色谱-质谱条件:T G-5 M S毛细管柱(30 m×0.25 mm,0.25 μm);进样口温度250 ℃,载气He(99.999 5%),流速1.5 mL/min;不分流进样,进样量1.0 μL;升温程序:初始温度35 ℃持续2 min,以10 ℃/min升至280 ℃,恒温15 min;质谱条件:电子电离源,质谱传输线温度230 ℃,离子源温度230 ℃,溶剂延迟3 min,选择离子对监测,糠醛(m/z96→95)、糠硫醇(m/z81→53)。
1.4 数据处理
实验中每个处理平行重复3 次,采用SPSS 17.0软件进行数据的处理和分析,采用Origin 8.5进行绘图。
2 结果与分析
2.1 酿酒酵母Str3基因克隆及重组质粒pEASY-E1-Str3的构建结果
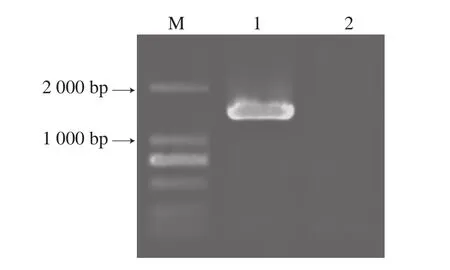
图1 PCR克隆重组质粒pEASY-E1-Str3凝胶电泳图Fig. 1 Electrophoresis of PCR-amplified pEASY-E1-Str3
由图1可知,PCR产物条带约1 400 bp,与预期大小相符。重组质粒经PCR验证和测序分析,确认其大小及测序结果与GenBank中已报道的酿酒酵母Str3基因一致。由图2可知,重组质粒双酶切验证,分别呈现5 700 bp和1 400 bp两条条带,分别与质粒pEASY-E1和Str3基因大小一致;重组质粒条带约7 100 bp,与预期大小相符,说明重组质粒pEASY-E1-Str3构建成功。

图2 重组质粒pEASY-E1-Str3及其酶切凝胶电泳图Fig. 2 Electrophoresis of pEASY-E1-Str3 and restriction enzyme digestion product
2.2 Str3p异源表达工程菌构建
Str3p经E. coliBL21表达,并在其辅因子(磷酸吡哆醛)存在的情况下,利用镍柱纯化,最终获取目的蛋白。如图3所示,目的蛋白分子质量约为52 kDa,这与酿酒酵母Str3p分子质量的理论计算值(52.7 kDa)一致。重组菌在低温条件下诱导,Str3p表达量较高,其质量浓度约为0.89 mg/mL。Holt等[20]同样表达纯化酿酒酵母VIN 13的Str3p,其分子质量约为52 kDa,与本实验结果一致。

图3 SDS-PAGE分析Str3p纯化结果Fig. 3 SDS-PAGE analysis of nickel affinity-purified Str3p
2.3 诱导条件对工程菌E. coli BL21(pEASY-E1-Str3)的Str3p表达量的影响
2.3.1 IPTG浓度对Str3p表达量的影响

图4 IPTG浓度对Str3p酶活力的影响Fig. 4 Effect of IPTG concentration on the activity of Str3p
如图4所示,IPTG浓度对Str3p酶活力变化有显著影响(P<0.05),随其浓度的增加,Str3p酶活力呈现先增后降的趋势,其中最适IPTG诱导浓度为0.5 mmol/L,当IPTG浓度过高时,可能会影响菌株生长和蛋白的表达,进而导致Str3p酶活力降低。
2.3.2 诱导温度对Str3p表达量的影响
由图5可知,诱导温度对Str3p表达量的影响极显著(P<0.01),Str3p最适诱导温度为20 ℃,随着温度的升高,酶活力逐渐下降。通常温度的升高往往会使蛋白错误折叠形成包涵体,从而失去活力,但过低的温度也会导致菌体生长受到抑制,使蛋白表达量下降。因此,适宜的温度条件下诱导,有利于Str3p的表达。

图5 诱导温度对Str3p酶活力的影响Fig. 5 Effect of induction temperature on the activity of Str3p
2.3.3 诱导时间对Str3p表达量的影响

图6 诱导时间对Str3p酶活力的影响Fig. 6 Effect of induction time on the activity of Str3p
如图6所示,诱导时间对Str3p表达量有显著影响(P<0.05),随诱导时间的延长,Str3p酶活力不断上升,当诱导时间大于13 h时,Str3p酶活力急剧下降,因此认为13 h为适宜的IPTG诱导时间。通常诱导时间短,菌体生长仍处于适应期,蛋白表达量较低,以致酶活力降低。随诱导时间的延长,蛋白表达量增加,但同时可能导致目的蛋白降解及菌体老化,使其得率下降,导致酶活力降低。
2.4 正交设计试验优化Str3p酶活力结果

表2 最适诱导条件优化正交试验设计与结果Table 2 Design matrix and experimental data for optimization of ITPG-induced expression of Str3p
根据单因素试验结果,选择对E. coliBL21(pEASYE1-Str3)蛋白表达量影响较大的3 个因素,IPTG浓度(A)、诱导温度(B)和诱导时间(C),采用L9(33)正交表进行正交设计试验,其结果见表2。
由表2可知,3 个因素条件对Str3p表达量的影响大小依次为IPTG浓度>诱导温度>诱导时间,最优诱导条件为A2B2C3,即IPTG浓度0.5 mmol/L、诱导温度20 ℃、诱导时间13 h。按照优化诱导条件进行3 次平行验证实验,Str3p最高表达量为1.26 mg/mL,与未优化时的表达量(0.89 mg/mL)相比,正交试验优化使得Str3p表达量提高41.7%,且在该条件下酶活力较优化前提高38.6%,明显提高Str3p的表达量及其酶活力,满足后续催化实验需求。
2.5 反应液挥发性成分分析
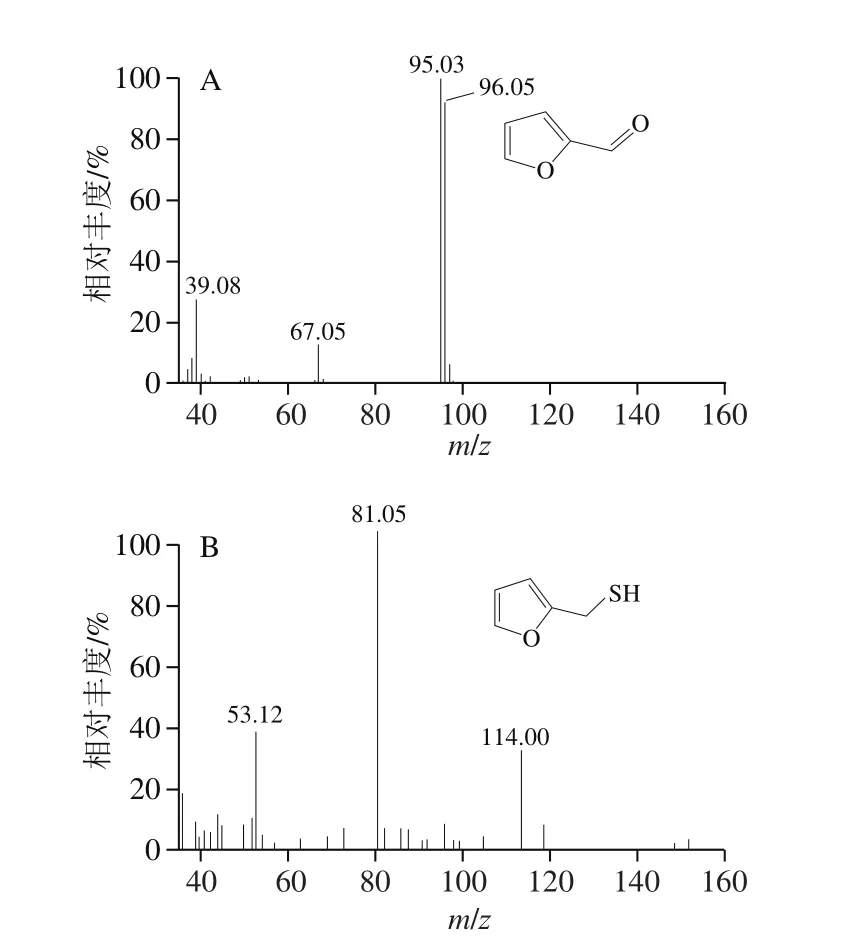
图7 糠醛(A,5.29 min)和糠硫醇(B,6.52 min)气相色谱-质谱全扫描质谱图[11]Fig. 7 Full-scan MS spectra recorded at 5.29 min for furfural (A) and at 6.52 min for 2-furfurylthiol (B)
如图7所示,GC-MS分析发现一个保留时间为5.29 min的目标化合物,其离子流图显示特征离子为m/z95和96,另一个化合物在保留时间为6.52 min处显示的特征离子为m/z53、81和114,这与NIST谱库中糠醛和糠硫醇的特征离子m/z相匹配。


图8 糠醛和糠硫醇选择离子扫描EIC图Fig. 8 Comparison of GC-MS/MS chromatograms recorded for furfural and 2-furfurylthiol
通过考察标准品的出峰情况,同样在相同的保留时间检出上述特征离子,说明反应液中存在这2 种物质。从图8A可以看出,7.4 mmol/L糠醛和49.5 μmol/L糠硫醇的特征离子对分别在5.29 min和6.52 min出峰,图8B是Str3p催化反应液的出峰情况,其定性离子对与标准品出峰保留时间一致,一方面说明定性结果准确可靠,另一方面证实催化反应生成糠硫醇。
2.6 Str3p催化裂解半胱氨酸-糠醛加合物
前期研究工作确认酿酒酵母中Str3基因是糠硫醇合成中的关键基因[12],但还需进一步验证其功能。通过异源表达所得的重组蛋白Str3p,其催化生成糠硫醇情况如图9所示,Str3p酶活力受pH值影响较大(P<0.05),随着pH值的升高,催化效率逐渐增加,当pH 8.0时,催化效率达到最大,在底物浓度10 mmol/L、50 μg/mL的Str3p 1 h能催化产生47 μmol/L的糠硫醇。有学者发现细菌来源的C—Sβ裂解酶能催化合成硫醇类物质[16,22-24],其转化率普遍较低。Holt等[20]报道葡萄酒酿造过程中酿酒酵母V13来源的Str3p能够催化裂解半胱氨酸加合物(Cys-3MH,Cys-4MMP),生成12.3 μmol/L 4MMP和2.1 μmol/L 3MH,该酶在pH7.0时,4MMP的产量为pH 7.5时的47%。本研究中重组Str3p的糠硫醇产量在pH 8.0时较pH 7.0提高了近2.7 倍,说明偏碱性条件有利于催化反应的进行。

图9 不同pH值条件下糠硫醇产量Fig. 9 Production of 2-furfurylthiol at different pH levels
野生酿酒酵母G20中胱硫醚β-裂解酶经异源表达纯化,能够催化裂解半胱氨酸-糠醛加合物生成糠硫醇,进一步明确Str3基因在糠硫醇合成代谢中的作用。多项研究认为,由半胱氨酸加合物(Cys-3MH和Cys-4MMP)生物转化生成3MH和4MMP的量很低(0.1%~10%)[2,19,25-26]。本研究发现在实验室模拟条件下硫醇类物质生物转化率(低于1%)明显低于真实发酵环境(最高达11%)。由于较低转化率和酵母菌对Cys-thiol的间接催化作用,很可能促使大量的前体物质被分解,并作为氮源、碳源或硫源等被机体所利用,这也与前期所发现的结论基本一致,在发酵或体外催化实验中,有大量糠醛、糠醇(糠醛被还原,仅在发酵体系下检测到)生成[12]。因此,对于糠硫醇生物合成分子机制,需要继续挖掘具有高效转化功能的酵母菌株,加强开发体系中这些未被利用的前体物质,以提升白酒及相关发酵食品特征风味。
3 结 论
通过基因工程技术构建高效表达Str3p的工程菌E. coli BL21(pEASY-E1-Str3),正交设计试验优化其蛋白诱导条件,并以半胱氨酸-糠醛加合物为底物,验证Str3p的催化作用。研究发现在诱导剂IPTG浓度0.5 mmol/L、诱导温度20 ℃、诱导时间13 h时,重组Str3p质量浓度为1.26 mg/mL,蛋白表达量和酶活力较优化前分别提高41.7%和38.6%;纯化后Str3p受反应pH值条件影响较大,在pH 8.0时,能够催化裂解半胱氨酸-糠醛加合物(10 mmol/L)生成47 μmol/L糠硫醇。该研究结果将为天然硫醇类香料绿色制造、发酵食品特征风味形成提供理论支持和技术指导。
