甲状腺乳头状癌中线粒体基因组D环区基因突变的研究
2019-04-12浮苗范希景傅媛方莉萍祝骁涛王玉王金华
浮苗 范希景 傅媛 方莉萍 祝骁涛 王玉 王金华
近年来,越来越多的研究证实线粒体DNA(mitochondrial DNA,mtDNA)突变以及线粒体结构和功能异常可能与多种肿瘤的发生相关[1]。mtDNA的非编码区D环主要调控DNA的转录和复制,几乎所有与DNA转录、复制和翻译相关的调控序列都位于该区[2]。D环区作为突变的热点区域,在乳腺、宫颈、胃、结直肠、肺、肝、肾等恶性肿瘤中都表现为高突变率[3],其突变形式主要是单个碱基的突变、缺失、插入大片段的缺失以及微卫星不稳定性(microsatellite instability,MSI)。因此,不可忽视mtDNA D环区突变在肿瘤发生机制中的作用。为了研究mtDNA突变在甲状腺乳头状癌发病机制中的作用,笔者对71例甲状腺乳头状癌患者采用直接测序法分析各标本mtDNA D环区突变,为甲状腺肿瘤病因学研究提供实验依据,并为临床甲状腺肿瘤的诊断和治疗提供参考。
1 对象和方法
1.1 对象 选取我院2017年5月至2018年4月病理诊断为甲状腺乳头状癌的患者71例,所有患者均无血缘关系,无其他组织、脏器肿瘤,无糖尿病等其他现在已知与线粒体突变相关的疾病。男24例,女47例;年龄18~64岁,中位年龄48岁。在药物治疗或放化疗之前采集患者的甲状腺乳头状癌组织和癌旁正常甲状腺组织(距离癌组织5cm以外)以及静脉血2ml。癌组织和癌旁正常组织均经病理检查证实后立即液氮冷冻,其中癌组织在病理医师指导下避开钙化和胶原化区域取其癌细胞丰富部位,癌旁正常组织病理切片光镜下未见肿瘤细胞。
1.2 方法
1.2.1 DNA抽提 使用DNA提取试剂盒(天根公司),提取甲状腺肿瘤组织和血液细胞总DNA。
1.2.2 PCR扩增 D环区的PCR扩增引物采用primer 5.0软件进行设计,由杭州擎科生物公司合成。引物序列如下,L15975F:5′-CTCCACCATTAGCACCCAAAGC-3′,H794R:5′-AGGCTAAGCGTTTTGAGCTG-3′。引物299F GGTGGAAATTTTTTGTTATG,用于测序时从mt16184到mt16193遇到poly结构加测。使用PCR扩增试剂盒进行PCR(日本TaKaRa公司),在PCR反应管中依次加入下列物质:2×PCR Premix 25μl,上游引物1μl,下游引物 1μl,模板 DNA 2μl,灭菌双蒸水补足至终体积为 50μl。PCR 扩增:95℃预变性 5min;94℃变性30s,57℃退火 30s,72℃延伸 40s,35 个循环;72℃延伸4min扩增。取2μl反应产物,在1.5%的琼脂糖凝胶上进行电泳。对于扩增效果良好且足量的样品,进一步进行纯化和测序。
1.2.3 测序 测序委托杭州擎科生物公司进行。测序反应所用引物与PCR反应引物相同,所有样品均进行双向测序。D环区的基因序列与剑桥标准序列(revised Cambridge reference sequence,rCRS)进行比对。在某一位点上癌组织、癌旁组织和外周淋巴细胞碱基一样,而与数据库不同就认为这是一个多态性位点,如果数据库(MITOMAP、mtDB和mtSNP)没有记载就是新发现的多态性位点;癌组织与癌旁组织和外周血碱基不一样,而癌旁正常甲状腺组织和外周血碱基是一样(为除外组织特异性多态),就认为该位点在癌组织中发生突变。在实验中突变型mtDNA和野生型mtDNA同时被扩增,测序反应时表现为套峰,即在同一位点出现两个碱基,且碱基峰线起降一致,周围序列测序基线正常无杂乱峰线即可判定为异质性突变。另外为排除系统误差,对存在mtDNA突变的区域重新进行PCR反应和DNA测序,进一步验证。
2 结果
2.1 甲状腺乳头状癌患者mtDNA D环区PCR扩增结果 扩增各标本mtDNA D环区,所有样品均扩增出1 543 bp片段,见图1。
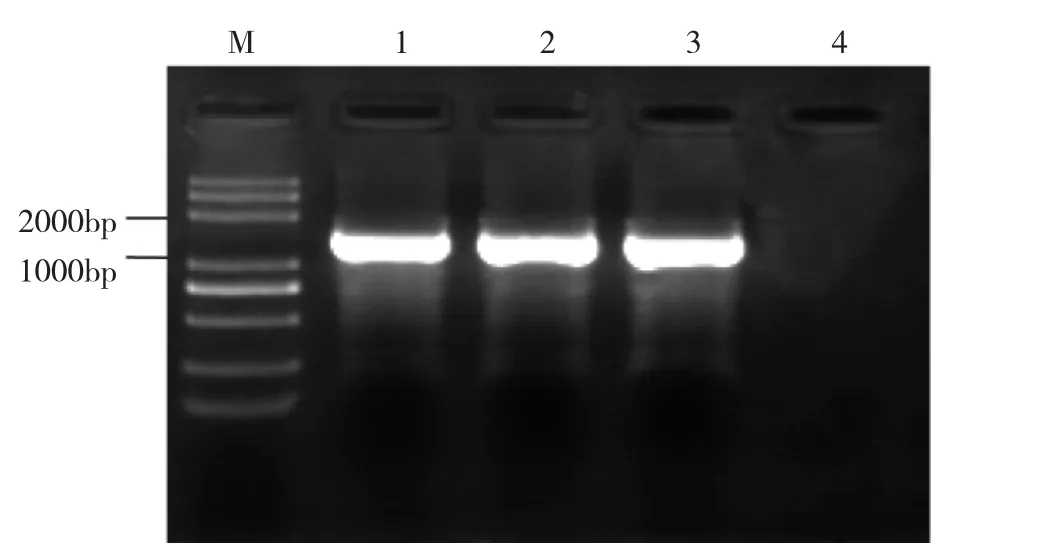
图1 mtDNA D环扩增产物琼脂凝胶电泳图(M:DNA Ladder Marker;1-3:甲状腺乳头状癌组织、癌旁组织、血液mtDNA目的片段PCR扩增产物;4:阴性对照)
2.2 甲状腺乳头状癌患者mtDNA D环区多态性变化情况 本研究中,当甲状腺乳头状癌组织、癌旁组织及外周血测序结果完全一致,而与数据库不同方确定为多态性变化。71例甲状腺乳头状癌患者中发现167个多态性改变,人均变异数为2.35个,146个位点MITOMAP,mtDB和mtSNP数据库均有记载,但有21个位点并未见记载,见表1。

表1 甲状腺乳头状癌mtDNA D环区新的多态性变化
2.3 甲状腺乳头状癌患者mtDNA D环区点突变情况在71例患者中有9例mtDNA D环区点突变,出现了A-G、T-C、C-T、C-A、G-A 等碱基突变,且 66.7%为异质性突变。9例患者中有4例[编号为甲状腺乳头状癌标本(Tc)21、Tc34、Tc38、Tc40]线粒体转录因子 l(mitochon-drial transcription factor l,mtTF1)结合区域发生了突变;另外 5 例(Tc1、Tc16、Tc51、Tc55、Tc62)患者均有突变位于两个高变区:HVR-Ⅰ区(16024~16324)和 HVR-Ⅱ区(63~322)。见表 2、图 2。
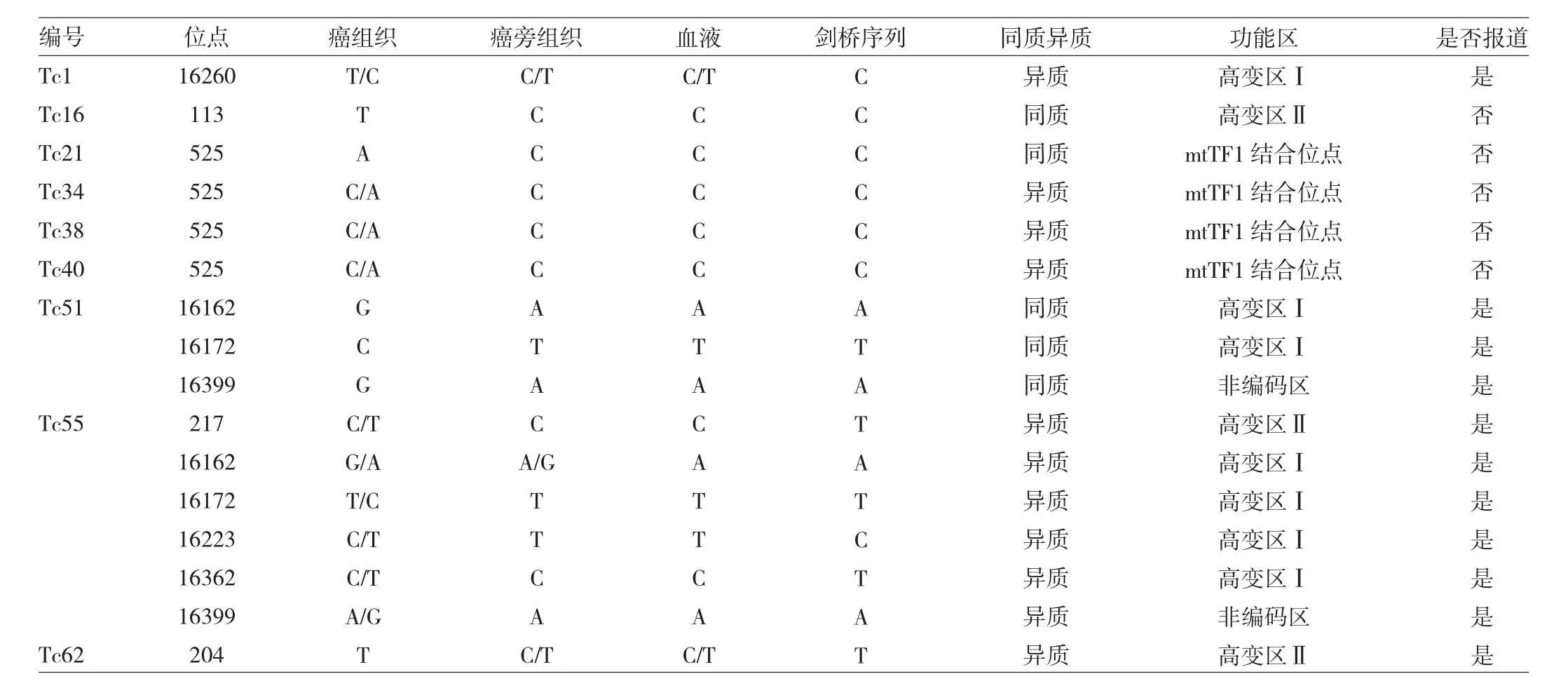
表2 9例甲状腺乳头状癌患者mtDNA D环区点突变情况
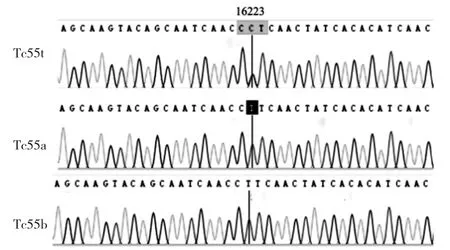
图2 测序结果碱基替换图(Tc55t、Tc55a、Tc55b分别为甲状腺乳头状癌55号癌组织、正常组织、血液的测序结果)
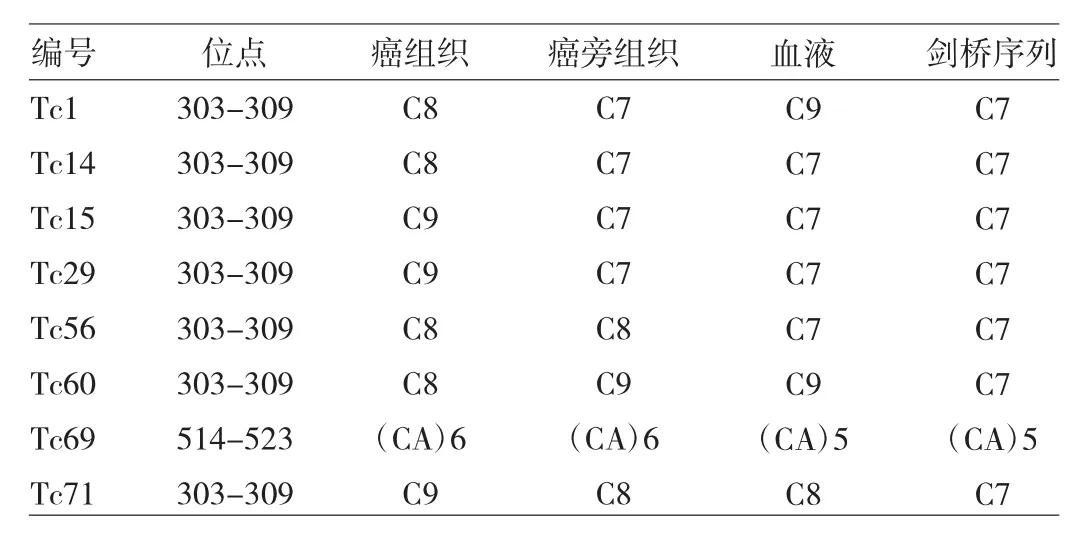
表3 甲状腺乳头状癌患者mtDNA D环区mtMSI分析
2.4 甲状腺乳头状癌患者mtDNA D环区mtMSI分析本研究中17例突变患者有8例发生。几乎所有的mtMSI均发生在303-309区域插入1-2个C碱基,但有1例甲状腺乳头状癌患者(Tc69)发生在mtTF1结合位点,插入1个(CA)重复序列,见表3。
3 讨论
mtDNA序列在人类基因组中是高度可变的[4],它在功能上重要的突变对于确定癌症的发病机制和肿瘤进展至关重要。线粒体DNA诱发突变的比率比核基因高10~20倍,可能因为其缺乏精确的DNA保护和修复系统,以及在氧化磷酸化过程对与活性氧(reactive oxygen species,ROS)的累积,所以极易受到致癌物的攻击[5]。其中D环区是mtDNA的非编码区,由于富含A、T碱基,而且是mtDNA与线粒体膜的结合位点,易受脂质过氧化物的影响,故D环区为mtDNA突变的高发区,碱基替换率比mtDNA的其他区域高6~8倍[6],尤其是HVR-Ⅰ和HVR-Ⅱ两个高变区。因此,研究mtDNA D环区在肿瘤组织中的突变情况对研究肿瘤发生的机制具有重要意义。虽然,目前不能完全确定mtDNA D环区的突变与肿瘤的发生直接相关,但可以证实D环区具有高度的多态性。已有报道证实,在正常人群中非相关个体的mtDNA测序约有50个(0.3%)核苷酸互不相同,绝大部分分布于D环及非编码区[7]。本研究中71例甲状腺乳头状癌患者共发现167个种系性变异,人均变异数为2.35个。由于剑桥mtDNA序列数据库中的信息来源于西方人群,因此mtDNA D环区的多态性及突变性有地域、国家和人种间的差异。某些已被发现的多态性位点可能与癌症的遗传易感性有关,但本文中未见报道的21个新多态性位点,由于出现频率比较低,尚不能进行统计学意义上的关联分析,尚待进一步扩大样本量深入研究,以便寻找可能的中国人特异的遗传易感性位点。
不同肿瘤中D环区的改变存在差异,Habano等[8]研究45例结肠癌患者癌组织和正常组织mtDNA突变时发现,44.4%(20/45)D环区存在CA不稳定和多聚C(PolyC)不稳定;Fliss等[9]分析了头颈部肿瘤、肺癌和膀胱癌中 D环区突变率分别为23.1%(3/13)、38.5%(5/13)和28.6(4/14)。关于甲状腺肿瘤mtDNA D环区突变率的报道也各不相同;Tong等[10]通过对72例不同类型的甲状腺癌HVR-Ⅱ区序列进行检测,发现在乳头状癌、滤泡癌、未分化癌和髓样癌的突变率分别为2/35、1/9、1/9 和 1/18,总突变率仅为 5/72(6.9%);Ding 等[11]检测了101例甲状腺肿瘤患者,包括结节性甲状腺肿、腺瘤和甲状腺癌,发现mtDNA D环区突变在瘤前病变中即存在,并随肿瘤的发生而增加;Maximo等[12]通过对mtDNA D环区部分重复序列研究发现甲状腺良、恶性肿瘤突变率分别高达50%(15/30)和47.6%(17/36),他们认为这些突变反映了甲状腺肿瘤mtDNA的不稳定性。
本研究中,71例甲状腺乳头状癌突变率为23.9%(17/71),突变位点涉及 HVR-Ⅰ、HVR-Ⅱ以及 mtTF1结合位点。与很多学者的观点相同对于mtDNA来说,D环区的HVR-Ⅰ、HVR-Ⅱ这两个高变区是突变热点[13-14]。值得注意的是17例突变患者有5例位于mtTF1结合位点,占29.4%,其中1例是mtMSI。已知mtTFl是一个能与线粒体DNA重链及轻链启动子相结合的因子,对线粒体增殖和功能起着重要的调控作用,是决定线粒体数量和转录活性的关键分子,从而对细胞增殖产生影响[15]。
因此,可以推测mtTFl结合位点的突变可能与甲状腺肿瘤的发生发展有关。mtMSI现象是指线粒体中简单重复序列的增加或丢失,有研究报道mtDNA D环区最常见的突变集中在nt303-309的PloyC结构中1-3个碱基C的插入或缺失[16]。本研究中,47.1%(8/17)的突变存在nt303-309区域1-2个碱基C插入的改变,高于Tong等[10]只有6.9%的标本出现在此区域,这可能是不同人种和地区的原因。nt303-309区域位于保守序列Ⅱ区,是mtDNA重链的复制起始点。由于D环区的单链启动复制机制,突变可能会使DNA基因部位出现发卡样结构,增加了mtDNA多聚酶γ在C区的错配机会;同时,此区是线粒体转录因子A(mitochondrial transcription factor A,mtTFA)的结合位点,是高水平特异性转录起始所必须的,故而nt303-309区的突变可能会导致线粒体转录异常的发生[17]。
MtDNA为母系遗传,可分为同质性和异质性。正常情况下,大多数健康个体不同的细胞或组织中的mtDNA为同一类型,即同质性;但在许多疾病个体的细胞中,突变型mtDNA和野生型mtDNA共存,即异质性。异质细胞分裂时突变的mtDNA随机分布到子细胞中,经过多代的传递mtDNA表型向突变型mtDNA占优势的方向漂变,当突变积累过多时,能量输出降低到正常细胞、组织和器官功能最低需要量以下时出现疾病症状,并越来越严重就会影响生化和临床表型,从轻度功能缺陷到重度线粒体完全解体[18]。在本研究中66.7%的突变为异质性突变,与Su等[19]研究结果相似。这些体细胞变异可能会给肿瘤细胞带来再生优势,为肿瘤细胞的发展可能提供必要的遗传多样性,以满足进化适应性和驱动肿瘤进展[20]。
综上所述,甲状腺肿瘤组织mtDNA D环区具有高度多态性和较高突变率,该区的基因突变可能与甲状腺肿瘤的发生相关。线粒体功能紊乱是肿瘤发生的表现之一,可以通过抗氧化剂选择性基因治疗或改变mtDNA变异载量等方法用于临床治疗,这些将可能成为肿瘤诊断和治疗的新方法。
