重症肌无力合并肌萎缩侧索硬化1例报告
2019-04-11曾文双肖海兵蔡继福褚晓凡
涂 柳, 曾文双, 肖海兵, 蔡继福, 褚晓凡
肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)是一种累及运动神经元的快速进展的神经退行性疾病,目前还没有明确的实验室检查或影像学检查来证实诊断,诊断仍基于临床表现结合电生理改变明确。重症肌无力(Myasthenia gravis,MG)是一种肌肉无力和易疲劳为特征的神经肌肉接头疾病,是细胞免疫依赖、抗体介导、补体参与的,以突触后膜的乙酰胆碱受体(AchR)及相关蛋白为靶点的自身免疫性疾病。MG和ALS的发病率分别为(8~20)/10万[1]、(7~11)/10万[2],同时发生的情况极为罕见。笔者所在神经免疫团队于2017年11月收治了1例临床确诊的MG合并ALS患者,现报告如下。
1 临床资料
患者,女,66岁,因“进行性四肢乏力1 y余”于2017年11月6日入院,1年余前开始出现四肢乏力情况,首先累及双下肢,主要为起蹲费力,无麻木及二便障碍,存在易疲劳性,后逐渐累及双上肢,主要为上抬费力,伴有双侧手内肌萎缩及波动性左侧眼睑下垂,我院骨科就诊完善头颈胸腰MRI未见明显异常,遂转诊我科。入院查体神经系统阳性体征:舌肌萎缩伴纤颤,双上肢肌力4-级,双下近端肌力3级,远端肌力4级,肌张力均正常,双上肢大鱼际肌、骨间肌萎缩,四肢腱反射,双侧感觉正常对称,双侧巴氏征阳性,左眼Jolly试验阳性。实验室检查:肌酸激酶:303 U/L;肌酸激酶同工酶:17.0 U/L,腰椎穿刺压力及相关生化检查、女性肿瘤标志物、ANA、ANCA、维生素B12、血清蛋白电泳、术前四项、甲功及相关抗体等检查均未见明显异常。新斯的明试验阳性。低频重复电刺激试验阳性,肌电图提示:右侧颏舌肌、三角肌、胫前肌、胸椎旁肌及左侧胸锁乳突肌、股外侧肌、小指展肌均在静息状态下可见较多正锐波、纤颤波和束颤波,MUP时限增宽、波幅增高,大力收缩募集电位为单纯混合相,符合典型的ALS电生理改变。抗AchR抗体阴性,抗Musk抗体及抗LRP4抗体未能完善。胸腺CT未见占位及增生。头部及脊髓MRI未见中枢神经系统病变(见图1~图4)。入院后加用溴吡斯的明症状改善明显,后加用中等剂量泼尼松(30 mg)同时加用激素助减剂他克莫司(3 mg/d),患者因经济原因暂未接受利鲁唑治疗,出院时患者眼睑无下垂,四级肌力恢复到4+级,出院后规律服用免疫调节药物,出院半年及1 y随访自觉上肢远端力弱缓慢加重,下肢远端肌肉进行性萎缩,目前正在进一步随访中。
2 讨 论
我们汇报的这位MG合并ALS的患者,其临床表现包括左侧眼睑波动性下垂,四肢肌肉病态易疲劳,疲劳试验、新斯的明试验阳性,低频重复电刺激试验呈典型的递减波形,递减幅度大于10%,临床诊断MG明确;同时,患者合并存在舌肌束颤及萎缩,上肢存在下运动神经元损害(如肌肉萎缩无力),下肢存在上运动神经元损害征象(巴宾斯基征阳性),这些症状都是无法用MG一元论解释的,完善电生理提示存在延髓、颈、胸与腰骶不同神经节段所支配肌肉失神经及神经再支配现象,根据修订的EI Escorial的临床诊断标准可临床确诊为ALS。因此本例患者几乎可以肯定其同时患有MG 与ALS。但患者目前抗AchR抗体阴性,抗Musk抗体及抗LRP4抗体未能完善,存在一定的遗憾,可动员其择期复查完善。
MG和ALS分属于自身免疫性疾病及神经变性疾病,其发病机制迥异,但是目前仍有一些文献探讨了两者之间可能存在的联系[3~5]。有文献报告一些包括MG在内的自身免疫疾病可增加患ALS的风险[6],同时有些文献指出在ALS患者中监测出抗LRP4抗体,其为MG的相关致病抗体,推测两者之间存在一定的免疫共性[7]。一项英国动物实验研究显示:MUSK复合物的大量表达可稳定神经肌肉接头突触功能,在一定程度内减少肌肉的失神经支配,改善遗传性ALS模型小鼠的运动功能,进而推测ALS患者如存在抗Musk抗体,其可通过影响神经肌肉接头突触的稳定性导致ALS的临床进展,这项研究在一定程度上有助于我们理解ALS及MG两者之间的相关性[8,9]。
通过这例病例,提示临床工作医生:对于ALS患者,可考虑完善包括MG在内的自身免疫性疾病相关抗体,及时地发现其可能存在的免疫共病,同时也有助于进一步证实两者之间可能存在的免疫共性。同时当MG患者合并上下运动神经元损害征象时,建议完善肌电图检查排除有无合并ALS可能性。
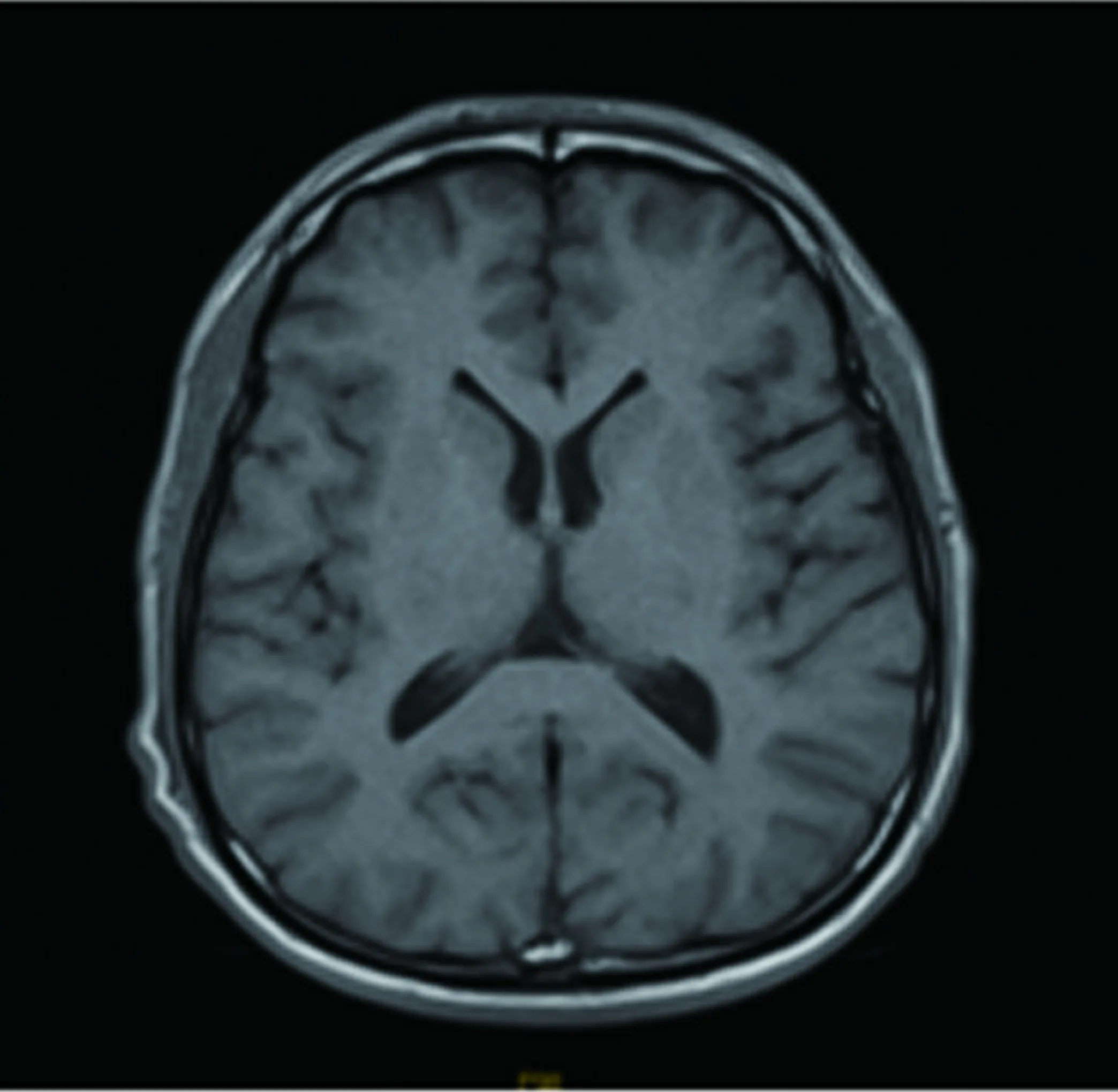
图1 头部MRI T1WI
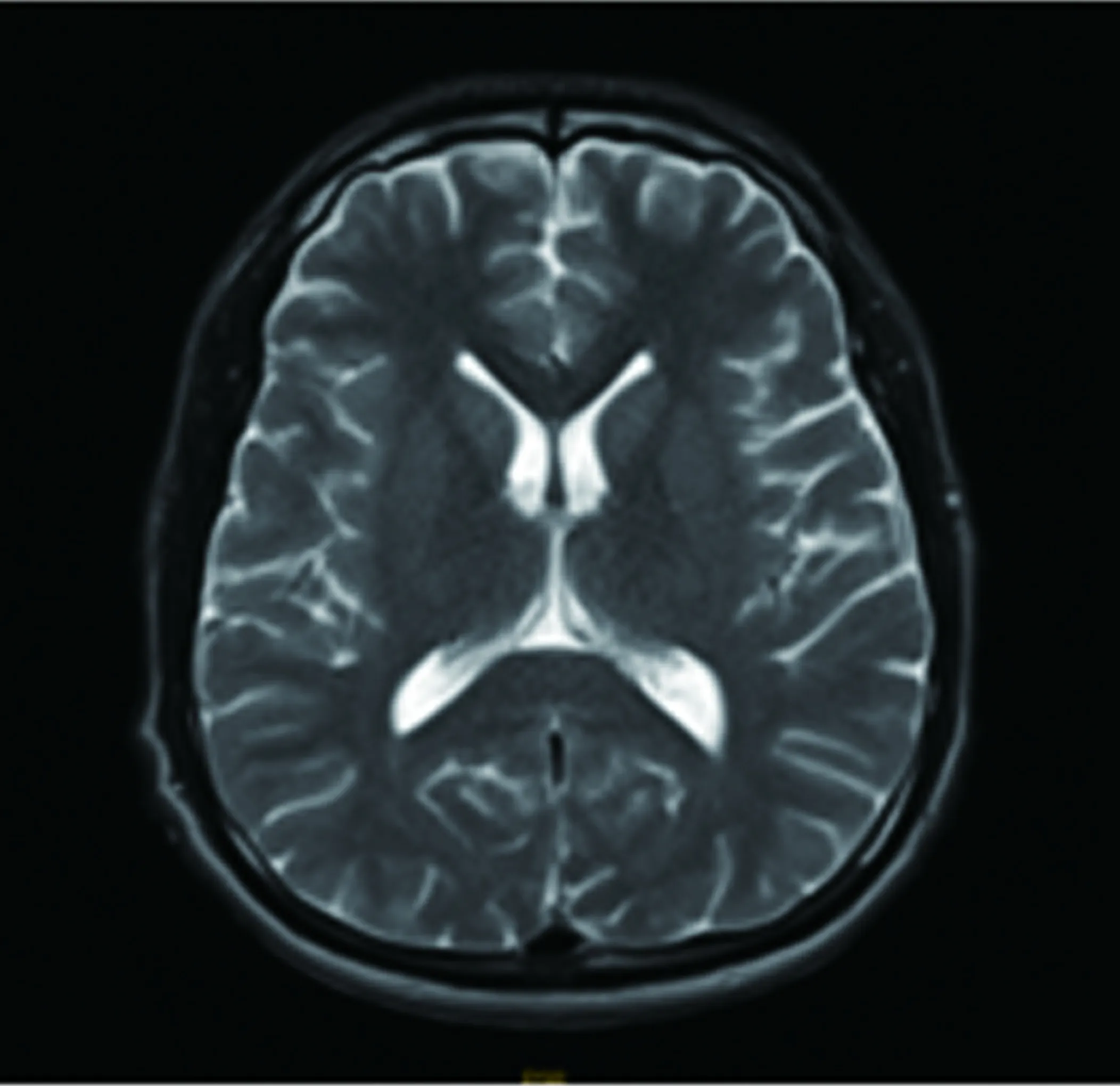
图2 头部MRI T2WI

图3 全脊髓T1WI
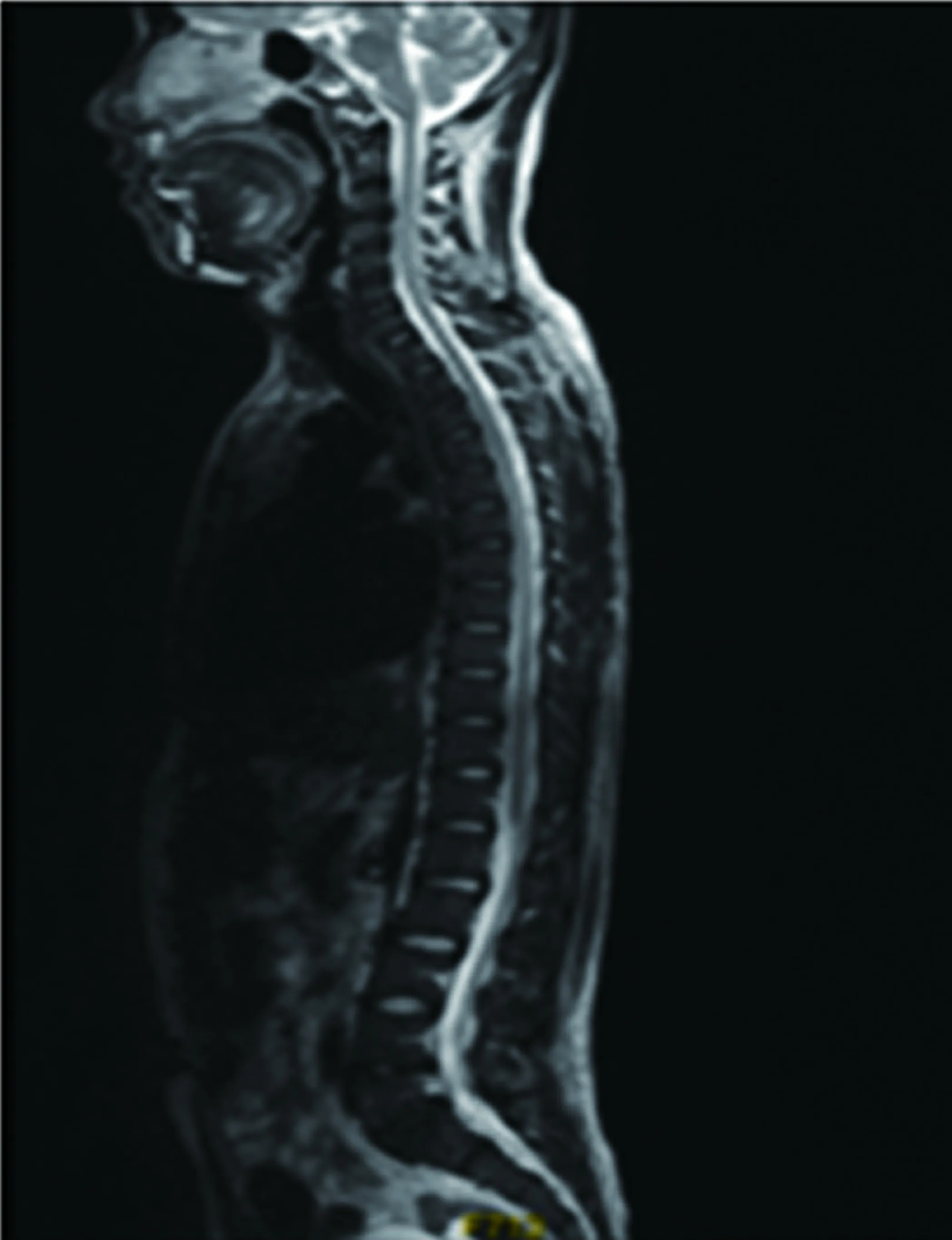
图4 全脊髓MRI T2WI
