自身免疫性脑炎研究新进展
2019-04-11孙梦娇马莉花杜转环马玉梅综述王满侠审校
孙梦娇, 马莉花, 杜转环, 马玉梅综述, 王满侠审校
自身免疫性脑炎(Autoimmune Encephalitis,AE)泛指一类由自身免疫机制介导的脑炎。通常以急性或亚急性记忆障碍、精神行为异常和癫痫为主要临床表现。且由于不同类型自身免疫脑炎的病因、发病部位与是否伴随肿瘤等方面差异,其临床表现也不尽相同,需临床医生仔细鉴别。AE包括抗细胞内抗原相关抗体脑炎、抗细胞表面抗原或突触蛋白相关抗体脑炎以及其他系统自身免疫性疾病相关脑炎。近年来,随着抗体检测技术、医学影像学的发展,新类型AE逐渐被人们发现,该病的诊治也较前有明显改善。目前,AE患病比约占脑炎病例的10%~20%,故本文就AE分类以及临床诊治方面的研究进展进行简单总结,以提高国人对AE的认识以及该病在我国临床诊断率及疗效。
1 自身免疫性脑炎概述
广义的AE包括抗细胞内抗原相关抗体脑炎(也称经典的副肿瘤性脑炎(PNDS))、抗细胞表面抗原或突触蛋白相关抗体脑炎以及其他系统自身免疫性疾病相关脑炎[1,2]。最早由Corsellis于1968年首次提出“边缘叶脑炎”的概念,2001年Buckly报道了体内未检测到肿瘤的边缘叶性脑炎,将人们对AE的认识提升到一个新高度[3]。2005年Dalamau等自4例卵巢畸胎瘤患者海马神经元培养物中发现神经元细胞抗原受体,2007年Dalamau将其首次命名为抗NMDAR受体脑炎[4~6]。近十年来,抗NMRAR脑炎已成为国际、国内研究的热点[7]。总之,AE是一组抗原抗体相关疾病,其临床诊断主要依据临床表现、自身抗体检测和影像学检查等方面,目前治疗手段主要为免疫治疗和肿瘤切除以及对症支持治疗[8,9]。
2 自身免疫性脑炎的分类
因AE发病机制尚未清楚,其分类目前在临床上的划分不尽相同。有学者根据不同神经元抗原和相应的临床综合征将AE分为抗NMDAR脑炎、边缘性脑炎和其他AE综合征,也有研究者根据影像学表现分成边缘叶型、边缘叶以外型,混合型和无变化型[2,10]。而本次综述则参考相关文献将其分为抗细胞内抗原相关抗体脑炎、抗细胞表面抗原或突触蛋白相关抗体脑炎以及其他系统自身免疫性疾病相关脑炎[1,5,10]。其中PNDS常见的抗体有抗Hu、Ri、Yo、Ma2、CV2,其发病机制主要由T细胞介导,而非抗原抗体直接作用[8]。对免疫治疗反应不佳,且常伴随肿瘤发生,预后较差。而抗神经元表面抗体和突触受体相关脑炎被认为其抗原抗体反应有直接致病作用,虽然其临床症状常较为严重,但对免疫治疗反应较好,无论是否伴随肿瘤发生,其预后大部分较好。目前也有学者将桥本脑病、急性播散性脑脊髓炎(ADEM)和Bickerstaff,s脑干脑炎等其他免疫系统疾病相关脑炎归入广义AE来研究[11,12](见表1)。
2.1 抗细胞内抗原相关抗体脑炎(经典副肿瘤性脑炎)也称边缘叶性脑炎(LE) 该型脑炎最初报道于1960年,涉及到亚急性出现的记忆缺失、幻想和肌张力障碍,癫痫发作和睡眠障碍也会经常出现[16]。在影像学上不同类型表现不同,抗Hu、Ri脑炎的MRI表现为小脑和脑干区域异常高信号改变;抗Ma2脑炎患者仅25%MRI表现异常;对于CV2抗体相关脑炎来说双侧纹状体高信号为其MRI的特征性表现[11,17]。且大部分LE通常伴随肿瘤发生,如乳腺、卵巢、肺部肿瘤等,预后较差[16]。有研究认为LE的致病机制为肿瘤抗原与神经系统细胞表达的抗原相似,故中枢系统炎性反应可能是攻击肿瘤抗原的抗体与神经系统表达的抗原相互作用的结果,细胞和体液免疫可能共同参与致病过程[3,8]。下面就各亚型脑炎作一简单介绍。
2.1.1 抗Hu(ANNA-1)抗体脑炎患者最常见的神经元病变以感觉系统为主 部分患者也伴随小脑变性,脑炎或脑脊髓炎[18]。抗Hu抗体不会直接引起免疫反应而致病,在主动免疫或被动转移的动物模型中不会致病,相关组织病理学研究显示CD8+T细胞大量浸润。且该型脑炎常伴随小细胞肺癌(约86%),预后往往很差。
2.1.2 抗Ri(ANNA-2)抗体脑炎表现多样 包括小脑变性、共济失调和脑炎等,且大多数患者患有肺癌或乳腺癌[19]。
2.1.3 抗-Yo(PCA-1)[20]抗体脑炎患者通常有副肿瘤性小脑变性 超过90%患乳腺癌或卵巢癌。大约有一半的患者死于肿瘤,肿瘤往往只能在确诊副肿瘤疾病后才能检测到。[21]目前其发病机制存在争议,有证据表明抗体可能直接引起神经元免疫反应,但部分研究人员认为T细胞的机制更可能,有待进一步探究。
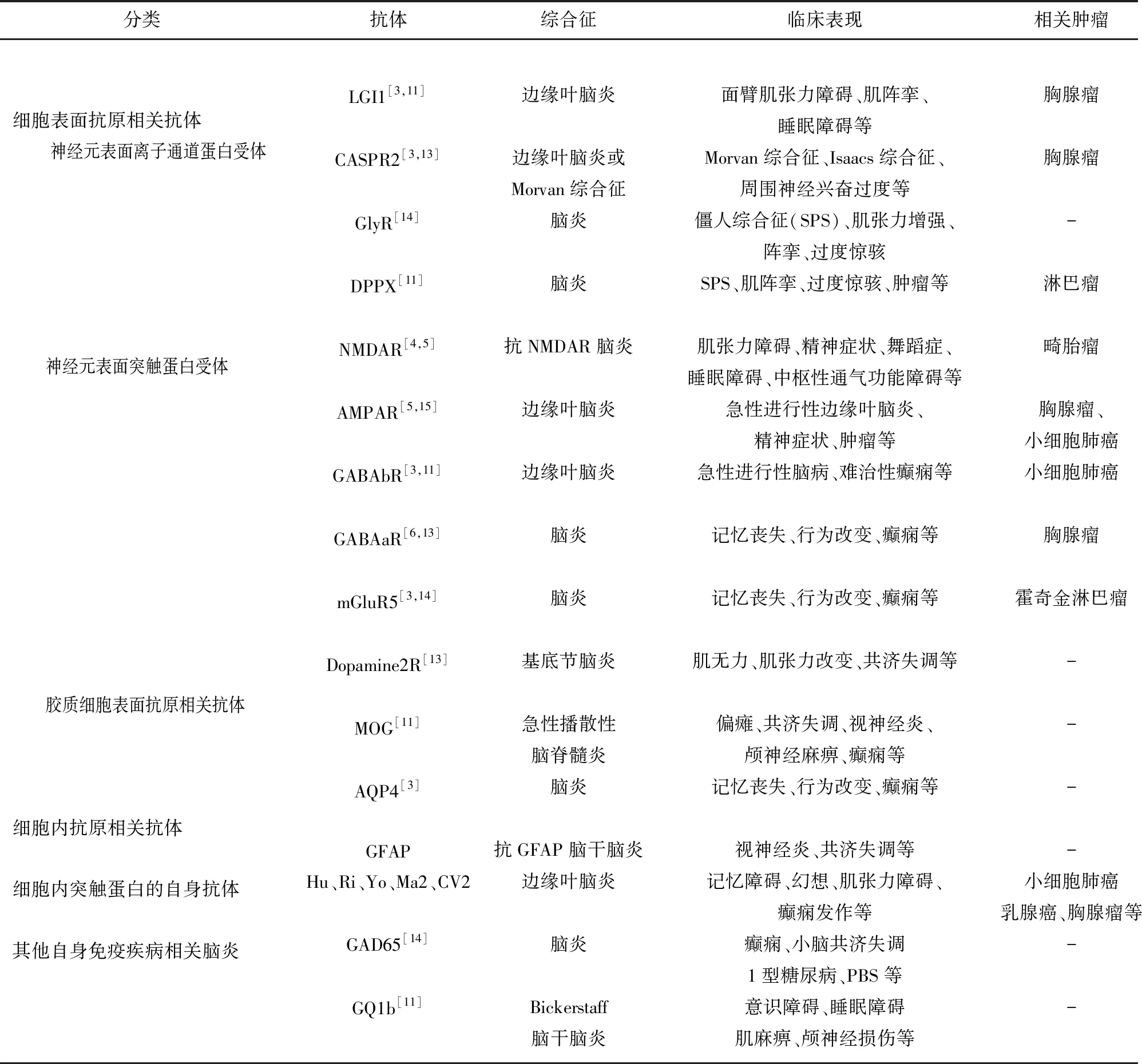
表1 自身免疫性脑炎的分类
2.1.4 抗CRMP-5抗体脑炎临床表现 包括认知障碍,小脑综合征,异常运动(舞蹈病)和颅神经病等,视神经炎也有报道。[22~24]。
2.1.5 抗Ma2(PMNA-2)抗体脑炎也较为罕见 以伴随生殖细胞肿瘤的青年男性最常见。神经症状包括边缘性脑炎、脑干综合征、小脑变性等[25]。
2.1.6 其他抗细胞内抗体相关脑炎 此外也有PCA-2和ANNA-3抗体脑炎的相关报道,目前国内外病例较少,这些检测到的抗体在疾病的发生、发展中如何起作用,有待进一步研究。[26,27]也有体内无肿瘤发生的LE和抗体阴性的LE被报道,其致病机制尚不明了,临床诊断和治疗更复杂[17]。
2.2 抗细胞内突触蛋白自身抗体脑炎
2.2.1 抗GAD65(谷氨酸脱羧酶)抗体脑炎临床表现多样 包括经典SPS、癫痫、小脑炎、1型糖尿病等[28]。小脑炎是步态,肢体运动,眼球运动,语音和吞咽共济失调的独特综合征,为抗GAD65抗体脑炎的常见症状,且大部分患者CSF中抗体滴度较强,自身免疫性小脑炎可能导致浦肯野神经元的不可逆损失,预后恢复可能比其他类型的自身免疫性脑炎更差[29]。在研究中也发现伴随肿瘤时,GAD65抗体常常与GABA-A或GABA-B的自身抗体共存[30]。
2.2.2 抗Amphiphysin抗体脑炎极为少见 这种脑炎常表现为SPS,合并乳腺癌,并对相应肿瘤切除和免疫治疗反应较好[31]。
2.3 抗细胞表面抗原或突触蛋白相关抗体脑炎 这一类型的脑炎发现较晚,是近年来AE研究的热点[7]。针对其细胞表面抗原大致分为两大类,分别为神经元表面介导抗体和胶质细胞表面抗体,前者包括兴奋性递质受体(如NMDAR和AMPAR)、抑制性递质受体(如GABABR、GABAAR和mGluR5等)和离子通道的亚单位和相关黏附分子(如LGI1、Caspr2、GlyR和DPPX),后者主要有星形胶质细胞表面水通道蛋白4(AQP4)抗体、少突胶质细胞表面髓鞘少突胶质细胞糖蛋白(MOG)抗体和GMAF抗体[13]。其临床表现统称为神经元表面抗体综合征(NSAS),即:前驱病毒感染症状,随后出现精神行为改变、意识障碍、运动障碍、自主神经功能紊乱和中枢性通气不足等[6,11,32]。下面就抗神经元细胞抗体抗体各类型脑炎分别展开叙述。
2.3.1 抗NMDAR脑炎 是目前最常见、最受重视的AE类型,约占AE患者的80%左右,美国有研究报道此型AE自被发现以来,其发病率可能超过病毒性脑炎,在30岁以下的脑炎患者中,抗NMDAR脑炎患者数量为单纯疱疹病毒、西尼罗病毒及水疱-带状疱疹病毒所致的脑炎患者的4倍[11]。该病系由机体对NMDAR产生特异性IgG抗体而导致的一种自身性免疫炎性脑炎[4]。最早报道于合并卵巢畸胎瘤的女性患者中,该脑炎病情危重,有潜在致死风险,且需接受长期重症监护治疗,不过大部分患者对肿瘤切除和免疫治疗效果较好[3,15]。近年来,对该病的认识和研究逐渐深入,有学者认为感染因素在该脑炎发病中的作用举足轻重[7]。其在成人和儿童均可发病,且病变侵及范围广,边缘叶、脑干、小脑等均可受累,可伴随肿瘤(通常为卵巢肿瘤)或无肿瘤发生。在儿童患者中,肿瘤发生率较小,其典型的表现为最初出现的精神症状、癫痫(AEDS药常难以控制)及相继出现延迟的严重的脑炎症状[3,15]。辅助检查几乎均可见脑电图异常,多为局灶性和弥漫性慢波,可有痫样放电,脑脊液检查可有细胞数增高或蛋白含量轻度增高或正常。抗NMDAR抗体阳性为本病诊断的特异性指标,MRI检查单侧或双侧颞叶异常信号,也可正常。对免疫治疗有效,大部分预后良好[15,33]。
据研究表明有80%的抗NMRAR脑炎患者平均年龄为21岁的女性[3]。Lizuk将NMDAR受体脑炎病程分为五期,包括前驱期、精神症状期、无反应期、运动功能亢进期、逐渐恢复期[6,10]。其前驱症状包括高热、呕吐、腹泻、头痛、乏力等非特异性表现,类似病毒感染,诊断较为困难。之后会出现精神症状,如焦虑、情绪及行为改变,出现幻觉、妄想、思维混乱等,此外此期也有失眠、记忆力缺失、癫痫发作等。部分患者在精神症状后期有无反应期,与外界交流较少,感情淡漠,语言功能障碍、反应能力下降,相继有运动障碍出现,如面臂肌张力障碍、手足徐动、肌张力障碍、肌强直等,也可伴有自主神经功能紊乱,体温不高、血压不稳定、心动过速,严重时出现中枢通气功能障碍。通常需要重症监护管理,部分患者需要长时间住院治疗,生理和行为康复较为缓慢,通常以月为单位比较,一般需18 m左右,大部分患者在治疗后可完全或接近完全恢复,但有部分患者终生留有后遗症,影响生活质量[33,34]。此外,老年患者多以癫痫为首发症状,脊液检查多无异常表现,血清、GSF自身抗体检测有助于诊断,确诊后应尽早治疗。
2.3.2 抗AMPA脑炎 首次报道于2009年,其发病率较低[3,16]。患者的典型症状为急性进行性边缘叶性脑炎,精神症状,多发于中年女性。大部分病例伴随肿瘤发生(如肺癌、乳腺癌和胸腺癌等),免疫治疗有效,可完全缓解症状,但有复发倾向,即使切除相关肿瘤,有时也会反复发作。需定期复查,长期检测患者相关抗体[16]。
2.3.3 抗VGKC脑炎 是仅次于抗NMDAR脑炎的AE类型,其临床表现有LE相关症状、面臂肌张力障碍、morvan综合征和癫痫等[3,35]。目前,主要检测到的两个重要抗原分别为LGI1和CASPR2[17,35]。大多数抗体并不直接针对VGKC,而是LGI1和CASPR2。这也导致了两种截然不同的临床症状。两者在不同方面的比较见表2[11,17]。

表2 抗VGKC脑炎两类抗原表现对比
总之,抗LGI1脑炎常与感染相关,且更为频繁地表现为边缘叶性脑炎(IE)、癫痫发作,通常不伴随肿瘤发生,而抗CASPR2抗体脑炎则表现为Morvan综合征、周围神经过度兴奋症状,且常和胸腺肿瘤相关[15]。当我们选择性地研究Morvan综合征患者时,患者体内常检测到高浓度的CASPR2抗体,偶尔有低浓度的LGI1抗体,并有40%患者伴随肿瘤(通常为胸腺瘤)[15,20]。
2.3.4 抗GABA脑炎目前有GABAa和GABAb 抗GABAb脑炎是临床上发病率仅次于抗NMDAR脑炎的一型AE。其主要临床表现为行为改变,锥体外系症状、癫痫发作,还包括共济失调和面臂肌张力障碍等[3,15,17]。就相关肿瘤而言,在对一组中位年龄为67岁的抗GABAb抗体脑炎患者(20人)的调查研究中显示,50%患者被发现有小细胞肺癌(sclc),但不伴小细胞肺癌患者更年轻(平均39岁),且此种类型脑炎男女发病机率均等[3]。大部分患者免疫治疗效果较好,长期预后取决于其伴随的恶性肿瘤类型。
抗GABAa脑炎首次报道于2014年,其主要的临床表现为急性进行性脑病和难治性癫痫发作(包括癫痫持续状态),其病情进展快,常较凶险,患者需要药物镇静、监护治疗[3,13]。尽管有两个患者死于癫痫持续状态和脓毒血症,但免疫治疗可使部分患者部分或完全康复。值得注意的是该型脑炎有抗体叠加,即其它自身免疫系统相关抗体也可被检测到,如抗甲状腺过氧化物酶抗体和抗GAD65抗体,这两个抗体都是细胞内抗原相关抗体。6例患者中3例符合桥本脑病的诊断标准。所以,我们在诊断桥本脑炎或抗GAD65脑炎时,也应该重视对GABAa抗体的检测[17,19]。
2.3.5 抗mGluR5(代谢型谷氨酸受体5) 脑炎典型表现为患者认知功能下降、时间定向障碍,且常常伴随[36]霍奇金淋巴瘤。据学者Carr[37]报道,患者通常不会出现精神异常,兴奋,癫痫发作和自主神经症状等,且大部分患者通过治疗淋巴瘤可以大大改善其预后。尽管mGluR1和mGluR5是紧密的同系物,但抗体不会交叉反应,临床综合征也不同。
2.3.6 抗DNER(δ缺口样表皮生长因子相关受体) 脑炎 DNER为Purkinje神经元上表达的跨膜蛋白,抗DNER脑炎常表现为小脑病变和霍奇金淋巴瘤.[38,39]。在该抗原被精确发现之前,这些抗体被称为“抗-Tr”,并将其归类于传统的副肿瘤性疾病[40]。现临床中疑似该疾病患者应仔细筛选是否患有霍奇金淋巴瘤,不过即使成功治疗肿瘤,小脑损伤常常也是永久性的。
2.3.7 抗GlyR(甘氨酸受体) 脑炎临床表现肌张力增强、痉挛和过度惊骇。在SPS患者应考虑检测该抗体,尤其是那些显示类皮肤样表型的患者[4]。虽然大多数抗GlyR脑炎患者没有伴随肿瘤,但仍存在患癌风险。
2.3.8 抗DPPX(二肽基肽酶样蛋白-6)脑炎 该型脑炎与胃肠和神经系统过度兴奋综合征相关[41]。除了记忆丧失,癫痫发作和意识障碍外,还有惊恐,肌阵挛,僵硬和反射过度等临床症状被报道。部分患者伴随严重的腹泻或便秘,也有一小部分伴随肿瘤,如淋巴瘤,尽早诊断治疗可改善其预后。
2.3.9 其它抗细胞表面抗原或突触蛋白相关抗体脑炎 目前,也有其它抗细胞表面或突触蛋白抗体脑炎被相继发现,如抗mGluR1脑炎、抗GMPA脑炎等[3,11]。由于这些抗体发现时间较短,仍处于监测研究阶段。此外,AE相关抗体类型众多,尚需我们进一步发现和深入研究。且部分患者存在抗体叠加现象,使得临床分类、诊治更为复杂。
2.4 其它系统自身免疫性疾病相关脑炎 目前,有研究者将此类型脑炎也纳入广义AE范围之中。如桥本脑病(Hashimoto’s encephalopathy)、急性播散性脑脊髓炎(ADEM))、Bickerstaff’s脑干脑炎、血管性相关性免疫性脑炎等[11,16]。这一类疾病也是近年来AE研究的热点。
3 自身免疫性脑炎的诊断
2016年3月GRAUS 等学者在“Lancet Newrclogy”发表了一篇由国际专家联合提出的关于AE的临床诊断标准及排除标准的指南,该指南不仅包括自身免疫性边缘系统脑炎的诊断标准、抗NMDAR脑炎的诊断标准,还纳入了可能的AE、ADEM、Bickcrstaff脑干脑炎和桥本脑病的诊断标准以及自身抗体阴性但拟诊为AE的诊断标准[11,13]。2017年3月由我国神经病学专家组提出的《中国自身免疫性脑炎诊治专家共识》中将AE的诊断就诊断条件和诊断标准两方面进行讲述[42],对我国目前在临床实践有着重要的指导意义,且早期诊断治疗与临床预后也密切相关[11,15]。
当然在临床工作中对AE的诊断通常需要如下过程:
4 自身免疫性脑炎的治疗
目前尚无明确的自身免疫性脑炎治疗规范,在临床工作中,大多为经验性治疗[43],主要以免疫调节治疗、对症支持治疗、伴随肿瘤切除几个方面为主。
4.1 肿瘤切除 肿瘤与自身免疫性脑炎有密切的关联,正如分类中提及,不同类型自身免疫性脑炎伴随肿瘤的发生率和类型不尽相同。例如,抗细胞内抗原相关抗体脑炎多伴有乳腺癌、卵巢癌及生殖细胞肿瘤,抗NMDAR脑炎常伴随畸胎瘤[4,5],抗GABAbR[3,6,11]脑炎超过一半患者诊断肺恶性肿瘤,包括肺小细胞癌和神经内分泌肿瘤,抗AMPAR脑炎部分可合并胸腺瘤和肺部肿瘤[5,15],抗LGI1、CASPR2脑炎常伴随胸腺瘤[3,11,13]等。因此对肿瘤相关的AE应尽早排查,尽早手术治疗,有学者对100例AE患者的病例回顾性分析中发现大部分患者切除肿瘤后病程缩短,复发率降低,总体预后明显改善[44]。
4.2 免疫调节治疗 一线免疫治疗包括糖皮质激素,免疫球蛋白(IVIG)和血浆置换和免疫吸附等,糖皮质激素和IVIG是目前临床最常用的治疗方法,其治疗关键是尽早尽可能在短期内减轻神经系统损害,尽早恢复神经功能[45]。血浆置换和免疫吸附的目的在于清除循环血中的自身抗体以改善临床症状,但一线治疗在降低鞘内抗体滴度上不是很理想,且目前缺乏安全性前瞻性研究,有待进一步评估[46~48]。对于一线免疫治疗后临床症状改善不明显患者者,则需予以二线免疫调节治疗,如环磷酰胺、利托昔单抗、霉酚酸等免疫抑制剂或者与一线治疗联合应用[3,7]。总之,大部分患者在接受一线免疫治疗后病情很快好转,无明显改善者在使用二线药物后效果显著[45]。
4.3 对症支持治疗 一部分自身免疫性脑炎患者临床症状较重,如严重的精神症状、癫痫发作、通气不足、意识障碍等,且不同类型AE患者临床表现不尽相同[45](分类中已提及,至此不再赘述)。因此须尽早予以对症治疗,对于精神症状严重者,及时加用精神类药品;伴有癫痫发作时,尽早加用抗癫痫药物;通气不足时,予以气管插管、人工辅助通气;对于嗜睡、昏迷患者,可尝试电休克治疗(ECT),有个案报道认为ECT可明显改善患者意识障碍相关症状[49~51]。对于一、二线免疫治疗均未见明显好转患者可行鞘内注射免疫抑制剂,如激素、甲氨蝶呤等,据相关文献报道效果显著[52]。在临床工作中,部分患者起病急、症状重,需重症监护、严密监测生命体征、防止继发呼吸道或泌尿道感染、褥疮等支持治疗。
有文献报道自身免疫性脑炎与病毒感染相关[53,54],故在临床上常规给予抗病毒药物。此外,AE有一定比例复发率,据研究者报道抗NMDAR脑炎的复发率可达20-30%[55],故对AE患者均应尽可能在疾病早期进行相关治疗,症状改善或康复出院后应定期复查,以防复发[12]。
5 结语和展望
AE是机体抗神经元抗原成分的异常反应所致的中枢神经系统炎性疾病,随着神经免疫学研究的发展,人们对AE的认识逐渐深入[2]。但目前AE的具体病理机制还不是很清楚,阐明自身免疫反应的启动机制对AE的预防、诊断以及治疗也至关重要,是神经免疫与感染领域亟待解决的热点问题[7]。
本综述就AE的分类、诊断以及目前临床治疗作一概括总结。近年来,由于新类型AE不断被发现,使得AE的分类也大不同以往,通过对相关文献的阅读分析,将广义的AE概括为三大类,其中又以抗NMDAR脑炎、抗GAGAb脑炎和抗LGI1脑炎较常见,已成为目前AE研究的热点[7]。当然,也有按影像学,病理学等不同角度对AE的分类[2,13]。此外,不同类型AE致病机制不同、临床表现也不同,故在治疗上临床医生需仔细鉴别其类型,总结治疗经验,分别针对各亚型制定相应的治疗方案、确立相关抗体的检测系统,为本病的临床研究及广大患者带来福音。
