固体超强酸SO42-/TiO2-SnO2-ZnO催化微波促进的1,3-二氧戊烷类化合物的合成
2019-04-09牟佳玲
牟佳玲,梁 玲,洪 志
(台州学院医药化工与材料工程学院,浙江 台州 318000)
缩酮是一类重要的有机化合物,在化学工业中可作为有机合成的羰基保护或反应中间体,及特殊的反应溶剂[1-2]。缩酮的合成方法较多[3-5],其中最常用的是酮类化合物与醇类化合物在催化剂作用下进行缩合得到[6]。此类反应的传统催化剂为质子酸,如 H2SO4[7]、HCl[8]、TsOH[9]等,或者是路易斯酸,如 AlCl3[10]、FeCl3[11]、Al2(SO4)3[12]、NH4Fe(SO4)2·12H2O[13]等,这些催化剂具有腐蚀性强、用量大、不易回收、容易造成环境污染等缺点。
近年来,硫酸化金属氧化物SO42-/MxOy(M=Ti、Zr、Fe等)型固体超强酸催化剂发展迅速,在酯化、酰化、烷基化和异构化反应等中表现出优良的催化性能[14],受到越来越多的关注。此类固体超强酸的催化功能来源于固体表面上存在的具有催化活性的酸性部位。其中固体酸SO42-/Fe2O3-MoO3[15]、固体酸 SO42-/TiO2-SnO2[16]、固体酸 SO42-/ZrO2[17]、纳米固体酸SO42-/Fe2O3[18]等被报道对缩酮反应具有良好的催化活性,它们通常是SO42-担载在金属或非金属氧化物载体上,形成类似双齿螯合物的物种,其催化性能不同于含过渡元素的氧化物催化剂。另外,硫酸化复合金属氧化物也越来越受到重视,比如SO42-负载的三种或四种复合金 属 氧 化 物 如 Fe2O3、Al2O3、TiO2、SnO2、ZnO、ZrO2等催化剂[19-20],或者是添加稀土金属或贵金属的固体酸催化剂如SO42-/ZrO2-TiO2/La3+[21]、Pt-SO42-/ZrO2-Al2O3[22]、Pd-SO42-/ZrO2-WO3[23]等,通过调节催化剂表面酸位密度,提高催化活性。
微波辅助合成具有加热均匀、节能高效、无污染等优点,被广泛运用在无机材料制备[24]、萃取[25]、有机合成[26-27]等过程。本文尝试采用自制的固体超强酸SO42-/TiO2-SnO2-ZnO为催化剂,在微波辅助下催化酮类化合物与1,2-二醇类化合物的缩合反应,制备1,3-二氧戊烷类化合物。实验结果表明,该方法具有收率高、后处理简便、催化剂活性好且易回收,且能重复使用等优点。
1 实验部分
1.1 主要仪器与试剂
AdvanceⅢHD 400型核磁共振波谱仪(TMS为内标,瑞士Bruker公司);5700型傅里叶红外光谱仪 (日本岛津公司);Quattro micro API型液质联用仪 (美国Waters公司);S-4800型扫描电子显微镜 (日本日立公司);WBFY-201型微波化学反应器 (巩义市科瑞仪器有限公司);JM-A20002型电子天平 (诸暨市超泽衡器设备有限公司);ZF-6型三用紫外分析仪(金坛市盛蓝仪器制造有限公司);M-565型熔点仪 (温度计未经校正,瑞士Buchi公司)。
实验所用试剂均为市售分析纯或化学纯,购于阿拉丁试剂(上海)公司或国药集团化学试剂有限公司,用前未作处理。
1.2 实验过程
1.2.1 固体超强酸SO42-/TiO2-SnO2-ZnO的制备
参照文献[28]的方法制备。称取18.97 g(0.1 mol)TiCl4加到250 mL去离子水中,配制成一定浓度的溶液,再加入2.73 g(0.02 mol)ZnCl2和 2.52 g (0.0072 mol)SnCl4·5H2O,搅拌,溶解混合后,加入氨水调节pH为8~9,静置陈化24 h。将沉淀用蒸馏水洗涤至无Cl-(用AgNO3水溶液检测),置于真空干燥箱中105℃干燥8 h。将干燥后的固体粉末研磨至均匀细粉,再加入质量3.2 g (0.024 mol) (NH4)2SO4、3.2 mL 去离子水湿法研磨混合后在马弗炉中于500℃温度下焙烧4 h,置于干燥器中,得到13.6 g固体超强酸SO42-/TiO2-SnO2-ZnO催化剂,标记为STSZ。所得催化剂晶体结构用FT-IR、EDS、SEM检测确定。
1.2.2 固体酸SO42-/TiO2-SnO2的制备
参照文献[16,29]的方法制备。称取18.97 g(0.1 mol)TiCl4加到250 mL去离子水中,配制成一定浓度的溶液,再加入 7.45 g (0.033 mol)SnCl2·2H2O,搅拌,溶解混合后,加入氨水调节pH为8~9,静置陈化24 h。将沉淀用蒸馏水洗至无有害离子为止,在120°C条件下干燥12 h,将干燥后的固体粉末研磨至均匀细粉,倒入170 mL浓度为1 mol/L的硫酸溶液中浸渍30 min,抽滤压干,干燥后在550℃~650℃条件下焙烧3 h,得到11.3 g固体超强酸SO42-/TiO2-SnO2催化剂,标记为STS。所得催化剂进行催化活性比较。
1.2.3 固体酸SO42-/TiO2的制备
参照文献[30]的方法制备。称取18.97 g(0.1mol)TiCl4加到250 mL去离子水中,配制成一定浓度的溶液,不断搅拌并加入氨水调节pH为9,继续搅拌0.5 h,室温下陈化24 h。过滤洗涤至无Cl-,110℃干燥24 h后研细,用0.5 mol/L硫酸按15 mL/g的比例浸渍搅拌1 h,过滤,110℃干燥24 h,550℃焙烧3 h,得到12.4 g固体超强酸SO42-/TiO2催化剂,标记为ST。所得催化剂进行催化活性比较。
1.2.4 1,3-二氧戊烷类化合物的基本合成过程
在100 mL单口烧瓶中,加入5 mmol的酮,10 mmol的1,2-二醇类化合物和20 mL的有机溶剂,缓慢加入固体超强酸催化剂。将单口烧瓶放入微波化学反应器中,接上球型冷凝管,通冷却水,设定功率档位为60%(最大功率为650 W,实际功率为390 W),通过TLC跟踪反应进程。反应结束后,冷却至室温。将反应液过滤,回收催化剂。滤液倒入分液漏斗,加入100 mL水,再加入乙酸乙酯萃取(30 mL×2)。合并有机相,用饱和食盐水和清水各清洗1次,无水硫酸钠干燥,旋蒸回收溶剂,残留液柱层析分离(洗脱剂为乙酸乙酯和石油醚),即得目标产物。具体合成路线见图1,所合成的1,3-二氧戊烷类化合物经FT-IR和1H NMR等分析表征。
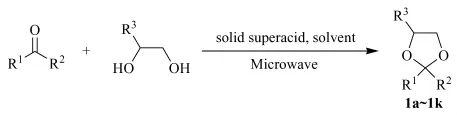
图1 1,3-二氧戊烷类化合物的合成路线
1.2.5 其它产物的合成过程
当以2-氨基二苯甲酮类化合物与乙二醇反应能顺利地得到1,3-二氧戊烷类化合物,但以乙醇为原料反应时,意外地得到了6,12-二苯基二苯并[b,f][1,5]二氮杂环辛四烯类化合物,反应式见图2,所得产物经FT-IR和1H NMR等分析表征。
当以4-羟基苯乙酮与二乙醇胺为原料反应时,得到 4-(2-甲基-4H-1,3,6-二噁唑啉-2-基)-苯酚,反应式见图3,反应条件及后处理都与1,3-二氧戊烷类化合物的合成过程类似,所得产物经FT-IR和1H NMR等分析表征。

图2 6,12-二苯基-二苯并[b,f][1,5]二氮杂环辛四烯类化合物的合成
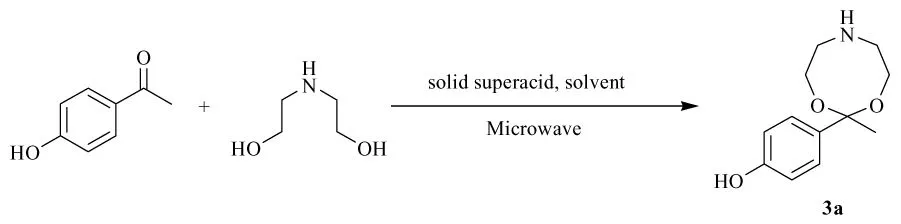
图3 4-(2-甲基-4H-1,3,6-二噁唑啉-2-基)-苯酚的合成
1.3 化合物表征
2,4-二甲基-2-(4-甲基苯基)-1,3-二氧杂环戊烷(1a):收率 74%,无色油状液体;1H NMR(CDCl3, 400 MHz), δ: 1.20~1.33 (dd, 3H, J1=6.4 Hz, J2=6.0 Hz, CH3), 1.64 (d, 3H, J=13.6 Hz,CH3),2.34 (s,3H,CH3), 3.28~3.54 (m,1H, CH), 3.85~4.38 (m, 2H, CH2), 7.14 (d,2H, J=8 Hz, ArH), 7.36~7.41 (dd, 2H, J1=J2=8 Hz, ArH) ppm;13C NMR(CDCl3, 100 MHz), δ:19.00, 21.13, 28.56, 70.85, 71.83, 109.08,125.19, 128.84, 137.38, 140.96 ppm; IR(KBr),v, cm-1: 819.8, 1037.7, 1080.1, 1201.7, 1371.4,1442.8, 1508.3, 2877.8, 2931.8, 2980.0; MS, m/z(%): 193 (M+1, 100), 215 (M+23, 50); ESIHRMS (calcd.),m/z:215.1149 (215.2440)[M+23]+。
2-甲基-2-(2-硝基苯基)-1,3-二氧杂环戊烷 (1b):收率83%,淡棕色固体,m.p.64.0℃~66.8 ℃ (lit.[31]: 65.0 ℃~66.0 ℃);1H NMR(CDCl3,400 MHz), δ: 1.87(s, 3H, CH3), 3.64~3.67 (m,2H, CH2), 4.00~4.04 (m, 2H, CH2), 7.42 (d,2H,J=4.0 Hz,ArH),7.50~7.54 (m,1H,ArH),7.66 (d,1H,J=8.0 Hz,ArH)ppm;13C NMR(CDCl3, 100 MHz), δ: 27.42, 64.70, 107.85,123.00, 128.18, 129.12, 131.17, 136.08, 149.37 ppm; IR (KBr), v, cm-1: 737.6, 873.8, 1109.1,1350.2, 1527.6, 2900.9, 2987.7, 3088.0; MS, m/z (%): 232 (M+23, 100); ESI-HRMS(calcd.),m/z: 246.0755 (246.1645)[M+35]+。
2,4-二甲基-2-(2-硝基苯基)-1,3-二氧杂环戊烷 (1c):收率 80%,白色固体粉末,m.p.78.5 ℃~78.9 ℃;1H NMR (CDCl3,400 MHz),δ:1.07 (d, 1H, J=6.4 Hz, CH3), 1.29 (d, 2H, J=6 Hz, CH3), 1.86 (d, 3H, J=6 Hz, CH3), 3.49 (s,1H, CH), 3.76~4.32 (m, 2H, CH2), 7.40~7.45(m,2H,ArH),7.48~7.53 (m,1H,ArH),7.64~7.69 (m,1H,ArH)ppm;13C NMR (CDCl3,100 MHz), δ: 18.74, 28.06, 70.96, 72.48, 107.84,122.87,123.04,127.92, 128.18,129.01, 131.08 ppm; IR (KBr), v, cm-1: 869.9, 1074.4, 1371.4,1444.7, 1531.5, 2889.4, 3095.8; MS, m/z (%):246 (M+23, 90)。
2-甲基-2-(3-硝基苯基)-1,3-二氧杂环戊烷 (1d):收率82%,白色固体粉末,m.p.70.8℃~71.8 ℃(lit.[32]: 71.0 ℃~72.0 °C);1H NMR(CDCl3, 400 MHz), δ: 1.68(s, 3H, CH3), 3.78~3.81(m, 2H, CH2), 4.08~4.12 (m,2H,CH2),7.54(t, 1H, J1=J2=8 Hz, ArH), 7.83 (d, 1H, J=7.6 Hz,ArH), 8.17 (d, 1H, J=8 Hz, ArH), 8.36 (s,1H, ArH) ppm;13C NMR (CDCl3, 100 MHz), δ:27.54, 64.77, 108.00, 120.59, 122.99, 129.40,131.62,145.90,148.31 ppm;IR (KBr),v,cm-1:875.7, 1107.1, 1340.5, 1354.0, 1450.5, 1481.3,2897.7, 2987.7, 3088.0; MS, m/z(%): 232 (M+23, 100)。
2,4-二甲基-2-(3-硝基苯基)-1,3-二氧杂环戊烷 (1e):收率 84%,白色固体粉末,m.p.38.0 ℃~39.2 ℃;1H NMR (CDCl3, 400 MHz), δ:1.21~1.26 (m,3H,CH3),1.66 (d,3H,J=13.6 Hz, CH3), 3.58~3.75 (m, 2H, CH2), 3.90~4.06(m, 1H, CH), 7.53 (t, 1H, J1=7.6 Hz, J2=8 Hz,ArH), 7.83~7.86 (dd, 1H, J1=5.6 Hz, J2=7.6 Hz,ArH),8.16 (d,1H,J=8.4 Hz,ArH), 8.38 (d,1H, J=14.8 Hz, ArH) ppm;13C NMR(CDCl3, 100 MHz), δ: 18.75, 28.35, 71.01, 72.36, 108.09,120.51, 122.89, 129.35, 131.58, 146.41, 148.28 ppm; IR (KBr),v, cm-1: 815.9,873.8,1072.4,1348.2, 1527.6, 2982.0, 3080.3; MS, m/z (%):246 (M+23, 99)。
2-甲基-2-(4-硝基苯基)-1,3-二氧杂环戊烷(1f):收率93%,黄色固体粉末,m.p.69.3℃~73.0 ℃(lit.[33]: 73.0 ℃~75.0 ℃);1H NMR(CDCl3,400 MHz),δ:1.66 (s,3H,CH3),3.76~3.80 (m,2H, CH2), 4.07~4.11 (m, 2H, CH2), 7.67 (d,2H, J=8.8 Hz, ArH), 8.20 (d, 2H, J=8.8 Hz,ArH) ppm;13C NMR (CDCl3, 100 MHz),δ:27.43, 64.74, 108.17, 123.56, 126.42, 147.71,150.66 ppm; IR (KBr), v, cm-1: 700.2, 758.0,854.5, 881.5, 1031.9, 1201.7, 1346.3, 1450.5,1518.0,1604.8, 1691.6,1813.1,1925.0,1944.3,2852.7, 2899.0, 2972.3, 3074.5, 3107.3; MS, m/z(%): 232 (M+23, 100)。
2,4-二甲基-2-(4-硝基苯基)-1,3-二氧杂环戊烷(1 g):收率92%,淡黄色固体粉末,m.p.59.3 ℃~60.6 ℃(lit.[34]: 58.0 ℃);1H NMR(CDCl3,400 MHz), δ: 1.19 (d, 1H, J=6.4 Hz, CH3),1.35(d, 2H, J=6 Hz, CH3), 1.65 (d, 3H, J=15.2 Hz,CH3),3.24~3.60 (m,1H,CH), 3.88~4.44(m, 2H, CH2), 7.66~7.69 (dd, 2H, J1=8.8 Hz,J2=9.2 Hz, ArH), 8.20 (d, 2H, J=8.8 Hz, ArH)ppm;13C NMR (CDCl3,100 MHz), δ:18.80,28.29, 71.00, 72.36, 108.26, 123.59, 126.40,151.22, 151.95 ppm; IR (KBr), v, cm-1: 854.5,1078.2, 1519.9, 1604.8, 2891.3; MS, m/z (%):246 (M+23,100)。
2-甲基-2-(4-硝基苯基)-4-甲醇-1,3-二氧杂环戊烷(1 h):收率93%,淡黄色固体粉末,m.p.55.2 ℃~59.7 ℃;1H NMR(CDCl3, 400 MHz) δ:1.67 (d, 3H, CH3), 3.50~3.72 (m, 2H, CH2),3.80 (t,1H,J1=8 Hz, J2=7.2 Hz, CH),3.92~4.46(m, 2H, CH2), 7.68~7.71 (dd, 2H, J1=8.8 Hz,J2=9.2 Hz,ArH),8.19~8.21(m,2H,ArH)ppm;13C NMR (CDCl3, 100 MHz), δ: 27.82, 62.70,63.10, 66.00,108.89,123.63, 126.47, 150.40,151.22 ppm; IR (KBr), v, cm-1: 854.5, 1043.5,1205.5, 1244.1, 1352.1, 1516.1, 1602.9, 2873.9,2935.7, 2985.8, 3111.2, 3404.4, 3450.7; MS, m/z(%): 262 (M+23, 100)。
2-甲基-2-(4-氯苯基)-4-甲醇-1,3-二氧杂环戊烷(1i):收率76%,黄色油状液体;1H NMR(CDCl3, 400 MHz), δ: 1.61~1.65 (m, 3H, CH3),3.45~3.85 (m, 4H, CH2), 4.05~4.37 (m, 1H,CH), 7.29~7.32 (m, 2H, ArH), 7.40~7.44 (m,2H, ArH) ppm;13C NMR (CDCl3, 100 MHz), δ:28.06, 62.89, 63.28, 65.80, 109.27, 126.84,128.47, 133.84, 141.64 ppm; IR (KBr), v, cm-1:829.4, 883.4, 1014.6, 1043.5, 1093.6, 1132.2,1195.9, 1249.9,1375.3, 1398.4, 1444.7,1487.1,1595.1, 1683.9, 1911.5, 2885.5, 2935.7, 2989.7,3439.1; MS, m/z(%): 251(M+23, 95), 253 (M+25, 36)。
2-苯基-2-(2-氨基苯基)-1,3-二氧杂环戊烷(1j):收率 73%,棕色油状液体;1H NMR(CDCl3, 400 MHz), δ: 2.52 (brs, 2H, NH2), 3.70~3.73 (dd, 4H, J1=J2=7.2 Hz, CH2), 6.98~7.00(dd,1H, J1=J2=0.8 Hz,ArH),7.03~7.11 (m,2H,ArH),7.33~7.37 (m,2H,ArH),7.42~7.47(m,2H,ArH),7.79 (d,1H,J=7.2 Hz,ArH),8.05~8.07 (m, 1H, ArH) ppm;13C NMR(CDCl3,100 MHz),δ:64.08,72.41,118.44, 125.91,128.16, 128.45, 128.77, 129.34, 129.70, 131.40,134.23, 139.58, 198.82 ppm; IR (KBr), v, cm-1:640,707,752,933,1031, 1072,1122,1174,1249, 1276, 1448, 1483, 1548, 1624, 1718,2881, 2926, 2963, 3080, 3315, 3431; MS, m/z(%): 242 (M+1, 100); ESI-HRMS(calcd.), m/z:368.1278 (241.2851)[M+127]+。
4-甲基-2,2-(4-甲氧基苯基)-1,3-二氧杂环戊烷(1k):收率72%,黄色油状液体;1H NMR(CDCl3, 400 MHz), δ: 1.34 (d, 3H, J=6 Hz,CH3), 3.58 (t, 1H, J1=7.6 Hz, J2=7.2 Hz, CH),3.76 (s,3H,CH3),3.78 (s, 3H, CH3),4.07~4.29 (m, 2H, CH2), 6.81~6.86 (m, 4H, ArH),7.37~7.42 (dd,4H,J1=J2=8.8 Hz,ArH)ppm;13C NMR(CDCl3, 100 MHz), δ: 18.82, 55.27, 71.30,72.70, 113.32, 113.42,127.71, 127.82,159.33,159.40 ppm; IR (KBr), v, cm-1: 831.3, 1170.8,1246.0, 1510.3, 1610.6, 2835.4, 2933.7, 2970.4;MS, m/z(%): 301 (M+1, 45), 323 (M+23, 97)。
6,12-二苯基二苯并[b,f][1,5]二氮杂环辛四烯(2a):收率80%,黄色固体粉末,m.p.187.1℃~190.3℃ (lit.[35]:190.5 ℃~192.0 ℃);1H NMR(CDCl3, 400 MHz), δ: 6.96~7.04(m, 6H, ArH),7.29~7.36 (m, 6H, ArH), 7.39~7.44 (m, 2H,ArH), 7.76~7.78 (dd, 4H, J1=J2=1.2 Hz, ArH)ppm;13C NMR (CDCl3, 100 MHz), δ: 120.92,123.42, 126.94, 127.56, 128.25, 129.45, 129.66,131.08,138.01, 151.90,169.61 ppm; IR(KBr),v, cm-1: 690.5, 767.7, 960.6, 1317.4, 1446.6,1616.4, 3016.7; MS, m/z(%): 359 (M+1, 100),381 (M+23, 94)。
2,8-二氯-6,12-二苯基二苯并[b,f][1,5]二氮杂环辛四烯(2b):收率81%,黄色固体粉末,m.p.214.0 ℃~216.7 ℃(lit.[36]: 215.0 ℃~217.0 ℃);1H NMR(CDCl3,400 MHz),δ:6.95 (d,2H, J=2.4 Hz, ArH), 6.98 (s, 1H, ArH), 7.00 (s, 1H,ArH), 7.30 (d, 1H, J=2.4 Hz, ArH), 7.32 (d,1H, J=2 Hz, ArH), 7.37 (t, 4H, J1=7.2 Hz, J2=8 Hz,ArH),7.43~7.47 (m,2H,ArH), 7.73 (d,4H,J=7.2 Hz,ArH)ppm;13C NMR (CDCl3,100 MHz), δ: 122.54, 127.21, 128.08, 128.47,129.10, 129.43, 130.12, 131.61, 137.16, 150.15,168.84 ppm; IR (KBr), v,cm-1:692.4,819.8,852.5, 1302.0, 1315.5, 1469.8, 1614.4, 3057.2,3425.6, 3446.8; MS, m/z(%): 427 (M+1, 100),429 (M+3, 82)。
4-(2-甲基-4H-1,3,6-二噁唑啉-2-基)-苯酚(3a):收率73%,棕色固体粉末,m.p.88.4℃~92.0 ℃;1H NMR(CDCl3, 400 MHz), δ: 1.26 (t,3H,J1=6.8 Hz, J2=7.2 Hz, CH3),2.57 (s,4H,CH2), 3.73~3.80 (m, 4H, CH2), 3.82 (brs, 1H,NH),6.91 (t,2H,J1=6.8 Hz, J2=2 Hz,ArH),7.89~7.91 (dd,2H,J1=3.6 Hz,J2=2.4 Hz,ArH)ppm;13C NMR (CDCl3, 100 MHz), δ: 14.48,23.80, 42.71, 48.67, 61.22, 81.82, 116.89,124.19,129.21,150.92,168.31,176.86 ppm;IR(KBr), v, cm-1: 667.4, 815.9, 844.8, 1072.4,1107.1, 1165.0, 1220.9, 1278.8, 1508.3, 1577.8,1602.9,3307.9;MS, m/z(%): 224 (M+1,100);ESI-HRMS (calcd.), m/z: 271.1283 (223.2683)[M+48]+。
1.4 催化剂STSZ的分析表征
1.4.1 催化剂STSZ的FT-IR分析
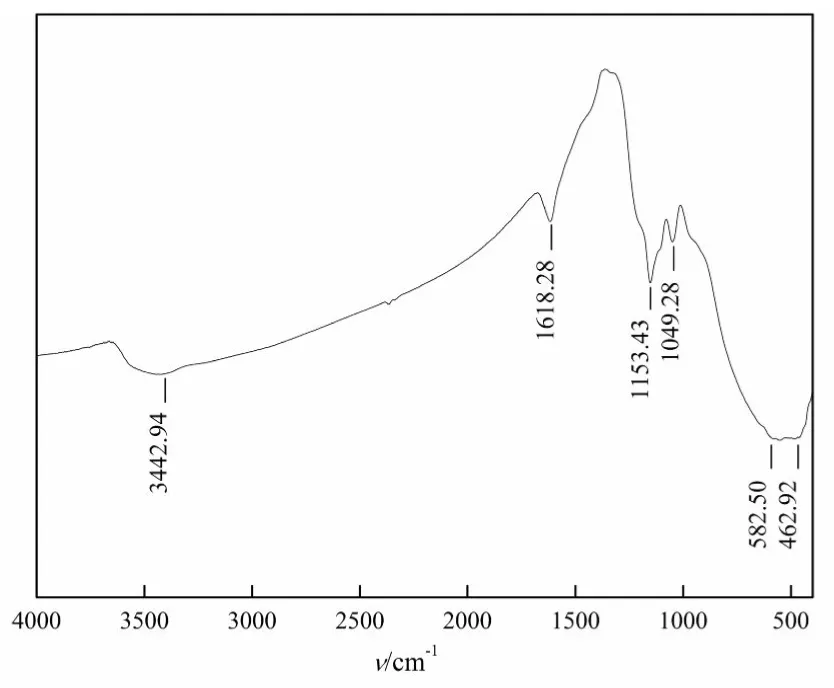
图4 固体超强酸STSZ的红外光谱图
图4 中1618 cm-1和3443 cm-1处出现的吸收峰,推测为氧化物上吸附水的O-H的弯曲振动峰和伸缩振动峰,说明固体酸表面易吸附水。1153 cm-1的吸收峰归属为与固体酸酸性有关的S=O伸缩振动峰,1049 cm-1的吸收峰归属为O=S=O的伸缩振动峰,结果表明催化剂经过硫酸根的浸渍及高温煅烧已由离子键变成了稳定的共价键,S=O具有很强的诱导效应,增强了金属钛表面的酸性,从而形成强的L酸中心。而583 cm-1处特征峰可能归属为M-O金属氧化物的伸缩振动峰。当催化剂吸水后,因为H2O吸附在L酸位上,L酸位减少,同时含硫化合物对H2O中的电子产生吸引作用,使H2O更易解离,从而使催化剂产生B酸中心。
1.4.2 催化剂STSZ的SEM分析

图5 固体超强酸STSZ的扫描电镜图
由图5可得,所制备的催化剂表面出现微孔结构,松散颗粒状,大小均匀,颗粒分布较均匀,粒子间空隙很大,从而能有效吸附有机分子。微孔结构和松散颗粒状形貌增大了催化剂的比面积,增强催化性能。
1.4.3 催化剂STSZ的EDS分析

图6 固体超强酸STSZ的能谱分析图

表1 固体超强酸STSZ的能谱分析统计表
由图6和表1可知,该催化剂中存在O、S、Ti、Sn、Zn元素,即所需的元素都已负载上去。
2 结果与讨论
2.1 反应条件的优化
以对硝基苯乙酮与乙二醇的反应为模型,对反应条件进行了优化,反应式如下所示,实验结果列于表2。对催化剂种类及用量、溶剂种类、微波功率及反应时间等进行条件优化。结果表明,固体超强酸STSZ的催化活性优于STS和ST,可能是因为添加了复合金属氧化物,提高了催化剂表面酸位密度,增大了催化剂的比面积,使催化效果更好。当有机溶剂为PEG-400,催化剂为固体超强酸STSZ,催化剂用量为1.0 g,微波功率390 W,反应15 min时制备得到2-甲基-2-(4-硝基苯基)-1,3-二氧杂环戊烷(1f),产率较高,达到93%(表 2, Entry 14)。

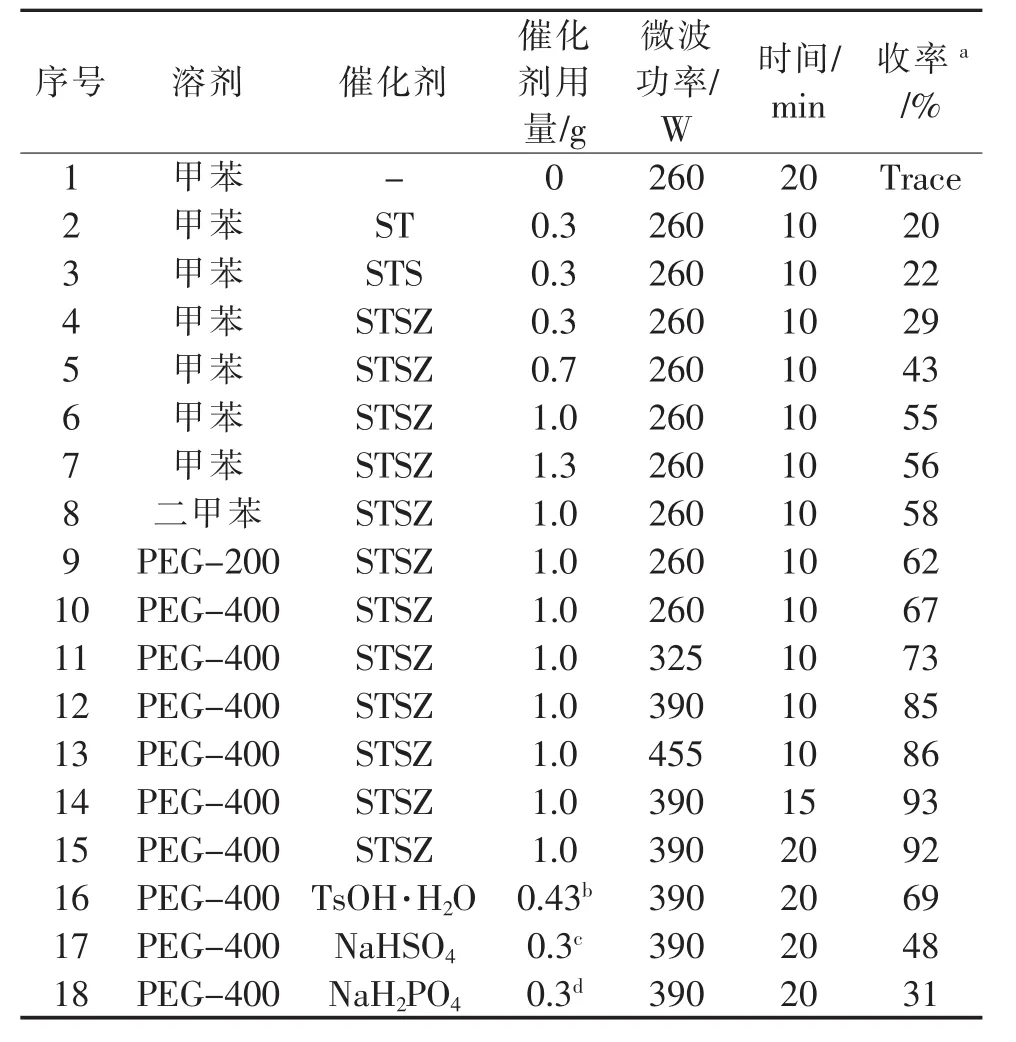
表2 反应条件的优化
2.2 催化剂STSZ的回收利用
上述典型反应按照优化反应条件进行,反应结束后,催化剂经过抽滤回收,用无水乙醇洗涤,在100℃下干燥2 h,重新使用。由于每次回收操作过程中催化剂会有部分损失,所以需要加入新催化剂,使催化剂总量保持恒定,考察使用次数对催化剂活性影响。实验表明,在补加一定量新催化剂的条件下,循环使用5次,每次循环使用,催化剂活性略有降低,收率从93%降至82%。结果见表3。
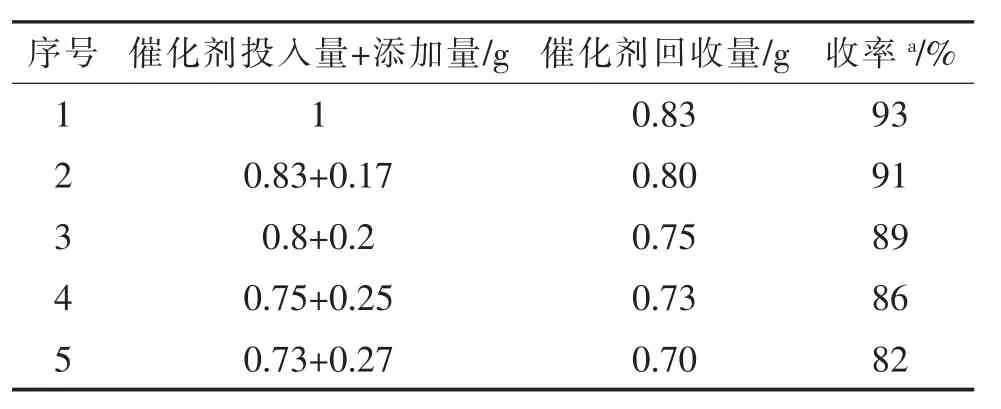
表3 固体超强酸STSZ的循环使用实验
2.3 固体超强酸STSZ催化合成1,3-二氧戊烷类化合物及其它产物
在上述优化条件下,通过微波合成一系列1,3-二氧戊烷类化合物及其他产物,结果见表4。在 1,3-二氧戊烷类化合物(1a~1k)的合成中(Entry 1~Entry 11),含有甲基和氯取代的芳香酮产率低于吸电子硝基取代的芳香酮;硝基在苯环上取代的位置对产率的影响不大;1,2-二醇结构上方面,乙二醇、1,2-丙二醇、丙三醇对产率的影响很小。当酮为2-氨基二苯甲酮类化合物,醇类为乙醇时,意外地发生了2-氨基二苯甲酮类化合物分子间的缩合反应,制备得到含八元环的6,12-二苯基二苯并 [b,f][1,5]二氮杂环辛四烯类化合物(2a, 2b)(Entry 12, Entry 13)。 另外,我们还尝试了4-羟基苯乙酮和二乙醇胺的缩合反应,成功制备得到含八元噁唑啉环化合物。
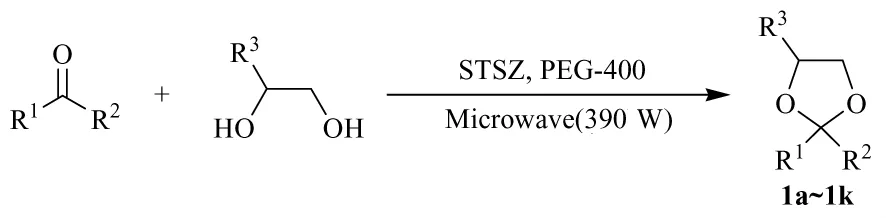

表4 固体超强酸STSZ催化酮类化合物与二醇类或乙醇的缩合反应
3 结论
实验结果表明:5 mmol的酮,10 mmol的1,2-二醇类化合物,固体超强酸SO42-/TiO2-SnO2-ZnO催化剂 (酮与催化剂质量比为 10:15),20 mL的PEG-400,微波功率 390 W,反应 15 min,合成了11种1,3-二氧戊烷类化合物,2种二苯基二苯并[b,f][1,5]二氮杂环辛四烯类化合物以及 4-(2-甲基-4H-1,3,6-二噁唑啉-2-基)-苯酚, 反应收率72%~93%,其中有4种化学物未见文献报道。
固体超强酸SO42-/TiO2-SnO2-ZnO在缩酮的催化合成中具有良好的催化活性,生产工艺简单,产物易分离,且减少了后处理操作,减少“三废”污染,产品质量好,催化剂易回收。在催化剂回收实验中我们发现固体超强酸SO42-/TiO2-SnO2-ZnO,在每次回收后活性都有所降低,可能原因是硫酸根离子的流失,通过补加少量新制的固体超强酸SO42-/TiO2-SnO2-ZnO,反应收率基本稳定在82%~93%。总之,本实验的研究为缩酮类化合物的合成提供了一种简单有效、绿色经济的方法。
