添加Bi对Cu-Sn合金电化学腐蚀性能的影响
2019-03-28李灿灿谷传峰马迎迎王恩华马学美
李灿灿,谷传峰,刘 艳,白 鸽,马迎迎,曹 培,王恩华,马学美
(齐鲁工业大学(山东省科学院)实验室与设备管理处,山东 济南 250353)
传统 Sn-Pb 合金应用在电子封装领域已有几千年的历史,但由于含Pb化合物对人类健康和生活环境的带来危害,世界各国都已经开始限制含Pb制品的生产。目前的无铅焊料主要采用 Sn-Bi、Sn-Ag、Sn-Zn、Sn-Cu以及 Sn-Ag-Cu 等系列合金[1]。Sn-Cu合金由于其成本较低,具有较低的熔化温度,对铜基体的润湿性能好,导电性、延展性良好被广泛应用于焊接领域[2-3]。而焊点经常受到大气及海洋环境的腐蚀,而添加元素会在一定程度上影响合金的性能。本文通过添加一定量的Bi研究成分改变对合金组织及其电化学腐蚀性能的影响,初步探讨了 Cu-Sn-Bi 合金在3.5% NaCl溶液中的腐蚀状况和腐蚀机理。
1 试验方法
实验所用原材料为99.9%以上的纯铜(Cu)以及99.99%以上的高纯铋(Bi)、锡(Sn)。将试验材料放入坩埚性气体保护下熔炼浇注成预制合金试样。由熔体合金过热到800℃浇到铜模中制得待测样品。采用模块化电化学工作站,用3.5% NaCl溶液作为腐蚀液,扫描速度为10mV/s,将合金试样打磨抛光成表面光滑的薄片,连接各电极进行电化学腐蚀试验,根据所测数据绘制图谱得到极化曲线。利用 SEM 观察组织形貌,通过XRD分析相的成分,对腐蚀前后的组织和相进行分析讨论。
2 结果与分析
2.1 Cu-Sn合金腐蚀前后的XRD图谱
图1为Cu20Sn80和Cu5Sn80Bi15合金的凝固组织在3.5% NaCl溶液中经电化学腐蚀前后的XRD图谱。由图1可知,Cu20Sn80腐蚀前主要以Cu6Sn5金属间化合物相和Sn基体相存在,而在3.5% NaCl溶液中腐蚀后有Sn3O(OH)2Cl2析出。Bi原子在Sn基体中固溶度有限,多余的Bi在Sn基体中以富Bi相存在,经腐蚀后形成Bi2O3腐蚀产物[4]。
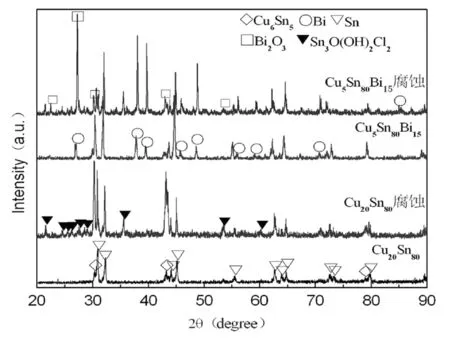
图1 Cu20Sn80及Cu5Sn80Bi15合金腐蚀前后的XRD图谱
2.2 添加Bi对Cu-Sn合金的耐蚀性的影响
图2为添加不同含量Bi的合金试样经电化学腐蚀后得到的动电位极化曲线。表1是极化曲线对应各试样的电化学参数。可以看出,各曲线变化基本一致,试样在阳极极化曲线后有一段宽且稳定的阳极腐蚀区,在此区域阳极腐蚀电流区域较为平稳。在点蚀电位Epit处,电流密度急剧增大,阳极点蚀速率加快。腐蚀电位Ecorr,电位值越负越易发生阳极极化。由图2及表1得出,与Cu20Sn80合金相比,添加Bi可以增大自腐蚀电位及点蚀电位,即提高了试样的耐腐蚀性。由1-5号试样的电化学腐蚀数据得出,它们的自腐蚀电位及点蚀电位相差不大,3号合金Cu15Sn80Bi5具有最正的自腐蚀电位,但腐蚀电流密度最大,说明其腐蚀速度最大。

图2 添加Bi对Cu-Sn合金电化学腐蚀性能的影响
2号合金即Cu17Sn80Bi3合金具有较大的自腐蚀电位,最小的腐蚀电流密度,说明Cu17Sn80Bi3合金耐蚀性在这几种成分中最好。由图3看出,在腐蚀的过程中,5个试样都经历了活化-钝化-点蚀过程。由此可以得出,添加适量的Bi可以提高合金的耐腐蚀性。究其原因,随 Bi 量的增加,组织形貌发生明显变化,富 Cu相颗粒尺寸减小,富 Bi 相析出逐渐增多,Bi 主要固溶在基体β-Sn中,而Bi 在Sn 中的固溶度很小(室温下质量分数约为 1%),富Bi相从Sn基体中析出,使Cu6Sn5金属间化合物的生长受阻,从而细化了β-Sn基体组织[5],增强了其耐腐蚀性。当Bi含量添加到一定量时,其腐蚀电位和点蚀电位变化较小,说明添加合金元素对Cu-Sn耐蚀性的影响有限。
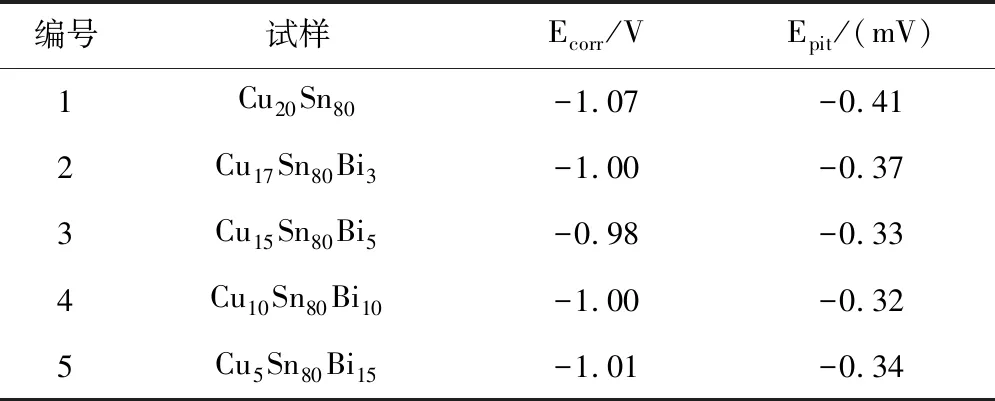
表1 添加Bi在相同条件下凝固得到的Cu-Sn合金的电化学参数

(a:Cu20Sn80合金;b:Cu5Sn80Bi15合金)

表2 腐蚀后试样各点的EDS分析 (100 at.%)
图3为腐蚀后试样的扫描电镜图像,腐蚀后的表面散落着一些碎裂的钝化膜,裸露出内部腐蚀后的组织,并分布有一些不规则蚀孔。图3(a)为Cu-Sn合金试样的腐蚀形貌,腐蚀表面组织疏松,表面散落尺寸较大的腐蚀产物。对腐蚀表面特征区域进行EDS分析(见表2),各点能谱曲线相似,腐蚀后合金表面同样检测含有Sn、Cl及O等元素的腐蚀产物。图3(b)为Cu5Sn80Bi15腐蚀后的SEM图像,其表面腐蚀较为均匀,蚀孔尺寸较小,表面分布着呈树枝状的亮色腐蚀产物,经EDS分析,样品表面为未腐蚀的富Cu相及Sn、Cl及O元素组成的腐蚀产物,未检测到富Bi组织(见表2)。推测是由于Bi的电负性相较Cu、Sn比较大,在NaCl溶液中先被腐蚀掉[6],从而保护了富铜相组织。Sn3O(OH)2Cl2这种复杂化合物的形成需经过一定的复杂反应过程[7-8]:首先阴极发生反应
O2+4e+2H2O 4OH-
(1)
当反应达到一定程度,阴极将发生反应
2H2O+2e 2OH-+H2
(2)
阳极反应较复杂,其可能生成Sn3O(OH)2Cl的反应为[9]
3Sn+4OH-+2Cl--6e-=Sn3O(OH)2Cl2+H2O
(3)
3 结语
在Cu-Sn合金中添加适量的Bi,其耐腐蚀性也得到一定程度的提高。Bi的电负性较大,析出的富Bi相先发生腐蚀,保护了富Cu相及富Sn相。β-Sn中固溶了一定量的Bi,使表面组织更加均匀致密,从而在一定程度上提高了Cu-Sn合金的耐腐蚀性能。
