人非小细胞肺癌中TSG101蛋白、MDM2蛋白及突变型P53蛋白的表达
2019-03-27徐艳曾子华
徐艳,曾子华
(1.大连市金州区第一人民医院病理科,辽宁 大连 116100;2.美国德克萨斯州休斯敦卫理公会医院研究所肿瘤病理实验室)
肿瘤易感基因101(tumor suppressor gene 101,tsg101),自发现之日始,人们对它与肿瘤发生发展关系的认识从“肿瘤抑制作用”[1]到“剪接变异体”[2]、“肿瘤增强作用”[1],一直备受争议。研究表明正常细胞中tsg101与mdm2两种基因及其产物之间存在着一种反馈循环,可通过蛋白降解的方式调节及平衡两种蛋白的水平,继而通过影响p53与mdm2间的反馈循环来调节p53的产物水平[3]。本实验通过免疫组化的方法在光镜下评估分析TSG101蛋白、MDM2蛋白和突变型P53蛋白在人非小细胞肺癌(NSCLC)组织中的表达情况,以及TSG101蛋白在肺癌发生发展中的作用和三种蛋白表达水平之间的关系。
1 资料与方法
1.1 一般资料 选择2004年1月至2006年12月暨南大学附属第一医院等四家医院存档的81例人肺组织蜡块为研究对象,其中非小细胞肺癌71例(肺癌组,其中鳞癌33例,腺癌38例)、肺炎症性病变10例(对照组)。肺癌组中男48例,女23例;年龄(57.03±11.93)岁;发生淋巴结转移者35例。
1.2 病理学诊断 由2名临床病理主治医师对71例肺癌的肿瘤分化程度[4]进行评估。高分化腺癌特征为腺体形成完好,癌细胞呈高柱状或黏液样,胞浆透明或嗜酸,胞核位于基底,核仁明显,核分裂像常见;中分化腺癌,腺体分布杂乱,癌细胞异型明显,间质反应明显;低分化腺癌主要特征为癌细胞呈实性片状生长,缺乏腺体或腺体结构形成不完整。高分化鳞癌特征为砌砖样结构,癌细胞胞浆嗜酸,核类圆,核仁明显,细胞间桥明显,角化珠易见;低分化鳞癌的细胞异型性明显,核分裂易见,坏死及出血常见,细胞间桥及角化极少见;中分化鳞癌形态特征介于两者之间。本研究71例肺癌中,高分化肿瘤(腺癌+鳞癌)8例,中分化肿瘤(腺癌+鳞癌)31例,低分化肿瘤(腺癌+鳞癌)32例。
1.3 主要试剂 TSG101蛋白、MDM2蛋白、突变型P53蛋白抗体分别购自美国Santa Cruze公司、北京中衫金桥公司以及福州迈新公司。免疫组化EliVisionTMplus检测试剂盒及其余相关试剂均购自福州迈新公司。
1.4 方法 采用免疫组化EliVision法进行操作,具体过程参照试剂盒,设有阴性和阳性对照。本实验共分3次完成,每次对71例组织白片进行一种抗体的免疫组化染色。肺癌组每种抗体的免疫组化均出现技术性掉片,其中TSG101蛋白1例、MDM2蛋白2例、突变型P53蛋白3例;对照组3种抗体均未出现掉片。故实际纳入TSG101蛋白、MDM2蛋白、突变型P53蛋白各自的肺癌组与对照组比较、3种蛋白分别与肺癌临床病理特征的相关分析的病例数均分别为70例、69例、68例;实际纳入TSG101蛋白与MDM2蛋白的相关性分析的为68例。
1.5 结果的判读 TSG101蛋白显色于胞浆,MDM2蛋白和突变型P53蛋白均显色于细胞核。评估方法[5]:(1)每张切片高倍(400×)镜下挑选5个肿瘤视野区;(2)每个视野下随机计数100个肿瘤细胞同时评估它们的着色情况(无色=0分、淡黄=1分,棕黄=2分,棕褐=3分);(3)算出每张切片5个视野中显色(胞核着色于背景者)细胞一共所占的百分比并打分(全阴=0分,≤10%=1分,11%~50%=2分,51%~75%=3分,>75%=4分);(4)算出每张切片(2)、(3)两组分数的乘积即综合评分:0~3分者归为“阴性”,>3分者归为“阳性”(4、5分=弱阳性,6~8分=中等阳性,9~12分=强阳性)。整个判读过程在“双盲”(实验人员对诊断结果、临床信息完全不知情)情况下完成。
1.6 统计学方法 采用SPSS 17.0软件进行统计学分析,计数资料采用χ2检验,相关性分析采用精确概率法以及等级相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 TSG101蛋白、MDM2蛋白、突变型P53蛋白在肺癌中的表达 本实验中TSG101蛋白在肺癌组主要呈弱阳性表达(37/70,52.9%),在对照组主要呈中等阳性表达(9/10,90%),2组的表达水平比较,差异有统计学意义(P=0.000);MDM2蛋白在肺癌组主要呈中等阳性表达(33/69,47.8%)和强阳性表达(28/69,40.6%),对照组主要呈弱阳性表达(4/10,40%),无中等阳性和强阳性表达,2组的表达水平比较,差异有统计学意义(P=0.000);突变型P53蛋白只在肺癌组中有表达(30/68,44.12%),2组的表达水平比较,差异有统计学意义(P=0.016),见表1。
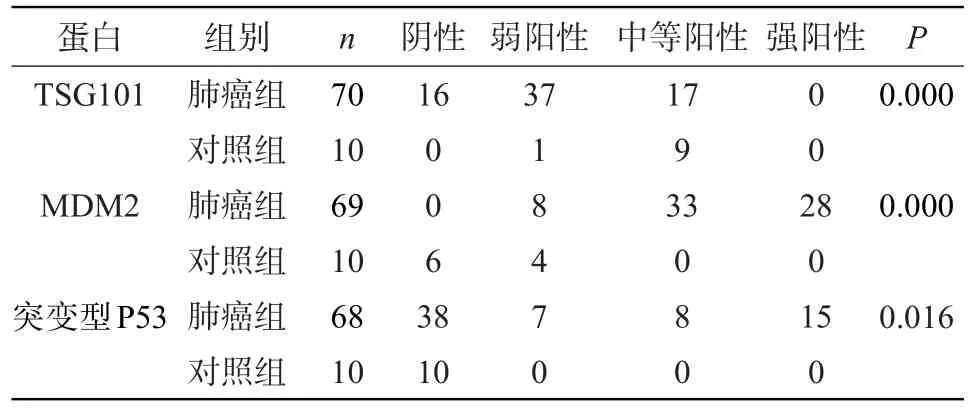
表1 肺癌中TSG101、MDM2及P53蛋白的表达
2.2 三种蛋白的表达与肺癌临床病理特征的关系 本实验中TSG101蛋白在肺癌组织的表达程度与其组织学类型、肿瘤分化程度、淋巴结转移以及性别、年龄无关(P>0.05);MDM2蛋白的表达程度与肺癌组织肿瘤分化程度有关(P=0.007),与其他参数无关(P>0.05);突变型P53蛋白与淋巴结转移与否相关(P=0.005),与其他临床病理参数无关(P>0.05),见表2。
2.3 TSG101蛋白与MDM2蛋白的相关性分析 TSG101蛋白与MDM2蛋白综合评分的等级相关分析显示,肺癌组织中两种蛋白的表达不具相关性(P=0.294),但在突变型P53蛋白阴性(P53不显色,综合评分为0)时,两者的表达具有相关性(P=0.000);另外在不伴有淋巴结转移的肺癌组织中,两者的表达也具有相关性(P=0.016)。经卡方检验分别比较TSG101蛋白在突变型P53蛋白阳性肺癌、突变型P53蛋白阴性肺癌2组以及淋巴结转移、未转移2组的表达,结果均没有显著性差异(P值分别为0.679、0.073);MDM2蛋白在突变型P53阳性肺癌、突变型P53蛋白阴性肺癌2组中的表达具有显著差异(P=0.011),而在淋巴结转移、未转移2组中的表达没有差异(P=0.124)。
3 讨论
3.1 TSG101蛋白在肿瘤形成及发展中的角色 本实验中TSG101蛋白在肺癌中的表达水平明显低于正常肺组织(P=0.000),提示tsg101基因在肺癌的形成或发展过程中可能具有肿瘤抑制作用。这一结论与Liu等[6]的报道相似,Broniarczyk等[7]也证明TSG101蛋白在宫颈癌中呈低表达。有研究发现 TSG101蛋白在胃癌[8]、结肠癌[9]、肝癌[10]、胆囊癌[11]、前列腺癌[12]等大多数肿瘤组织中表达过度;并且,在进一步的研究中不仅发现绝大多数肿瘤组织中的tsg101基因未曾出现基因突变,还发现该基因由于异常转录而出现了大量的剪接变异体,认为其具有致癌性[2];但Gamazon等[13]发现有近90%的蛋白质编码基因会发生可变剪接,认为这也可能只是一种普遍现象。
Sai等[14]发现TSG101蛋白可能参与多种肿瘤细胞的入侵过程,是一个多面的基因,其在癌症的发病率和致死率密切相关的过程中可能发挥着双向调节的作用——在某些肿瘤中可能具有抑制肿瘤的作用,在另一些肿瘤中可能具有增强肿瘤的作用,即可能以双向或者多面的方式参与肿瘤的形成与发展。
3.2 肿瘤组织中tsg101、mdm2和p53间的关系 已知肿瘤发生的基础是由细胞周期调控改变所导致的细胞增殖与凋亡之间的失衡。MDM2蛋白水平的变化会扰乱细胞周期的调控从而导致肿瘤发生[15],其数量和稳定性受 p73、p53、TSG101、p14ARF和Ras-Raf-MEK-ERK等途径调节[3,16]。因 TSG101 蛋白缺陷所导致的 p21 依赖的细胞周期阻滞是一种间接结果,即与P53相关途径有关,并非是TSG101蛋白基于MDM2作用的结果[17]。本实验结果显示肺癌中TSG101蛋白与MDM2蛋白的表达不具相关性(P=0.294),但在P53全阴性肺癌中时,两者的表达具有相关性(P=0.000),并且MDM2蛋白在突变型P53蛋白阳性肺癌与突变型P53蛋白全阴肺癌2组中的表达差异有统计学意义(P=0.011),提示TSG101-MDM2反馈环路的改变在肺癌的发生发展中具有影响,该环路的改变可能与p53基因的突变方式有关。另外本实验还显示在肺癌不伴有淋巴结转移的情况下,TSG101蛋白与MDM2蛋白的表达具有相关性(P=0.016),提示TSG101-MDM2反馈环路的改变可能与肿瘤的侵袭性有关。
3.3 问题与展望 本实验中TSG101蛋白的低表达水平与淋巴结转移、组织学分级等参数比较后并未发现相关性(P>0.05),究其原因,可能与样本的数量不足有关。本研究确定并验证了TSG101蛋白在非小细胞肺癌中的低表达状态,这一改变对肺癌的发生的具体作用机制还有待更深入的研究。
致谢:感谢暨南大学附属第一医院、暨南大学附属第四医院、广东省第二人民医院、广东省胸科医院病理科对本研究的支持。
