HBV PC区和BCP区变异与Peg-IFNα-2b疗效的关系及治疗前后的变化*
2018-09-27刘艳艳李家斌
汪 波, 刘艳艳, 李家斌,2△
(1安徽医科大学第一附属医院感染科, 安徽 合肥 230022; 2安徽医科大学附属巢湖医院感染科, 安徽 巢湖 238000)
慢性乙型肝炎(chronic hepatitis B,CHB)是引起肝硬化、肝衰竭以及肝细胞肝癌的主要病因[1],当前主要治疗药物包括核苷酸类似物(nucleotide analogues,NAs)和聚二乙醇化干扰素α(peginterferon α,Peg-IFNα)两大类。Peg-IFNα较NAs除了具有抗病毒作用外还具有免疫调节的功能,有限疗程(48周)Peg-IFNα治疗可以使25%~30%的患者获得持久的治疗应答[2];但是Peg-IFNα在临床应用过程中存在治疗费用高、副作用大以及应答率相对较低等问题,因此选择合适的患者接受Peg-IFNα治疗仍是有待解决的重要临床问题。乙肝e抗原(HBeAg)水平是评估疾病状态及抗病毒疗效的一项重要血清学指标,HBeAg血清转换多预示疾病的缓解[3],但是HBeAg血清转换的机制仍不完全清楚。由于乙型肝炎病毒(hepatitis B virus, HBV)逆转录酶缺乏保真性,病毒在长期感染复制过程中容易发生突变;其中前核心(precore, PC)区G1896A和基本核心启动子(basal core promoter, BCP)区A1762T/G1764A突变可以终止或降低HBeAg合成,因此与HBeAg血清转换存在一定关系[4]。
近年来有研究提出,CHB患者治疗前HBV存在PC区G1896A和/或BCP区A1762T/G1764A位点变异均可能会降低Peg-IFNα疗效,从而不推荐将Peg-IFNα作为此类患者首选治疗方案[5-6];但是此类研究对象以西方A/D基因型CHB患者占主体,无法代表国内B/C基因型为主的CHB患者治疗情况。国内相关研究则局限于病例数少、治疗使用普通干扰素以及疗程不足48周[7-8],因而PC/BCP区相关突变对国内B/C基因型为主的CHB患者48周足疗程Peg-IFNα-2b治疗应答的影响尚不明确。此外患者体内HBV PC/BCP区突变情况在治疗前后的变化鲜有报道,是否与干扰素疗效存在关系仍不清楚。因此,本研究的目的是通过分析HBeAg阳性CHB患者中PC/BCP区突变情况,探讨其与Peg-IFNα-2b病毒学和血清学应答的关系,以及PC/BCP区突变在Peg-IFNα-2b治疗前后的变化情况,为临床工作者的诊疗选择提供依据。
材 料 和 方 法
1 研究对象
所有HBeAg阳性CHB患者均来自于先前的一项安徽省随机开放多中心Ⅳ期临床研究[9-10](2012年6月~2014年7月),共有100名患者参与初始临床试验,排除11位血清标本不全患者,共89例患者血清进行测序分析;去除20例测序失败(重复2次)患者,最终69例患者纳入当前研究。每位患者诊断及治疗指征符合《慢性乙型肝炎防治指南(2015版)》[11]:(1)HBsAg和HBeAg两项均阳性并且超过6个月;(2)HBV DNA≥20 000 IU/mL且丙氨酸转氨酶(alanine aminotransferase, ALT)≥2×正常值上限(upper limit of normal value,ULN),≤10×ULN;(3)血清总胆红素<2×ULN。排除标准:(1)合并HAV、HCV、HDV、HEV或HIV等其它病毒感染;(2)有精神病史及未控制的癫痫、失代偿肝硬化等;(3)任何其它严重基础疾病的。所有患者均签署知情同意书,研究得到安徽医科大学第一附属医院伦理委员会的批准(Grant No: K2010003)。
2 研究方法
2.1治疗方法及随访 入选本研究的69例患者均接受Peg-IFNα-2b(商品名佩乐能,爱尔兰先灵葆雅公司)1.5 μg/kg,每周1次,皮下注射;其中35例(51%)患者随机联合阿德福韦酯(10 mg/d,口服);疗程共48周并随访24周。每位患者于第0、4、8、12、24、36、48、60和72周定期随访并采集外周静脉血20 mL,离心取上清,-80 ℃保存备用。
2.2临床实验室检查 患者HBV DNA、HBsAg和HBeAg水平由患者随访时于安徽医科大学第一附属医院感染科实验室检测完成。Roche COBAS TaqMan 48荧光定量PCR仪检测HBV DNA载量,检查下限为20 IU/mL,检测上限为1.70×108IU/mL。HBsAg、HBeAg和HBeAb检测使用美国罗氏公司产品:HBsAg检查下限为0.05 IU/mL;HBeAg<1 COI为阴性,>1 COI为阳性;HBeAb<1 COI为阳性,>1 COI为阴性。HBV基因型在患者治疗前由上海之江生物有限公司检测完成。
2.3HBV病毒基因组提取、扩增及测序 取患者第0周和第72周于-80 ℃保存的血清各200 μL,按照QIAamp MinElute Virus Spin Kit (Qiagen)说明,提取基因组DNA,-80 ℃保存备用。根据中国HBV参考序列[12],使用Oligo 7.0软件设计一对引物:上游引物F1为5’-GCAATGTCAACGACCGACCT-3’,下游引物R1为5’-CACCCCAACACAGAATAGCTTG-3’,扩增片段(第1 677~2 069位核苷酸)包含PC区和BCP区。扩增条件为:94 ℃ 3 min; 94 ℃ 30 s、57.3 ℃ 30 s、72 ℃ 30 s,共35个循环。PCR产物直接送华大基因测序,测序结果使用Chromas 2.1和Lasergene 7.1软件分析。
2.4分组及治疗应答 分组参考Sonneveld等[5]的研究,分为野生型(wild-type,WT;无G1896A和A1762T/G1764A突变)和突变型(存在G1896A和/或A1762T/G1764A突变),其中突变型包括PC突变型(只存在G1896A突变,或同时存在G1896A突变和野生株)、BCP突变型(只存在A1762T/G1764A突变,或同时存在A1762T/G1764A突变和野生株)和PC+BCP突变型(同时存在G1896A、A1762T/G1764A突变,有或无野生株)。根据患者HBeAg基线水平四分位数可分为4组:第1组(基线HBeAg<1.958 0 logIU/mL),第2组(>1.958 0,<2.891 9 logIU/mL),第3组(>2.891 9,<3.028 9 logIU/mL)和第4组(>3.028 9 logIU/mL)。HBeAg血清转换定义为:HBeAg<1 COI(阴性),HBeAb<1 COI(阳性)。联合应答(combined response,CR):72周随访结束时HBeAg血清转换+HBV DNA<2 000 IU/mL。
3 统计学处理
采用SPSS 21.0统计软件进行统计分析。符合正态分布的计量数据以均数±标准差(mean±SD)表示,两组间比较采用t检验,多组间比较采用方差分析;计数资料采用2检验或Fisher确切概率法。R×C列联表资料的2检验若P<0.05,则进行任意两组间比较(卡方分割)并行显著性校正。以P<0.05为差异有统计学意义。
结 果
1 患者特征
由于患者接受Peg-IFNα-2b单药(n=34,49%)与联合阿德福韦酯(n=35,51%)对其72周治疗应答无影响(HBeAg血清转换率两组比较2=0.189,P=0.664;联合应答率两组比较2=0.289,P=0.591),再结合文献[5-6, 13]的分组方式,2组患者将被合并分析基线特征及治疗学应答,见表1。
2 患者PC/BCP区基线突变情况
BCP区A1762T/G1764A野生型和突变型PCR产物测序结果见图1A、1B;PC区G1896A野生型和突变型PCR产物测序结果见图2C、2D。69例患者中14例检测为WT(20.29%),55例检测为突变型(79.71%),其中PC突变型19例(27.53%),BCP突变型20例(28.99%),PC+BCP突变型16例(23.19%),见表1。根据HBV基因型再分类,B基因型患者中PC突变型占18例(51%),而C基因型患者中仅1例(3%);C基因型患者中BCP突变型占19例(58%),而B基因型患者中仅1例(3%)。B/C基因型患者在WT、PC突变型、BCP突变型和PC+BCP突变型所占构成比上存在差异(2=34.553,P<0.001),见图2。
表1患者基线特征
Table 1. Baseline characteristics of the study cohort (Mean±SD.n=69)
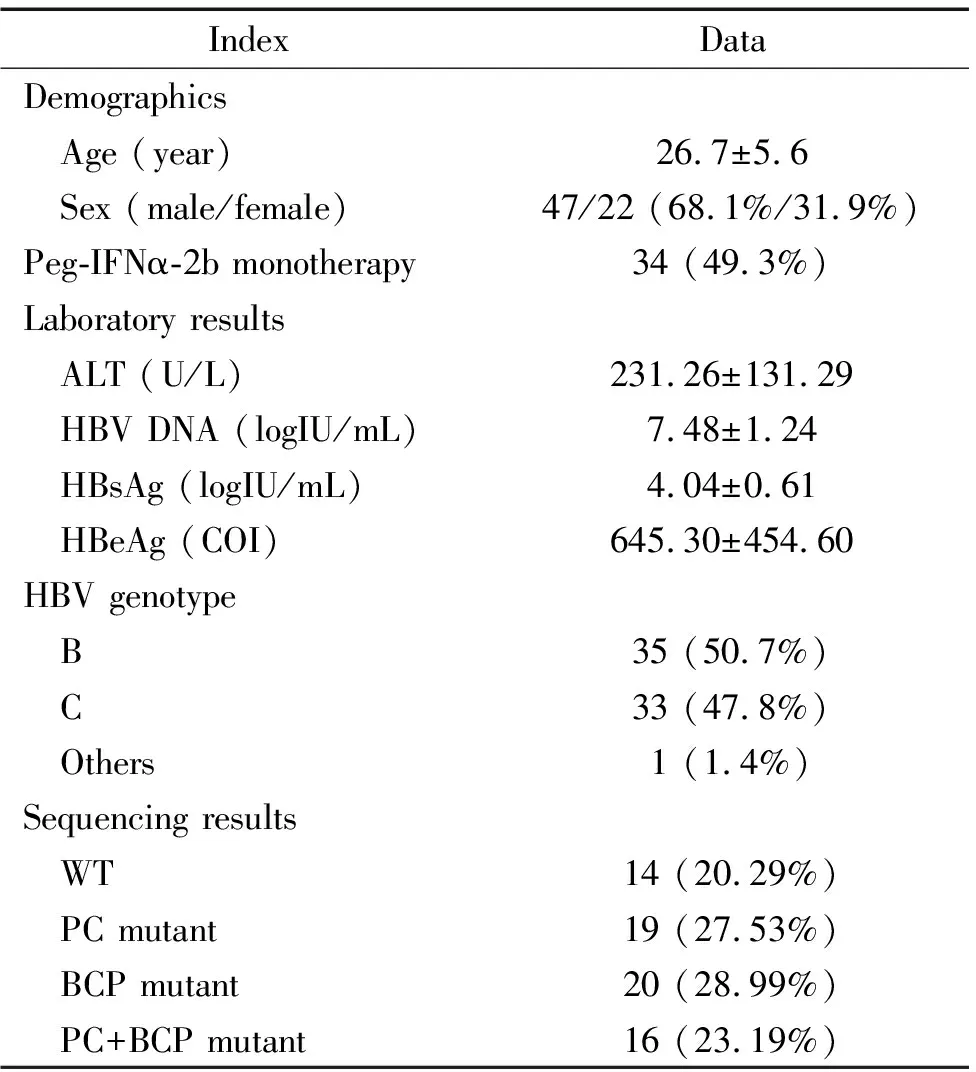
IndexDataDemographics Age (year)26.7±5.6 Sex (male/female)47/22 (68.1%/31.9%)Peg-IFNα-2b monotherapy34 (49.3%)Laboratory results ALT (U/L)231.26±131.29 HBV DNA (logIU/mL)7.48±1.24 HBsAg (logIU/mL)4.04±0.61 HBeAg (COI)645.30±454.60HBV genotype B35 (50.7%) C33 (47.8%) Others1 (1.4%)Sequencing results WT14 (20.29%) PC mutant19 (27.53%) BCP mutant20 (28.99%) PC+BCP mutant16 (23.19%)
HBeAg: hepatitis B e antigen; HBsAg: hepatitis B surface antigen.
3 WT和突变型患者基线血清标志物的比较
与突变型相比,WT患者HBeAg基线水平更高(t=2.312,P=0.024),ALT水平较低(t=2.312,P=0.012),而年龄、HBV DNA和HBsAg的差异则均无统计学显著性,见表2。
4 72周时患者PC/BCP区突变情况
72周时共59例(86%)患者标本扩增产物测序成功。治疗后14例WT患者中10例(71%)转变为突变型;治疗后PC突变型、BCP突变型和PC+BCP突变型患者也均存在突变情况的改变,但均未发现向WT逆转的现象;患者基线和72周WT、PC突变型、BCP突变型和PC+BCP突变型所占构成比发生明显变化(2=13.178,P=0.004),见图3。
5 WT和突变型患者HBeAg基线水平及治疗应答比较
根据所有患者的HBeAg水平四分位数,由低到高将患者分为4组,随着HBeAg滴度的增高,WT患者在各组所占百分比表现出逐渐升高的趋势,见图4A;第1组在72周有着相对更高的HBeAg转阴率和联合应答率(53%和41%),4组在72周时的HBeAg转阴率和联合应答率的差异均无统计学显著性(Fisher确切概率法,P=0.070和P=0.054,P值均接近临界值),见图4B。

Figure 1. The sequencing results for BCP region A1762T/G1764A (A and B) and PC region G1896A sites (C and D).
图1BCP区A1762T/G1764A和PC区G1896A位点测序结果
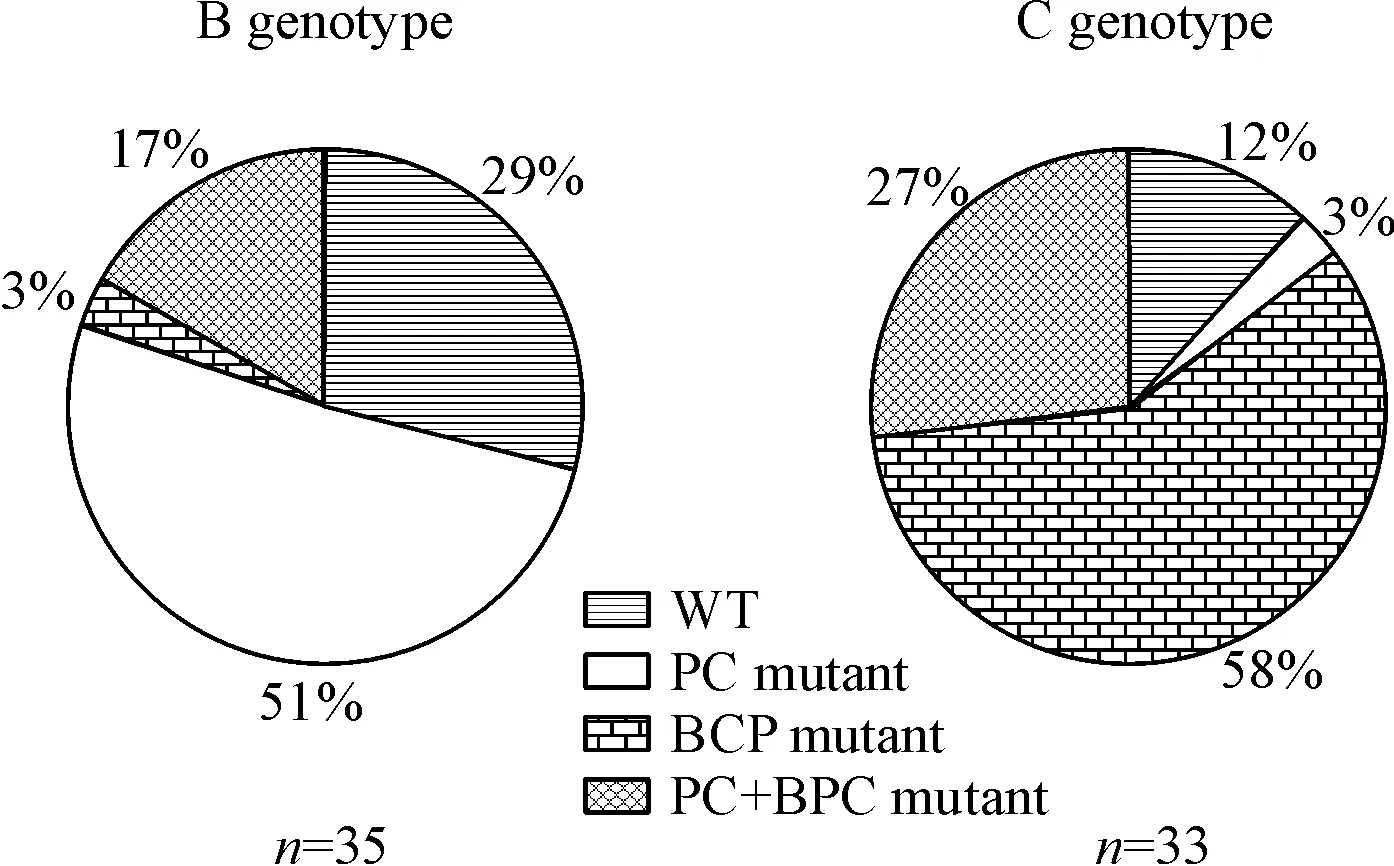
Figure 2. Frequencies of PC and BCP mutants at baseline in the study cohort with HBV genotypes B and C.
图2B、C基因型患者WT和各突变型所占百分比
6 PC区和BCP区突变对治疗72周患者应答效果的影响
所有患者根据突变情况分为WT组和突变型组,72周时HBeAg血清转换率和联合应答率的差异无统计学显著性(Fisher确切概率法,P=0.523和P=1.000),见图5A。当患者根据突变情况分为WT组、BCP突变型组、PC突变型组和PC+BCP突变型组时,72周时HBeAg血清转换率和联合应答率的差异仍无统计学显著性(Fisher确切概率法,P=0.207和P=0.590),见图5B。
讨 论
乙肝病毒感染是世界性公共卫生难题,全球约有2.4亿慢性乙型肝炎患者,中国大约有9 300万[14]。积极的抗病毒治疗是阻止慢性乙型肝炎疾病进展的重要手段,Peg-IFNα在其中发挥了重要作用[1]。
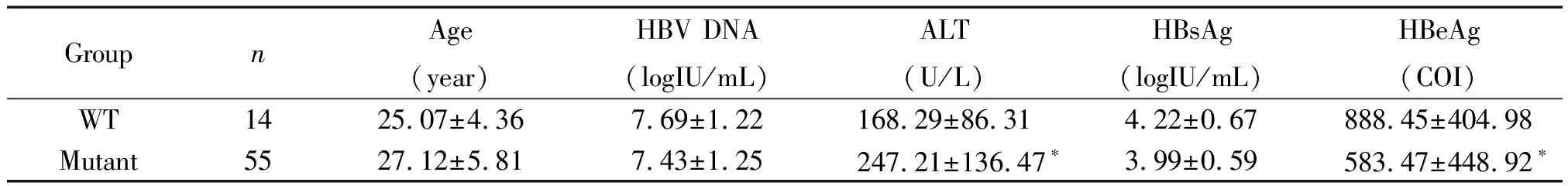
表2 WT和突变型患者基线水平血清标志物的比较
*P<0.05vsWT group.

Figure 3 Baseline and week 72 sequencing results in patients (n=59).
图3患者基线和72周WT、PC突变型、BCP突变型和PC+BCP突变型变化情况

Figure 4. The proportion of WT and mutant divided by baseline HbeAg level (A) and relationship between baseline HbeAg level and response to Peg-IFNα-2b at week 72 (B). Combined response was defined as HBeAg serconversation and HBV DNA<2 000 IU/mL at week 72.
图4HBeAg基线水平与突变的关系及对应答的影响
HBeAg血清学转换是HBeAg阳性CHB患者抗病毒治疗过程中一项重要的血清学应答指标,而影响HBeAg血清转换包括宿主、病毒及治疗方案等多种因素[15-16]。有研究发现HBeAg血清转换与HBV病毒PC区G1896A和BCP区A1762T/G1764A变异终止或降低HBeAg合成存在一定关系[4]。在本研究中我们发现治疗前WT组较突变型组HBeAg水平明显偏高,这与之前的研究是相符合的[13, 17]。但是对于PC和BCP区相关变异对Peg-IFNα治疗应答的影响依然存在争议。Sonneveld等[5]的一项回顾性研究提示PC和/或BCP区突变型HBeAg阳性CHB患者很难获得对Peg-IFNα的治疗应答,从而提出治疗前WT患者可以作为Peg-IFNα的最适治疗对象,而突变型患者则不建议接受Peg-IFNα治疗。而我们的研究发现,不管是72周HBeAg血清转换率还是联合应答率,WT和突变型患者均未表现出显著差异。这可能是因为我们的研究对象以国内B/C基因型患者为主,而Sonneveld等[5]的研究对象以欧洲A/D基因型患者为主;且A基因型CHB患者PC/BCP突变的发生率本身较低。因此人种和基因型的差异可能造成了CHB患者对Peg-IFNα不同治疗应答的结局,而PC/BCP区相关变异与Peg-IFNα应答可能并不存在相关性。

Figure 5. Relationship between WT and mutant groups and response at week 72 in total cohort (A) and response between each group (B). Combined response was defined as HBeAg serconversation and HBV DNA<2 000 IU/mL at week 72.
图5PC区和BCP区突变与72周患者应答效果的关系
当我们根据患者治疗时HBeAg基线滴度由低到高分为4组分析时,我们发现72周4组HBeAg血清转换率和联合应答率的差异均不存在统计学显著性,但HBeAg低滴度组似乎有着更高的联合应答率,这仍然有待扩大样本量进一步验证。有趣的是我们发现,突变型患者较WT有着更高的ALT基线水平。这可能是因为PC/BCP区突变可能导致Toll样受体2(Toll-like receptor 2,TLR2)高表达[18],而TLR2为炎症介导因子,此时高ALT水平可能预示着患者体内肝细胞炎症应答活跃,干扰素可能也更易发挥作用。这可能与本研究中突变型患者应答略好于WT存在一定关系。这样的发现仍需要进一步验证。
我们对72周测序成功的患者突变情况分析发现,患者基线和72周时WT、PC突变型、BCP突变型和PC+BCP突变型所占构成比发生明显变化,存在向BCP突变型和PC+BCP突变型集中的趋势,而突变型在72周时未发生向WT逆转。这可能提示了HBV准种在Peg-IFNα介导的机体免疫压力下的自然选择过程。Nie等[19]研究发现在自发HBeAg血清转换过程中PC/BCP变异是累计增高的,这与Peg-IFNα介导的突变位点改变是相似的。HBV准种的动态变化为今后的抗病毒治疗也提供了新的思路。
本研究依然存在一些缺陷,普通测序技术对样本中低于20%以下的突变株较难检测[20],这可能对实验结果产生影响。这有待更灵敏的实验技术来验证我们的观点。
综上所述,通过本研究我们发现HBV病PC区G1896A和BCP区A1762T/G1764A变异与B/C基因型为主的HBeAg阳性CHB患者Peg-IFNα-2b治疗应答并无明显关系。若国内根据PC/BCP变异与否判断患者Peg-IFNα疗效可能会产生偏差;对于患者治疗前后HBV病毒PC/BCP变异构成比发生改变这一现象,尚需进一步的覆盖宿主、病毒和治疗方案的多方面分层研究,从而对CHB抗病毒治疗做出更加详细可靠的分析,以达到个体化治疗的目的。
