FAM3C通过激活Akt 促进口腔鳞癌细胞活力*
2019-03-21迟毓婧禹祎萌刘爱禹郁卫东
迟毓婧,李 玫,禹祎萌,刘爱禹,郁卫东,莫 珩
(北京大学人民医院 1中心实验室和临床分子生物学研究所, 2口腔科, 北京 100044)
口腔鳞状细胞癌(oral squamous-cell carcinoma, OSCC)是常见的肿瘤,占口腔恶性病变的95%,近二十年其发病率不断上升[1],尤其是在年轻患者中,全球每年新增病例超过30万,尽管近年来对于OSCC的诊断和治疗有实质性进步,但其5年生存率仍然仅为50%[2]。因此亟待找出新的治疗靶点对OSCC进行特异性的干预,以其提高OSCC患者的生存率。
FAM3(family with sequence similarity 3)家族是2002年克隆的一个细胞因子样基因家族,包括4个成员:FAM3A (FAM3, member A)、FAM3B (FAM3, member B)、FAM3C (FAM3, member C)和FAM3D (FAM3, member D)。FAM3C也被称作白细胞介素样上皮-间充质转化诱导因子(interleukin-like epithelial-mesenchymal transition inducer, ILEI),在人和小鼠全身多种组织中高度表达[3]。目前的研究报道,FAM3C作为一种新型的上皮-间充质转化(epithelial-mesenchymal transition,EMT)及转移的调控分子,在结肠癌[4]、胰腺癌[5]和食管鳞状细胞癌[6]等的发生发展过程中起重要作用。
最新的研究结果显示,FAM3C在患者OSCC组织中呈现高表达,并且与患者的不良预后密切相关[7],但目前对于FAM3C参与OSCC发生发展的具体机制尚未有研究报道。蛋白激酶B (protein kinase B,Akt)已被认为是一种重要的原癌基因,在多种肿瘤,尤其是低分化肿瘤中存在Akt的激活,并具有更高的转移风险和更差的预后[8]。本课题组既往研究发现在小鼠肝脏及肝细胞中过表达FAM3C能显著激活Akt[9-10]。FAM3C是否也能通过激活Akt参与OSCC的增殖仍然未知。本文分别在口腔鳞癌癌前病变细胞DOK和口腔鳞癌细胞WSU-HN6中,初步探究FAM3C的表达变化及其影响OSCC细胞活力的机制,以期为OSCC的临床诊疗提供参考资料。
材 料 和 方 法
1 主要仪器和试剂
实时定量PCR仪和酶标仪(Bio-Red);凝胶成像仪(GE);CO2细胞培养箱(Thermo)。胎牛血清(Corning);高糖DMEM培养液、0.25%胰蛋白酶、青霉素及链霉素(Gibco);细胞活力检测试剂盒(Cell Counting Kit-8, CCK-8; Dojindo);高效真核转染试剂Vigofect(北京威格拉斯生物技术有限公司);TRIzol和cDNA逆转录试剂盒(Thermo);实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)试剂盒(TOYOBO);PCR引物购自上海生工生物股份有限公司;蛋白裂解液、蛋白酶抑制剂、磷酸酶抑制剂和PMSF(北京普利莱基因技术有限公司);BCA蛋白浓度测定试剂盒、蛋白marker和化学发光试剂盒(Thermo);硝酸纤维素膜(Pall);抗FAM3C抗体(Abcam);抗p-Akt和Akt抗体(Cell Signaling Technology);抗β-actin抗体、辣根过氧化物酶标记山羊抗兔IgG及辣根过氧化物酶标记山羊抗小鼠IgG(中杉金桥)。DOK口腔癌前病变细胞系和WSU-HN6口腔鳞癌细胞系由北京大学口腔医院提供。
2 主要方法
2.1细胞培养及处理 口腔鳞癌癌前病变细胞系DOK和口腔鳞癌细胞系WSU-HN6使用添加青霉素、链霉素及10%胎牛血清的高糖DMEM培养液进行常规培养,细胞传代使用0.25%的胰蛋白酶消化。WSU-HN6细胞使用抗FAM3C抗体(2.5 mg/L)处理(WSU-HN6+anti-FAM3C),对照(WSU-HN6+solvent)组使用抗体溶剂处理,24、48和72 h后进行CCK-8实验检测细胞活力,并提取细胞的总RNA及总蛋白进行后续实验。DOK细胞分别使用感染复数(multiplicity of infection,MOI)=50的绿色荧光蛋白(green fluorescent protein,GFP)腺病毒(adenovirus-GFP,Ad-GFP)和FAM3C腺病毒(adenovirus-FAM3C, Ad-FAM3C)腺病毒处理细胞,24、48和72 h后进行CCK-8实验检测细胞活力,并提取细胞的总RNA及总蛋白进行后续实验。
2.2siRNA细胞转染 WSU-HN6细胞分别转染对照(WSU-HN6+scramble)和FAM3CsiRNA(WSU-HN6+siFAM3C),转染前1 h更换新鲜培养液,首先将4条siRNA的混合物(50 nmol/L)与生理盐水混合5 min,同时将转染试剂(Vigofect)与生理盐水混合5 min,之后将2种混合15 min后逐滴加入到6孔板或96孔板中,转染4 h后更换为新鲜培养液,在转染后24、48和72 h后进行CCK-8检测细胞活力,并提取细胞的总RNA及总蛋白进行后续实验。siRNA序列见表1。
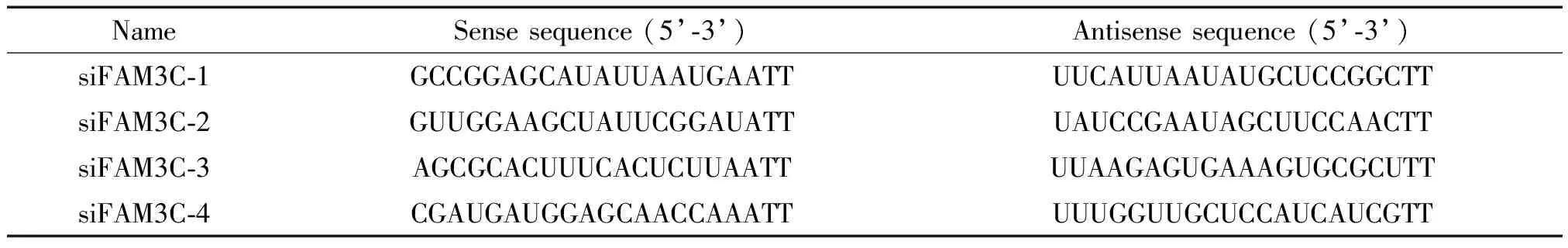
表1 siFAM3C序列
2.3CCK-8法检测细胞活力 DOK和WSU-HN6细胞各取3×103个细胞种植在96孔板中,每孔加入100 μL培养液,分别在不同处理的0、24、48及72 h更换培养液并加入10 μL的CCK-8试剂,培养2 h后,使用酶标仪在450 nm处进行吸光度(A)值的测定,每种处理重复4次,设置3个复孔,以A值为纵坐标,处理时间为横坐标绘制生长曲线。
2.4RT-qPCR 每孔细胞使用1 mL RNA裂解液(TRIzol)提取细胞总RNA,测定总RNA浓度后,使用逆转录试剂盒反转录2μg的cDNA。使用含有SYBR Green 1荧光染料的PCR混合物进行实时定量荧光PCR,以β-actin作为内参照,引物序列见表2。依据公式2-ΔΔCt法计算FAM3C mRNA的相对表达量。

表2 RT-qPCR引物序列
2.5Western blot实验 每孔细胞加入60 μL蛋白裂解液,15 520×g离心15 min后取上清,使用BCA蛋白浓度测定试剂盒测定细胞总蛋白的浓度。使用40 μg的细胞总蛋白进行SDS-PAGE,电泳完毕后将蛋白转移到硝酸纤维素膜上,5%奶粉室温封闭1 h后加入抗FAM3C、p-Akt(Ser473)、Akt及β-actin抗体,4 ℃过夜。第2天孵育Ⅱ抗,采用化学发光法检测目的蛋白的表达,ImageJ软件分析结果。
3 统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,使用t检验进行两组间比较,以P<0.05为差异有统计学意义。
结 果
1 口腔鳞癌细胞中FAM3C的表达上调
与癌前病变DOK细胞相比,WSU-HN6细胞中FAM3C mRNA表达显著升高(P<0.05),见图1A。在WSU-HN6细胞中FAM3C的蛋白表达水平也较DOK细胞显著升高(P<0.01),同时FAM3C的下游分子p-Akt蛋白水平显著上调(P<0.01),总Akt蛋白的表达水平无显著差异,见图1B。
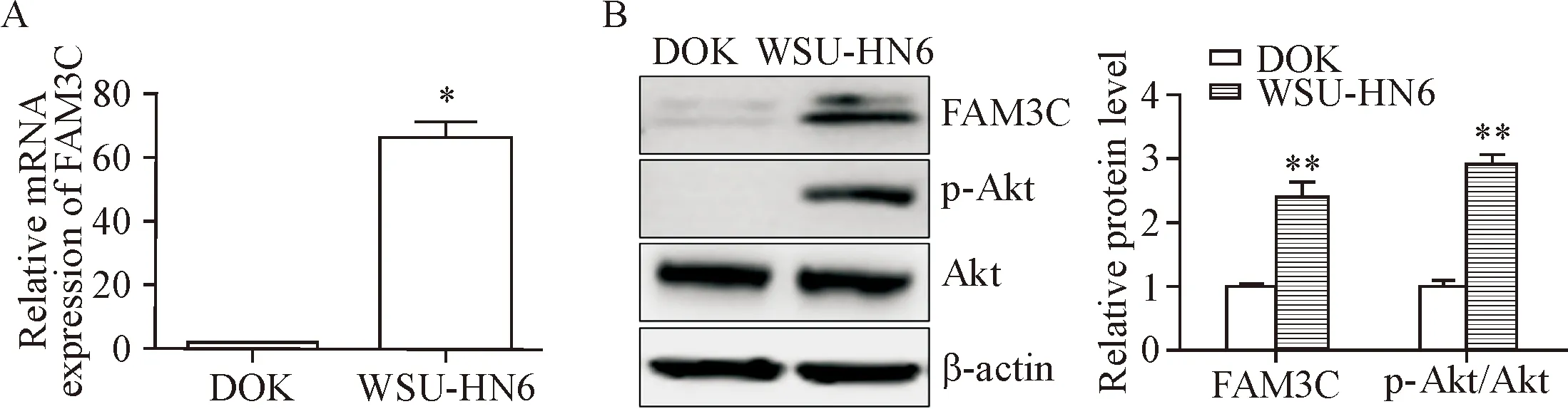
Figure 1.The mRNA and protein expression of FAM3C and the phosphorylation of Akt in DOK and WSU-HN6 cells. A: the mRNA expression of FAM3C in DOK and WSU-HN6 cells; B: the protein expression of FAM3C and p-Akt in DOK and WSU-HN6 cells. Mean±SD.n=4.*P<0.05,**P<0.01vsDOK group.
图1DOK与WSU-HN6细胞中FAM3CmRNA及蛋白表达水平和Akt磷酸化水平
2 siRNA敲减FAM3C抑制WSU-HN6细胞的活力
WSU-HN6细胞在siFAM3C处理24、48和72 h,FAM3C的mRNA表达均显著下调(P<0.01),见图2A。与对照(WSU-HN6+scramble)组相比,siFAM3C处理(WSU-HN6+siFAM3C)组WSU-HN6细胞的活力在48 h和72 h显著受到抑制(P<0.05),见图2B。siFAM3C处理后24、48和72 h,FAM3C蛋白表达水平下降,p-Akt蛋白的表达显著受到抑制(P<0.01),但总Akt的蛋白表达没有变化,见图2C。
3 抗体封闭FAM3C蛋白抑制WSU-HN6细胞的活力
与溶剂处理的对照(WSU-HN6+solvent)组相比,FAM3C抗体(WSU-HN6+anti-FAM3C组)在48 h和72 h可以显著抑制WSU-HN6细胞的活力(P<0.05),见图3A;FAM3C抗体处理24、48和72 h均能显著抑制p-Akt蛋白的表达(P<0.05),但对总Akt的蛋白表达没有影响,见图3B。
4 腺病毒介导过表达FAM3C促进DOK细胞的活力
DOK细胞过表达FAM3C(DOK+Ad-FAM3C)24、48和72 h后,FAM3C的mRNA水平均上调(P<0.05),见图4A。与对照(DOK+Ad-GFP)组相比,过表达FAM3C(DOK+Ad-FAM3C)可以在48 h和72 h显著促进DOK细胞的活力(P<0.05),见图4B,并在24、48和72 h促进p-Akt蛋白的表达(P<0.05),但对总Akt的蛋白表达没有影响,见图4C。
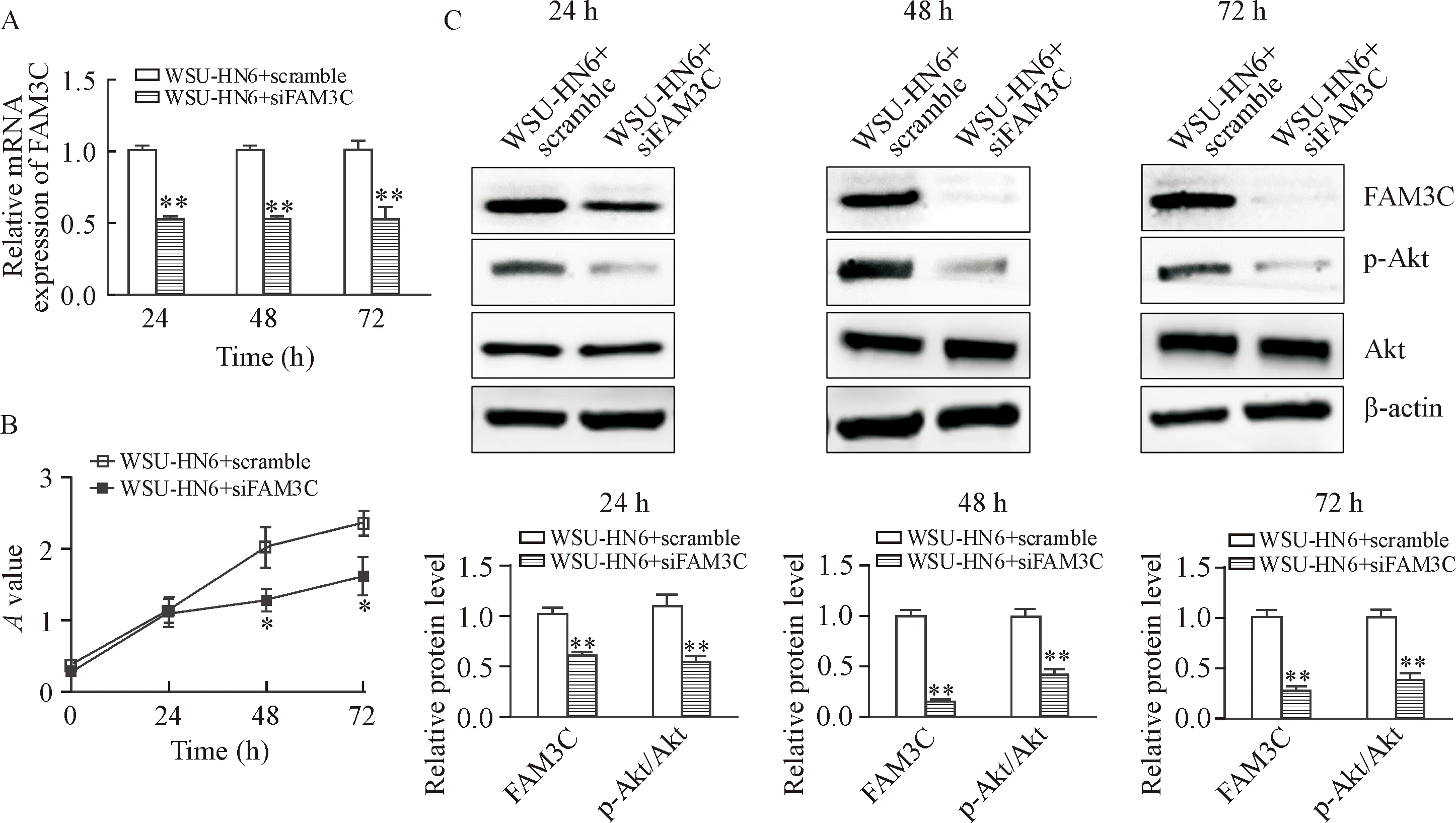
Figure 2.siRNA-mediatedFAM3Cknockdown (siFAM3C) inhibited the viability of WSU-HN6 cells. A: RT-q PCR was used to detected the FAM3C mRNA expression after siFAM3C treatment for 24, 48 and 72 h; B: WSU-HN6 cell viability detected by CCK-8 assay; C: FAM3C, p-Akt and Akt protein expression after siFAM3C or scramble treatment for 24, 48 and 72 h. Mean±SD.n=4.*P<0.05,**P<0.01vsWSU-HN6+scramble group.
图2siRNA敲减FAM3C抑制WSU-HN6细胞的增殖
Figure 3.FAM3C antibody (anti-FAM3C) inhibited WSU-HN6 cell viability. A: WSU-HN6 cell viability detected by CCK-8 assay; B: FAM3C, p-Akt and Akt protein expression in WSU-HN6 cells after anti-FAM3C or solvent treatment for 24, 48 and 72 h. Mean±SD.n=4.*P<0.05,**P<0.01vsWSU-HN6+solvent group.
图3抗体封闭FAM3C蛋白抑制WSU-HN6细胞的活力
讨 论
本项工作比较了癌前病变细胞DOK和口腔鳞癌细胞WSU-HN6中FAM3C的mRNA 和蛋白的表达水平,并检测到在口腔鳞癌细胞WSU-HN6中FAM3C的mRNA和蛋白的表达水平均显著高于癌前病变细胞DOK,这一结果与最新研究观察到在患者OSCC组织中FAM3C的表达显著高于正常黏膜及上皮异常增生组织一致[7]。此外在乳腺癌、肝癌和胃癌中,也有研究报道FAM3C在患者的肿瘤组织中呈现高表达,并且与患者预后不良密切相关[11-13]。由此可见FAM3C表达的增加可能与OSCC的发生及发展相关。
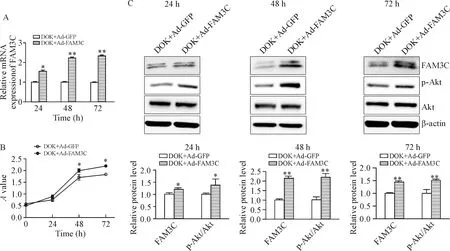
Figure 4.Adenovirus-mediated FAM3C overexpression (Ad-FAM3C) promoted DOK cell viability. A: RT-qPCR was used to detected the FAM3C mRNA expression after FAM3C overexpression for 24, 48 and 72 h; B: DOK cell viability detected by CCK-8 assay; C: FAM3C, p-Akt and Akt protein expression after Ad-FAM3C or Ad-GFP treatment for 24, 48 and 72 h. Mean±SD.n=4.*P<0.05,**P<0.01vsDOK+Ad-GFP group.
图4腺病毒介导过表达FAM3C促进DOK细胞的活力
细胞活力异常是导致OSCC发生的一个重要的原因[14]。本研究在高表达FAM3C的WSU-HN6细胞中使用siFAM3C抑制FAM3C mRNA的表达,在处理48 h后细胞的活力显著被抑制,同时使用抗FAM3C的抗体处理得到了同样的结果;而在低表达FAM3C蛋白的DOK细胞中使用FAM3C腺病毒过表达能显著提高细胞活力,提示FAM3C可能通过调控细胞活力参与OSCC的发生和发展。另有研究报道在非转移性的乳腺上皮细胞EpC40中,过表达FAM3C可促进肿瘤细胞的生长[15],并可诱导其EMT过程[16-18]。在乳腺癌和黑色素瘤细胞中下调FAM3C的表达能显著抑制肿瘤的侵袭和EMT[19]。
本研究中,敲减FAM3C在抑制OSCC细胞活力的同时也能抑制Akt的激活,而过表达FAM3C则能显著激活Akt。已有文献报道,在OSCC患者中,均存在p-Akt水平升高[20-21], 及其与OSCC预后不良呈正相关[20]。中国汉族人群Akt1基因点突变位点与OSCC的发病率及生存率有关[22]。p-Akt通过磷酸化调控下游cyclin D1、细胞凋亡蛋白Bad、细胞周期蛋白依赖激酶抑制剂p21Cip1等的表达参与调控细胞增殖、生长和生存等多种进程[23], 由此推测FAM3C可能通过激活Akt提高OSCC细胞活力。在胃癌细胞系中,敲减FAM3C不能影响胃癌细胞活力,但是却能激活Akt并抑制细胞的迁移及EMT过程[13],在肾小管细胞系HK2中也观察到FAM3C可能通过Akt诱导EMT[24]。对于FAM3C是如何激活Akt,本课题组既往研究观察到FAM3C可能通过热休克转录因子1(heat shock transcription factor 1,HSF1)-钙调蛋白(calmodulin,CaM)激活Akt调控肝脏的糖脂代谢[9-10],而对于FAM3C在OSCC发生和发展过程中参与到Akt所调控的具体事件,尚待深入研究。
目前对FAM3C在OSCC中的研究,仅为其在OSCC患者组织中表达上调及与患者预后的相关性[7],尚未见FAM3C参与OSCC的具体机制研究。本研究首次观察到FAM3C可能通过激活Akt促进OSCC细胞活力,可能是OSCC发生及发展的原因之一。本研究可能为今后OSCC的临床诊疗及提高OSCC的生存率提供了新参考资料。
