绿原酸改善db/db小鼠血管内皮功能障碍的作用初探*
2019-03-21杨艳秋刘家欣李文章王沛坚
杨艳秋,刘 森,王 丹,刘家欣,李文章,王沛坚△
(成都医学院第一附属医院 1科技部, 2心血管内科, 3衰老与血管稳态四川省高等学校重点实验室, 四川 成都 610500)
基于对血管的损害,糖尿病(diabetes mellitus,DM)可导致心脑血管并发症的发生与发展。流行病学数据表明,约70%~80%的DM患者最终死于相关的心脑血管并发症[1]。DM损害心脑血管系统的机制涉及氧化应激、肾素-血管紧张素-醛固酮系统激活、炎症、晚期糖基化终产物堆积及DNA和组蛋白甲基化在内的表观遗传途径等[2]。EMPA-REG OUTCOME研究结果发布之前的ACCORD、ADVANCE、UKPDS和VADT等研究均未证实降糖治疗能显著改善DM患者的心脑血管预后,钠-葡萄糖协同转运体2(sodium-glucose linked transporter 2,SGLT-2)抑制剂恩格列净为DM患者降低心脑血管风险,改善预后带来了希望,但仍存在一定的争议[3-5]。
DASH饮食和地中海饮食等研究探索了饮食和生活方式对心脑血管疾病的作用[6]。绿原酸(chlorogenic acid,CGA)主要来源于我国传统中药金银花和杜仲,此外,咖啡豆中也含有丰富的CGA[7]。近年大量关于CGA的研究表明其具有广泛的药理活性,基于其抗氧化和抗炎等作用,CGA在抗肿瘤、抗菌、调脂、降压、降糖及保护心血管系统等方面展现了显著的作用[8]。鉴于CGA对血糖的影响、抗氧化应激的活性及其对血管活性的调节作用,我们推测CGA可改善DM相关的血管内皮功能障碍。为此,我们利用肥胖型2型DMdb/db小鼠观察饮食中添加CGA对DM血管内皮功能障碍的影响,并初步分析其机制。
材 料 和 方 法
1 实验动物与分组处理
雄性db/db小鼠(6周龄,12只)购于南京大学模式实验动物中心,合格证编号为SCXK(苏)018-0008,分为对照(control)组(给予普通饲料喂养)和CGA膳食干预(CGA)组(饲料中含0.02% CGA)[9],每组6只小鼠,实验开始前,先进行适应性饲养1周,实验开始后的每周均观察空腹血糖、体重和鼠尾血压,观察的周期为12周。实验结束时在以4%水合氯醛麻醉后颈动脉取血,分离胸主动脉进行相关实验。动物实验符合成都医学院第一附属医院实验动物伦理委员会相关章程的要求。
2 主要试剂和仪器
绿原酸(纯度≥98%;Cayman);二氢乙啶(dihydroethidium, DHE)、4,5-二氨基荧光素二乙酸酯(4,5-diaminofluorescein diacetate,DAF-2 DA)、苯肾上腺素(phenylephrine,PE)、硝酸甘油(nitroglycerin,NTG)和乙酰胆碱(acetylcholine,ACh)等试剂均购于Sigma;测定血红素氧合酶-1(heme oxygenase-1,HO-1)、过氧化氢酶(catalase,CAT)、醌NADP(H)脱氢酶1[NAD(P)H dehydrogenase quinone 1,NQO1]和谷胱甘肽过氧化物酶1(glutathione peroxidase-1,GPx-1)的试剂盒购于南京建成生物工程研究所;抗内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)、p-eNOS、磷酸化的AMP活化蛋白激酶(phosphorylated AMP-activated protein kinase,p-AMPK)、过氧化物酶体增生物激活受体α(peroxisome proliferator-activated receptor-α,PPARα)、核因子E2相关因子2(nuclear factor E2-related factor 2, Nrf2)、P22phox和P47phox抗体均购于Santa Cruz。620M微血管张力测定仪(Wire Myograph System;DMT);BP-98A小鼠无创血压计(Softron);血糖仪及血糖试纸(美国强生)。
3 主要方法
3.1血液标本的处理 颈动脉取EDTA抗凝血,3 000 r/min 离心15 min 后取血浆以ELISA 法测HO-1、CAT、NQO1和GPx-1水平,具体操作按试剂盒说明书进行。
3.2超氧阴离子的DHE染色观察 参照既往方法[10],按说明书以DMSO溶解DHE配制成0.01 mmol/L的母液,4 ℃避光保存。临用前于Krebs溶液中稀释成工作液,37 ℃孵箱中避光染色30 min,用Krebs溶液清洗3次,在荧光显微镜下观察拍照。Krebs液组成(mmol/L):NaCl 119, KCl 4.7, CaCl22.5, MgSO41.2, KH2PO41.2, NaHCO325, glucose 11.1, pH 7.35~7.45。
3.3NO的DAF-2 DA染色观察 参照DHE染色液的配制方法,在干预后的血管内皮细胞中加入终浓度为5 mmol/L的DAF-2 DA, 37 ℃避光孵育30 min。用Krebs液清洗3次后在荧光显微镜下观察拍照。
3.4胸主动脉血管功能的测定 参照既往建立的方法[10],观察用PE预收缩后,ACh介导的血管内皮依赖性舒张反应和NTG介导的非内皮依赖性舒张反应。计算方法:舒张反应(%),某一药物浓度所引起的最大舒张幅度与血管收缩剂引起的最大收缩幅值之比值,以百分比表示。将数据输入GraphPad Prism 5.0软件,制作拟合曲线,通过软件计算最大舒张反应(Emax)进行比较。
3.5Western blot 分析相关蛋白分子的表达 参照既往建立的方法[11],以Bradford法进行蛋白定量后进行Western blot操作,检测p-AMPK、Nrf2、PPARα、eNOS、p-eNOS、P22phox和P47phox的蛋白水平。
4 统计学处理
用SPSS 16.0统计分析软件进行数据处理和统计分析。动物实验数据用均数±标准误(mean±SEM)表示,两组间比较采用t检验。以P<0.05有统计学意义。所有统计结果均使用GraghPad Prism 5.0软件作图。
结 果
1 CGA对小鼠血糖及体重的影响
与control组比较,CGA组在第11周末开始,体重及空腹血糖均显著降低(P<0.05), 这种情况在12周末实验结束时依然延续(P<0.01或P<0.05),见图1。
Figure 1.The effects of CGA on the changes of body weight and fasting blood glucose in thedb/dbmice. Mean±SEM.n=6.*P<0.05,**P<0.01vscontrol group.
图1CGA对db/db小鼠体重及空腹血糖的影响
2 CGA对db/db小鼠血浆HO-1、CAT、NQO1和GPx-1水平的影响
以ELISA法观察了膳食CGA对db/db小鼠血浆中机体抗氧化酶的影响,结果发现CGA显著增加db/db小鼠血浆中HO-1、CAT、NQO1和GPx-1的水平(P<0.05 或P<0.01),见图2。

Figure 2.The effects of CGA on the plasma levels of HO-1, CAT, NQO1 and GPx-1 in thedb/dbmice. Mean±SEM.n=6.*P<0.05,**P<0.01vscontrol group.
图2CGA对db/db小鼠血浆HO-1、CAT、NQO1和GPx-1水平的影响
3 CGA对db/db小鼠血管内膜超氧阴离子及NO的影响
DHE染色发现,给予12周饮食CGA干预的db/db小鼠血管内膜中的超氧阴离子水平显著低于control组(P<0.01);DAF-2 DA染色发现,与control组比较,CGA可显著增加db/db小鼠血管内膜中NO水平(P<0.01),见图3。

Figure 3.The effects of CGA on superoxide anion and NO levels in endothelium ofdb/dbmice aorta. A: CGA administration decreased superoxide anion (red) level in thedb/dbmice aorta; B: dietary CGA increased NO (green) levels indb/dbmouse endothelium. Mean±SEM.n=6.**P<0.01vscontrol group.
图3CGA对db/db小鼠胸主动脉内膜超氧阴离子及NO水平的影响
4 CGA对db/db小鼠血压及血管内皮功能的影响
鼠尾血压监测提示,与control组小鼠比较,CGA干预未能显著降低小鼠的血压水平。但离体血管功能评价显示,CGA干预后可显著改善db/db小鼠胸主动脉乙酰胆碱诱导的血管内皮依赖性舒张功能,对硝酸甘油诱导的非内皮依赖性舒张功能无显著影响,见图4。

Figure 4.The effects of CGA on the blood pressure and vasorelaxation in thedb/dbmice. A and B: the effects of CGA on systolic blood pressure (SBP) and diastolic blood pressure (DBP) after 12 weeks of administration; C and D: dietary CGA improved ACh-induced endothelium-dependent relaxation but not endothelium-independent relaxation. Mean±SEM.n=6.*P<0.05,**P<0.01vscontrol group.
图4CGA对db/db小鼠血压及血管功能的影响
5 CGA对血管组织相关分子表达的影响
以Western blot 检测了2组小鼠胸主动脉组织中p-AMPK、Nrf2、PPARα、eNOS、p-eNOS、P22phox和P47phox的蛋白水平,结果显示,与control组比较,CGA可上调胸主动脉PPARα、Nrf2、p-AMPK和p-eNOS的蛋白水平,降低P22phox和P47phox的蛋白水平(P<0.05或P<0.01),见图5。
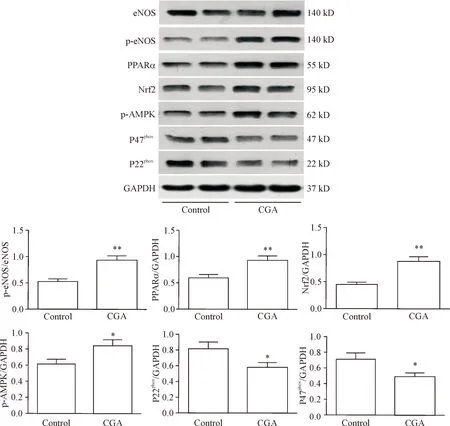
Figure 5.Effects of CGA on related protein expression indb/dbmice aorta. Mean±SEM.n=3.*P<0.05,**P<0.01vscontrol group.
图5CGA对db/db小鼠胸主动脉组织相关分子表达的影响
讨 论
在本研究中,我们以目前最常用的肥胖型DM小鼠观察CGA对DM血管内皮功能障碍的作用及对相关机制进行了初步的探索,结果发现在饮食中添加CGA可显著降低体重及空腹血糖,增加血浆中抗氧化物酶的水平,减少血管内膜超氧阴离子的生成,增加NO水平,改善血管内皮依赖性舒张功能。Western blot实验结果发现CGA可增加血管组织中PPARα、Nrf2和p-AMPK等信号通路分子蛋白的表达。
既往研究发现CGA可显著改善高血压患者的血管内皮功能、保护脑的缺血再灌注损伤[7, 12-13],但对DM相关血管内皮功能障碍的作用及相关的机制未见有相关的研究报道。在本研究中,我们发现CGA可显著改善db/db小鼠血管内皮依赖性舒张功能,但对血压无显著的降低作用。基于其对氧化应激水平的影响,我们推测其改善血管内皮功能的作用与其抗氧化的作用有关。
有研究表明,CGA可显著上调肝脏中PPARα表达水平从而增加脂肪酸的利用,改善脂质代谢,减轻非酒精性脂肪肝,降低心血管风险[14]。敲除PPARα的小鼠血管内皮功能受损,而氧自由基清除剂tempol可显著修复内皮功能,提示PPARα的缺失导致的血管内皮功能障碍归因于氧化应激[15],提示PPARα可能为CGA改善DM血管内皮功能障碍的作用靶点。
在急性肝损伤中,CGA可显著上调Nrf2的表达,从而减轻急性肝脏损害[16]。而在既往的研究中,Nrf2被认为是治疗DM相关心脑血管并发症的一个重要靶点[17]。另有研究表明,在DM模型中,CGA通过激活AMPK通路具有抗DM和相关肢体缺血的作用,但具体机制仍不明确[18]。根据目前的研究,我们以CGA干预db/db小鼠后,获取血管组织,以Western blot观察了CGA对血管组织中上述分子表达的影响,结果发现CGA可显著上调PPARα、Nrf2和AMPK的蛋白水平,同时下调P22phox和P47phox的表达。为此,我们初步认为CGA改善DM血管内皮功能的作用与其抗氧化应激有关,在分子机制层面上,我们认为可能与PPARα、Nrf2和AMPK有一定的联系。
综上,本实验证实了CGA通过减轻氧化应激水平,改善血管内皮功能的效应。虽然利用血管组织观察到CGA对PPARα、Nrf2和AMPK的作用,且在既往的研究中,PPARα、Nrf2和AMPK三者间亦存在密切的联系[19-20],但上述信号分子在CGA改善DM相关血管内皮功能障碍中是否有密切的联系,仍需结合细胞实验及相关的基因敲除动物实验进一步证实。
