敲减FGFR1基因表达对婴幼儿血管瘤内皮细胞生物学特性的影响*
2019-03-21钱丽娟李忠堂
徐 南,徐 杰,李 函,钱丽娟,李忠堂
(1东南大学附属中大医院无锡分院儿科, 江苏 无锡 214011; 2东南大学附属中大医院儿科, 江苏 南京 210009)
血管瘤是一种常发生于婴幼儿的良性肿瘤,主要的病理表现为血管的恶性形成,生物学特点表现为血管瘤内皮细胞(hemangioma endothelial cells, HemECs)的异常增生,具有明显的增生期和退化期[1-2]。虽然部分血管瘤可自行消退,但仍有部分血管瘤未退化并可进行可持续生长;一些血管瘤生长部位特殊,可引起毁容和破溃等,具有一定的危险性并影响局部器官功能。目前血管瘤的临床治疗具有多种治疗方法,但对于血管瘤的生长分子机制尚不清楚。研究表明,在血管瘤快速增生期,可能由于HemECs内部分基因的突变,从而激活相应的信号通路,从而促进HemECs大量快速生长和增殖,而血管瘤消退的主要原因是HemECs的凋亡增加和分化、转移[3-5]。成纤维细胞生长因子受体1(fibroblast growth factor receptor 1,FGFR1)在血管生长过程中发挥重要作用[6]。 因此,本文通过RNA干扰技术敲减体外培养的HemECs细胞中FGFR1基因的表达,分析其表达量对HemECs细胞生物学特点的影响,为理解婴幼儿血管瘤的病程形成机制提供实验基础。
材 料 和 方 法
1 主要实验材料
EGM-2MV培养基购自Lonza;小干扰RNA(small interfering RNA,siRNA)、Lipofectamine 2000和TRIzol购自Sigma;反转录试剂盒、荧光定量PCR(qPCR)试剂盒、细胞凋亡检测试剂盒和RIPA细胞裂解液购自上海碧云天生物研究所;Cell Counting Kit-8(CCK-8)购自日本同仁公司;Transwell小室购自Corning;Matrigel购自BD;抗磷脂酰肌醇3-激酶(phospoinositide 3-kinase,PI3K)单克隆抗体、抗蛋白激酶B(protein kinase B,AKT)单克隆抗体、抗磷酸化AKT(p-AKT)单克隆抗体和抗GAPDH单克隆抗体购自Cellular Signaling Technology;辣根过氧化物酶标记的II 抗购自武汉博士德有限公司。流式细胞仪购自BD;实时荧光定量PCR仪购自ABI;酶标仪购自Thermo。
2 方法
2.1婴幼儿血管瘤内皮细胞的分离和培养 共收集经病理鉴定的婴幼儿血管瘤6例,均获得家属知情或同意。根据参考文献[7]的技术方法分选并鉴定内皮细胞。将细胞培养于EGM-2MV培养基,放入37 ℃、5% CO2的细胞培养箱中,细胞传至2~3代时,接种至6孔板中。
2.2细胞的转染 将对数生长期婴幼儿血管瘤内皮细胞随机分为3组:对照(control)组、阴性对照siRNA(negative control siRNA, siRNA-NC)组和FGFR1 siRNA (si-FGFR1)组。根据Lipofectamine 2000说明书将siRNA-NC和si-FGFR1分别转染入HemECs,常规培养的细胞作为对照。
2.3qPCR检测FGFR1 mRNA的表达量 收集各组转染后48 h细胞,采用TRIzol提取细胞中总RNA。根据试剂说明书进行反转录和荧光定量PCR检测。FGFR1 扩增引物由Invitrogen合成,FGFR1上游引物序列为5’-CGCGGATCCATGTGGAGCTGGAAGTGCCTCCTCT-3’,下游引物序列为5’-CCGCTCGAGTCAGCGGCGTTTGAGTCCGCCATT-3’;β-actin引物上游序列为5’-GGACCTGACTGACTACCTC-3’,下游序列为5’-TACTCCTGCTTGCTGAT-3’。反应体系为50 μL,反应条件为: 95 ℃ 3 min; 95 ℃ 15 s、60 ℃ 30 s、68 ℃ 2 min, 35 个循环; 68 ℃ 10 min。结果采用2-ΔΔCt法进行计算。
2.4CCK-8法检测细胞的活力 收集各组细胞,每孔加入10 μL CCK-8,37 ℃孵育2 h,酶标仪检测570 nm的吸光度(A)值。
2.5流式细胞术检测细胞的凋亡率 调整各组细胞浓度为1×109/L,每孔加入10 μL 膜联蛋白 V-FITC(Annexin V-FITC),室温孵育15 min,离心,弃上清,加入5 μL 碘化丙啶(propidium iodide,PI),4 ℃孵育15 min,流式细胞术检测凋亡率。
2.6Transwell法检测细胞侵袭和迁移 将-80 ℃冰箱中的Matrigel置于4 ℃冰箱中融化,与300 μL无血清培养基混合均匀,吸取100 μL加入Transwell上室,37 ℃孵育5 h。收集各组细胞,制成浓度为5×108/L的细胞悬浮液, 吸取100 μL细胞悬液接种至铺有Matrigel的上室上孔,下室加入500 μL含10%胎牛血清的培养基,37 ℃孵育24 h后;姬姆萨染色,200目镜显微镜下拍照,取5个视野的平均值为细胞的侵袭数。在细胞的迁移实验中,将细胞悬浮液接种至未铺有Matrigel的上室上孔中,其余与侵袭实验相同。
2.7Western blot法检测PI3K、AKT和p-AKT的蛋白水平 收集各组细胞,调整为5×1010/L,加入100 μL现配PIPA裂解液,冰浴30 min,离心。收集上清,BCA法测定蛋白样品浓度。吸取40 mg总蛋白与等体积2×上样缓冲液混匀,沸水中变性10 min;在8% SDS-PAGE后转移至PVDF膜中,5%的脱脂奶粉封闭1 h;根据抗体说明书将抗PI3K、AKT和p-AKT抗体均以 1∶1 000稀释,4 ℃孵育过夜,TBST漂洗3次,加入 II 抗,37 ℃孵育2 h,TBST漂洗3次,避光,显色,凝胶成像仪中拍照,Quantity One分析灰度值。
3 统计学分析
SPSS 22.0软件进行统计处理。结果以均数±标准差(mean±SD)表示。多组数据间的比较采用单因素方差分析,组间多重比较使用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 转染后细胞中FGFR1的mRNA表达量
与对照组相比,siRNA-NC组细胞中FGFR1的mRNA水平的差异无统计学显著性,si-FGFR1组细胞中FGFR1的mRNA水平显著降低(P<0.05),见图1。

Figure 1.The expression of FGFR1 in the HemECs after transfection with siRNA. Mean±SD.n=3.*P<0.05vscontrol group.
图1转染后细胞中FGFR1表达量的变化
2 敲减FGFR1基因表达对HemECs活力的影响
与对照组相比,siRNA-NC组HemECs细胞活力的差异无统计学显著性,si-FGFR1组HemECs的细胞活力显著降低(P<0.05),见图2。

Figure 2.The effect ofFGFR1 expression knock-down on the viability of HemECs. Mean±SD.n=3.*P<0.05vscontrol group.
图2敲减FGFR1基因表达对HemECs细胞活力的影响
3 敲减FGFR1基因表达对HemECs凋亡的影响
与对照组相比,siRNA-NC组HemECs的凋亡率无显著差异,si-FGFR1组HemECs的凋亡率显著增加(P<0.05),见图3。
4 敲减FGFR1基因表达对HemECs迁移能力的影响
与对照组相比,siRNA-NC组迁移的HemECs数量无显著差异,si-FGFR1组迁移的HemECs数量显著降低(P<0.05),见图4。
5 敲除FGFR1基因表达对HemECs细胞侵袭的影响
与对照组相比,siRNA-NC组侵袭HemECs数量无显著差异,si-FGFR1组侵袭HemECs数量显著降低(P<0.05),见图5。
6 敲减FGFR1基因表达对PI3K、AKT和p-AKT蛋白水平的影响
与对照组相比,siRNA-NC组HemECs中PI3K、AKT和p-AKT蛋白水平的差异无统计学显著性,si-FGFR1组HemECs细胞中的AKT蛋白无显著变化,PI3K和p-AKT的蛋白水平显著降低(P<0.05),见图6。
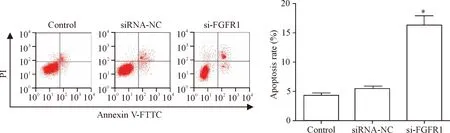
Figure 3.The effect ofFGFR1 expression knock-down on the apoptosis of HemECs. Mean±SD.n=3.*P<0.05vscontrol group.
图3敲减FGFR1基因表达对HemECs凋亡的影响

Figure 4.The effect ofFGFR1 expression knock-down on the migration ability of HemECs. Mean±SD.n=3.*P<0.05vscontrol group.
图4敲减FGFR1基因表达对HemECs迁移能力的影响

Figure 5.The effect ofFGFR1 expression knock-down on the invasion of HemECs. Mean±SD.n=3.*P<0.05vscontrol group.
图5敲减FGFR1基因表达对HemECs侵袭能力的影响
讨 论
血管瘤是一种常见的婴幼儿良性肿瘤,主要病理特征为局部杂乱无章的血管过度生成,异常的内皮细胞是其病变的主要原因。HemECs的增殖与凋亡间动态平衡的破坏是血管瘤增生期向消退期转变的主要原因,而增殖与凋亡平衡的失去主要受血管内皮生长因子和抑制因子的调节。在多种血管生成抑制剂和促进剂中,碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)是其中效率最高、特异性最强的促进血管生成因子之一,通过与受体FGFR1结合促进血管的形成,对血管的生成、内皮细胞的增殖、凋亡和侵袭过程至关重要[8-9]。FGFR1是成纤维细胞生长因子受体家族的成员之一,在血管瘤组织中的表达量上调[10]。研究表明,FGFR1在血管瘤增生期和退化期的表达量较正常对照组显著异常,提示FGFR1参与血管瘤的形成过程,与血管瘤的增生和退化显著相关[11]。
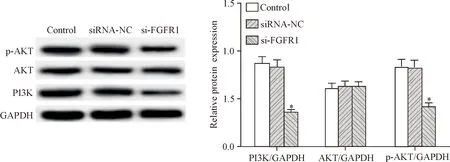
Figure 6.The effect ofFGFR1 expression knock-down on the protein levels of PI3K, AKT and p-AKT. Mean±SD.n=3.*P<0.05vscontrol group.
图6敲减FGFR1基因表达对PI3K、AKT和p-AKT蛋白水平的影响
血管瘤内皮细胞凋亡和转移在血管瘤的增生和消退期发挥重要作用。研究表明,在血管瘤消退期,细胞的凋亡率显著增加,其中1/3为内皮细胞凋亡[12]。在本实验中,通过转染靶向FGFR1的siRNA下调HemECs中FGFR1基因的表达,CCK-8法检测细胞的活力,结果发现敲减FGFR1的表达显著抑制HemECs的细胞活力,流式细胞术检测细胞的凋亡率发现敲减FGFR1表达可显著促进HemECs凋亡;Transwell法检测HemECs的迁移和侵袭能力显示,FGFR1表达量下显著降低HemECs的迁移能力,侵袭实验也表明si-FGFR1显著抑制HemECs的侵袭能力,表明FGFR1可通过调控血管瘤内皮细胞的生物学特性,从而影响血管瘤的增生和消退。
PI3K/AKT信号通路在多种肿瘤组织中发挥作用,如胃癌[13]、乳腺癌[14]和肺癌[15]等。PI3K是一个由催化亚基和调节亚基组成的异源二聚体,其介导的信号转导通路在人类肿瘤中常被异常激活,激活的PI3K可活化AKT依赖性的一系列信号通路,调节肿瘤细胞的生长、凋亡和迁移[16-19]。与其它肿瘤相同,血管瘤内也存在PI3K/AKT信号通路的异常激活。研究表明,异常激活的PI3K/AKT信号通路能显著抑制无血清培养基培养的HemECs发生自发性凋亡[20]。在体外裸鼠移植瘤的实验中显示,PI3K/AKT信号通路可能调控裸鼠移植血管瘤的增生与消退;抑制或激活PI3K/AKT信号通路促进血管瘤体的消退及增生[21]。本研究通过Western blot检测敲减FGFR1表达对HemECs中PI3K、AKT和p-AKT蛋白水平的影响,结果显示siRNA-FGFR1对AKT蛋白水平无显著影响,但可显著下调PI3K和p-AKT蛋白的水平,提示下调FGFR1可能通过影响PI3K/AKT信号通路调节HemECs的生物学特性。
综上所述,敲减FGFR1的表达可抑制婴幼儿血管瘤内皮细胞的活力,诱导其凋亡,阻碍细胞迁移和侵袭。这些作用可能与下调PI3K/AKT信号通路有关,但该信号通路以及下游靶基因参与调控内皮细胞生物学特性的机制还需进一步明确。
