丹参酮ⅡA通过AMPK介导的自噬减轻阿霉素所致H9c2心肌细胞损伤*
2019-03-21王朝华肖慧琼袁李礼
王朝华,徐 勤,肖慧琼,袁李礼
(湖南省脑科医院心内科, 湖南 长沙 410007)
阿霉素(又称多柔比星,doxorubicin,DOX)是一种蒽环类广谱抗肿瘤药物,应用于多种肿瘤的化疗方案组合,且效果显著[1],但阿霉素的心肌亲和力远高于其它器官,更易造成心肌损伤而限制其临床应用[2],因此寻找合适的心脏保护策略对抗阿霉素心肌损伤,更有利于其临床应用和疗效[3]。丹参酮ⅡA(tanshinone ⅡA,TAN)是唇形科植物丹参的一种脂溶性提取物,能够明显提高冠脉流量,改善心肌缺血缺氧,常用于临床冠心病的治疗[4]。研究报道丹参酮ⅡA同样能拮抗阿霉素诱导的心肌损伤[5],但具体机制并不明确。近年来,自噬(autophagy)在心血管疾病中的作用日益受到关注,在不同的心肌病理生理中,自噬可能是一种代偿性保护反应,也可能引起自噬性死亡[6]。丹参酮ⅡA拮抗阿霉素心肌损伤是否与自噬有关尚不明确。本实验拟通过体外研究观察丹参酮ⅡA对大鼠H9c2心肌细胞损伤、自噬和AMPK活化的影响,并利用抑制剂干预AMPK水平,从分子水平探讨丹参酮 ⅡA可能的调控机制,为其用于阿霉素心肌损伤的防治提供实验基础和理论依据。
材 料 和 方 法
1 细胞、主要试剂与仪器
大鼠H9c2心肌细胞购自上海中国科学院细胞库。DMEM培养基、磷酸盐缓冲液、胰酶、青链霉素双抗和DMSO购自Gibco;胎牛血清购自SERANA;阿霉素和丹参酮ⅡA购自上海阿拉丁生化科技股份有限公司;dorsomorphin购自Selleck;CCK-8检测试剂盒购自日本同仁化学研究所;乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒购自上海碧云天生物技术有限公司;抗LC3、AMPK、p-AMPK抗体和 II 抗购自Sigma;荧光 II 抗购自Invitrogen;BCA蛋白定量试剂盒、RIPA裂解液和多聚甲醛购自武汉谷歌生物科技公司;ECL化学发光试剂盒购自Thermo。二氧化碳培养箱购自Thermo;倒置荧光显微镜购自Olympus;酶标仪Biotek;蛋白电泳分离、转膜和成像系统购自Bio-Rad。
2 方法
2.1细胞培养 H9c2细胞用含10%胎牛血清的DMEM培养基,在37 ℃、5% CO2条件下培养。细胞融合度为80%~90%时传代 1 次,取对数生长期状态良好的细胞进行实验研究。
2.2处理试剂配制 将阿霉素、丹参酮ⅡA和dorsomorphin溶于DMSO中制成储存液避光储存于-20 ℃,再稀释成所需工作液浓度进行实验。
2.3实验分组 实验分为2个部分:(1)丹参酮ⅡA对阿霉素处理的心肌 H9c2细胞的影响:对照(control)组、丹参酮ⅡA(10 mg/L TAN)组、阿霉素(5 μmol/L DOX)组和阿霉素+丹参酮ⅡA(5 μmol/L DOX+10 mg/L TAN)组;(2)抑制AMPK后丹参酮ⅡA对阿霉素处理的心肌H9c2细胞的影响:对照(control)组、阿霉素(5 μmol/L DOX)组、阿霉素+丹参酮ⅡA(5 μmol/L DOX+10 mg/L TAN)组、阿霉素+AMPK抑制剂(5 μmol/L DOX+5 μmol/L dorsomorphin)组和阿霉素+丹参酮ⅡA组+AMPK抑制剂(5 μmol/L DOX+10 mg/L TAN+5 μmol/L dorsomorphin)组。
2.4CCK-8法测定细胞活力 将生长状态良好的H9c2细胞按每孔5×103个接种于96孔板,依照不同分组进行实验处理,48 h后每孔加入10 μL CCK-8试剂,37 ℃孵育2 h后测定490 nm的吸光度(A)值。
2.5LDH法测定细胞损伤 将生长状态良好的H9c2细胞按每孔5×103个接种于96孔板,依照不同分组进行实验处理,48 h后每孔加入10 μL LDH释放试剂,37 ℃孵育1 h,500×g离心5 min,收集细胞上清100 μL 置新96孔板中,每孔加入50 μL LDH检测工作液,室温避光孵育30 min后测定490 nm的A值。
2.6免疫荧光实验检测细胞自噬情况 将生长状态良好的H9c2细胞按每孔5×105个接种于6孔板,依照不同分组进行实验处理,48 h后用4%多聚甲醛固定10 min,并细胞穿孔、血清封闭,抗LC3抗体(1∶1 000)4 ℃孵育过夜,TBST洗膜3次,荧光 II 抗(1∶2 000)室温避光孵育1 h,TBST洗膜3次,封片后荧光显微镜观察拍照,随机选择10个视野,分析荧光强度。
2.7Western blot实验检测细胞AMPK的活化情况 将生长状态良好的H9c2细胞按每孔5×105个接种于6孔板,依照不同分组进行实验处理,48 h后用RIPA裂解液收集细胞总蛋白,BCA定量后煮沸蛋白变性。取40 μg总蛋白,10%的SDS-PAGE分离蛋白后转膜至PVDF膜,脱脂奶粉封闭1 h后,抗AMPK(1∶1 000)和p-AMPK(1∶1 000)抗体分别4 ℃孵育过夜,TBST洗膜3次,II 抗(1∶5 000)室温避光孵育1 h,TBST洗膜3次,ECL化学发光后成像系统进行图像采集及灰度分析。
3 统计学分析
SPSS 22.0软件进行数据分析,GraphPad Prism 5软件进行图形绘制。数据采用均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析(one-way ANOVA),LSD-t检验进行两两比较。以P<0.05为差异有统计学意义。
结 果
1 丹参酮ⅡA对阿霉素所致H9c2细胞损伤的影响
CCK-8法和LDH检测结果显示,与对照组相比,阿霉素作用后,H9c2细胞的活力减弱,LDH释放增多(P<0.05);丹参酮ⅡA处理能恢复H9c2细胞活力,减少LDH释放(P<0.05),见图1。
2 丹参酮ⅡA对阿霉素所致H9c2细胞自噬的影响
免疫荧光检测结果显示,阿霉素和丹参酮ⅡA单独作用后,LC3红色荧光均增多;阿霉素和丹参酮ⅡA共处理进一步增加LC3红色荧光强度(P<0.05),见图2。

Figure 1.The effects of tanshinone ⅡA (TAN) on the injury of the H9c2 cardiomyocytes induced by doxorubicin (DOX). Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsDOX group.
图1丹参酮ⅡA对阿霉素所致H9c2心肌细胞损伤的影响
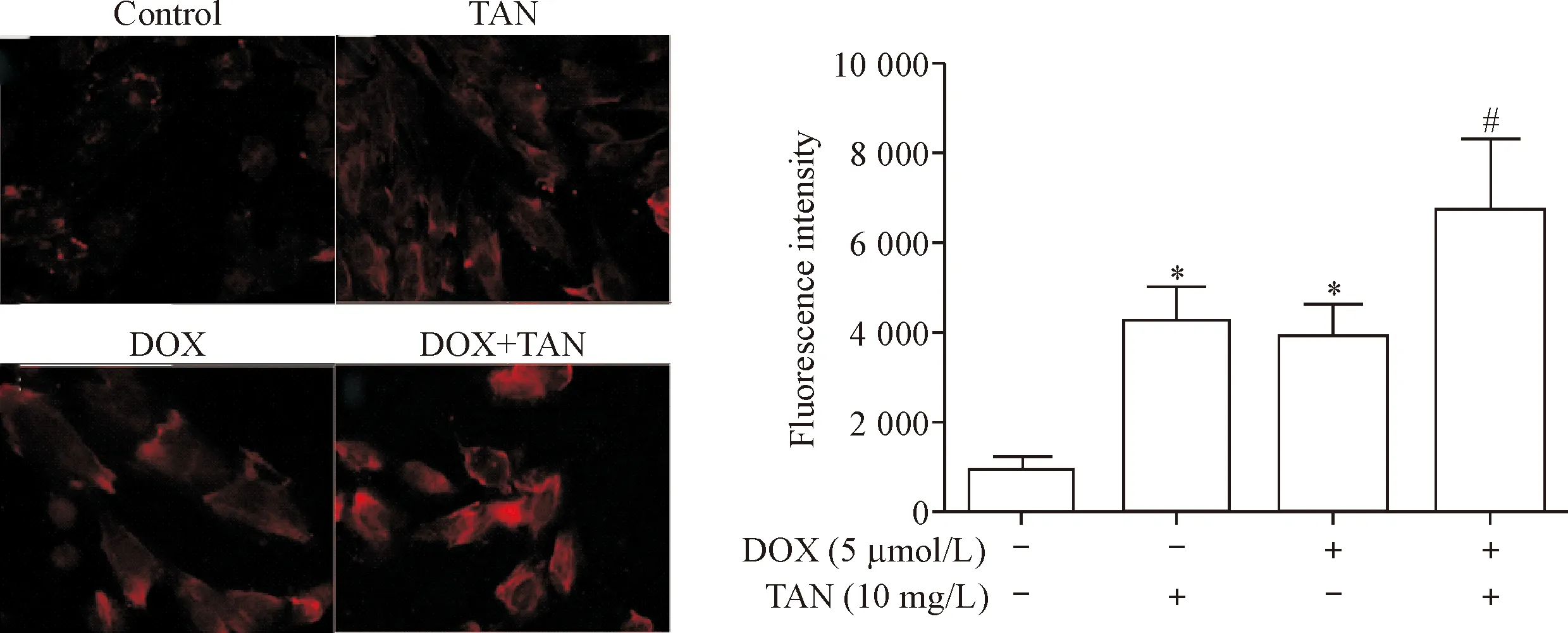
Figure 2.The effects of tanshinone ⅡA (TAN) on the autophagy in the doxorubicin (DOX)-induced H9c2 cardiomyocytes (×400). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsDOX group.
图2丹参酮ⅡA对阿霉素所致H9c2心肌细胞自噬的影响
3 丹参酮ⅡA对阿霉素所致H9c2细胞AMPK活化的影响
Western blot检测结果显示,与对照组相比,阿霉素作用后,p-AMPK/AMPK比值降低,AMPK活化被抑制(P<0.05);丹参酮ⅡA处理导致p-AMPK/AMPK比值升高,AMPK活化(P<0.05),与阿霉素组相比,丹参酮ⅡA+阿霉素组的 AMPK活化程度增加(P<0.05),见图3。

Figure 3. The effects of tanshinone ⅡA (TAN) on the activation of AMPK in the H9c2 cardiomyocytes induced by doxorubicin (DOX). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsDOX group.
图3丹参酮ⅡA对阿霉素所致H9c2心肌细胞AMPK蛋白水平的影响
4 AMPK抑制剂对丹参酮ⅡA抗阿霉素所致心肌 H9c2细胞损伤的影响
CCK-8法和LDH检测结果显示,使用AMPK抑制剂dorsomorphin后,阿霉素所致H9c2细胞的活力减弱和LDH释放增多无明显改变,差异无统计学显著性,但抑制AMPK后丹参酮ⅡA恢复H9c2细胞活力和减少LDH释放的作用减弱(P<0.05),见图4。

Figure 4.The effects of dorsomorphin on doxorubicin (DOX)-induced injury of H9c2 cardiomyocytes treated with tanshinone ⅡA (TAN). Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsDOX group;▲P<0.05vsDOX+TAN group.
图4Dorsomorphin对丹参酮ⅡA抗阿霉素所致H9c2心肌细胞损伤的影响
5 AMPK抑制剂对丹参酮ⅡA促阿霉素所致H9c2心肌细胞自噬的影响
免疫荧光检测结果显示,抑制AMPK后,阿霉素所致H9c2细胞的自噬减弱;抑制AMPK后丹参酮ⅡA促进H9c2细胞自噬的作用减弱(P<0.05),见图5。
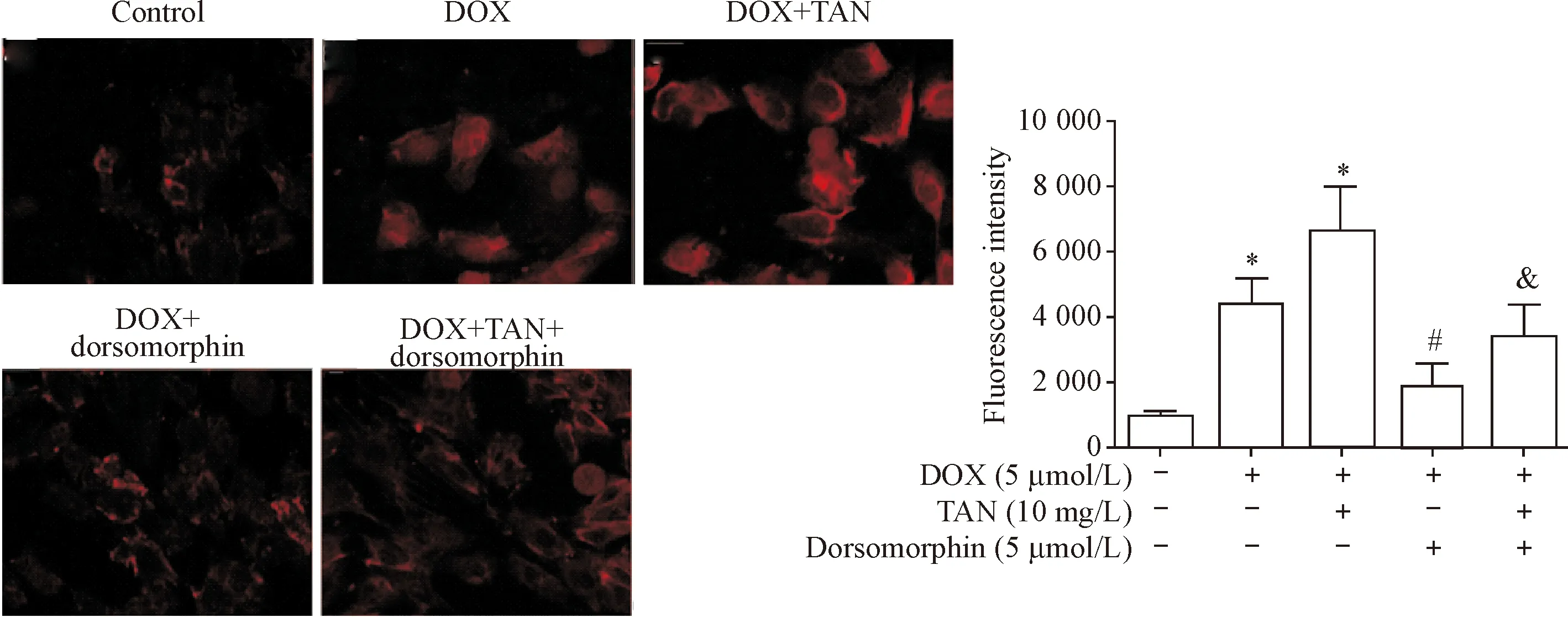
Figure 5.The effects of dorsomorphin on doxorubicin (DOX)-induced autophagy of the H9c2 cardiomyocytes with tanshinone ⅡA (TAN) treatment (×400). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsDOX group;&P<0.05vsDOX+TAN group.
图5Dorsomorphin对丹参酮ⅡA促阿霉素所致H9c2心肌细胞自噬的影响
讨 论
心肌损伤是阿霉素最常见且严重的副作用,其心肌毒性机制复杂,且尚未被完全阐明,但已知涉及氧化应激、线粒体功能障碍和细胞凋亡等[7]。丹参酮ⅡA作为传统中药丹参的提取物,应用于冠心病的辅助治疗,研究报道丹参酮ⅡA能拮抗阿霉素诱导的心肌损伤,其机制可能涉及氧化应激和凋亡等[8]。最新的研究报道自噬的异常也在阿霉素心肌损伤中发挥重要作用[9]。自噬被证实在阿霉素心脏损伤中有双重功能,一方面,自噬能通过降解受损或不需要的蛋白质和细胞器并抑制凋亡来增强细胞功能和存活[10];另一方面,自噬能诱导细胞死亡[11]。但丹参酮ⅡA的保护作用是否与自噬有关尚不清楚。
本研究利用阿霉素诱导的H9c2心肌细胞损伤模型,探讨丹参酮ⅡA对心肌细胞损伤的影响机制。阿霉素处理后H9c2细胞活力减弱,LDH释放增多,有明显损伤。LDH广泛存在于各种组织中,其中心脏和骨骼肌最为丰富。LDH在心肌细胞受损时释放入培养液,其漏出量能反映细胞损伤程度[12]。丹参酮ⅡA处理能部分恢复H9c2细胞活力,减少LDH释放,说明丹参酮ⅡA能减轻心肌细胞损伤。同时,我们检测了细胞自噬水平的变化,免疫荧光检测结果显示,阿霉素处理后H9c2细胞自噬增加,而丹参酮ⅡA处理进一步增加细胞自噬。自噬作为一个高度保守的生物学过程,近年来,其在心血管疾病中的作用日益受到关注,许多心脏疾病(如心肌肥厚、心肌疾病和缺血性心脏病)的心肌病理变化过程中都存在自噬的异常[13]。研究表明死亡的心肌细胞中常见存在大量自噬体,阿霉素心肌损伤的研究也发现自噬途径的异常激活[14],这与我们实验结果中发现的一致。丹参酮ⅡA被报道能够促进自噬抗内皮细胞氧化应激损伤[15],而本研究中发现丹参酮ⅡA同样也能促进H9c2细胞的自噬。丹参酮ⅡA可减轻阿霉素所致H9c2心肌细胞损伤,且此作用可能与诱导细胞自噬有关,其具体机制有待进一步深入研究。
AMPK是细胞能量感知和细胞信号调控的一个重要的激酶[16],其作为能量感受信号中转站,将细胞内的能量信号汇聚于哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)。磷酸化激活的AMPK可以通过磷酸化抑制mTORC1继而增强自噬[17]。 我们的结果显示阿霉素能够抑制H9c2心肌细胞AMPK的磷酸化,这与Gratia等[18]研究发现一致;而丹参酮ⅡA能诱导H9c2心肌细胞AMPK的磷酸化。本实验通过AMPK抑制剂dorsomorphin阻断AMPK激活,能够部分抑制丹参酮ⅡA诱导的自噬,进一步导致细胞活力减弱,LDH释放增多,说明丹参酮ⅡA通过AMPK信号通路上调自噬,进而减轻阿霉素所致H9c2心肌细胞损伤。
综上所述,丹参酮ⅡA可能通过调控AMPK信号通路,诱导H9c2心肌细胞自噬,发挥其减轻阿霉素心肌细胞损伤的生物学活性,进而防治阿霉素心肌毒性的发生发展。
