E-cadherin和FOXO3a在胃癌组织和细胞中表达的关系*
2019-03-21陈发帅薛长年刘世佳王梦丹马子涵孙海斌郑鹏远郭彦伟张自森
陈发帅,薛长年△,刘世佳,王梦丹,马子涵,孙海斌,郑鹏远,郭彦伟,张自森△
(郑州大学第五附属医院 1普通外科, 2肿瘤内科, 3病理科, 4消化内科, 河南 郑州 450052)
胃癌是我国常见的恶性肿瘤之一,其发病率居于第二位[1]。尽管胃癌的分子分型可有效区分胃癌患者的预后生存,但胃癌发生的分子机制尚不明确,仍需进一步研究。上皮钙黏素(E-cadherin)与胃癌发生发展关系密切,可通过调节多个信号传导通路影响胃癌细胞增殖[2]。叉头框蛋白O3a(forkhead box protein O3a, FOXO3a)是叉头转录因子家族(forkhead transcription factors)中重要成员,目前被认为是一种抑癌因子,参与了对胃癌细胞增殖调控[3]。然而,E-cadherin和FOXO3a在胃癌发生中的关系研究尚未见报道。本研究通过检测E-cadherin和FOXO3a在胃癌及癌旁组织中的表达,探讨其相关性及与临床病理特征的关系,观察E-cadherin过表达对胃癌AGS细胞活力和FOXO3a表达的影响及可能的分子机制,为胃癌的个体化治疗探索提供参考资料。
材 料 和 方 法
1 病例资料
组织标本取自郑州大学第五附属医院2014年6月~2017年12月期间的53例石蜡包埋胃癌组织及对应的癌旁组织,癌旁组织距离肿瘤组织边缘均大于5 cm。所有病例经病理诊断证实为胃腺癌,术前均未进行放疗和化疗,其中男性39例,女性14例,年龄33~83岁,中位年龄64岁,临床分期参照美国癌症联合会(AJCC)第7版TNM分期标准。本项工作经郑州大学第五附属医院伦理委员会审查通过。
2 材料
人胃癌细胞株AGS购自中国科学院上海细胞库;E-cadherin过表达细胞株AGS由上海吉凯基因科技有限公司构建的慢病毒感染完成。抗E-cadhe-rin(20874-1-AP)、FOXO3a(10849-1-AP)、Bax(50599-2-Ig)、Bcl-2(12789-1-AP)和GAPDH(10494-1-AP)抗体均购于武汉三鹰生物技术有限公司(proteintech®);抗Akt1(75692)抗体购于Cell Signaling Technology;ATP-4b(ab176992)购于Abcam;CCK-8试剂盒购自AbMole;F12K培养液购自Millipore。
3 免疫组织化学染色与结果判断
胃癌及癌旁组织均采用常规石蜡包埋,3 μm连续切片、烤干,二甲苯及梯度浓度的乙醇溶液脱蜡、脱水,用柠檬酸盐缓冲液进行抗原修复,以已知阳性标本作为阳性对照,用PBS代替Ⅰ抗作为阴性对照,实验步骤按SP试剂盒说明书进行。E-cadherin以细胞膜或细胞质内出现棕黄色颗粒为阳性表达,FOXO3a以细胞核或细胞质内出现棕黄色颗粒为阳性表达。观察阳性细胞百分比及染色强度,计数阳性细胞百分比(阴性为0,1%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分),评判阳性细胞染色强度(无阳性染色为0分,浅黄色为1分,深黄色为2分,棕黄色为3分)。最终结果以染色评分及染色细胞所占比率相乘,≤6分为阴性表达,>6分为阳性表达。免疫组化染色判断由2位病理医师通过独立双盲法判断。
4 方法
4.1细胞培养 用含10%的胎牛血清的F12K培养液(含青霉素1×105U/L和链霉素100 mg/L),在37 ℃、5%CO2条件下于培养箱中培养,细胞生长2~3 d传代1次。
4.2免疫细胞化学 胰酶消化细胞后重悬细胞于完全培养液中,充分吹打,使之成单细胞悬液,计数。以每孔1×108/L接种于6孔板上,制备细胞爬片,甲醇固定,封闭、Ⅰ抗和Ⅱ抗孵育,脱水、透明、镜检。
4.3E-cadherin过表达AGS细胞的构建与验证 构建E-cadherin过表达的长效慢病毒载体,感染AGS细胞,嘌呤霉素筛选并建立稳转株。Real-time PCR验证稳转株中E-cadherin mRNA的表达。E-cadherin的上游引物序列为5’-AACGCATTGCCACATACA-3’,下游引物序列为5’-CGGGCTTGTTGTCATTC-3’,产物114 bp。GAPDH的上游引物序列为5’-TGACTTCAACAGCGACACCCA-3’,下游引物序列为5’-CACCCTGTTGCTGTAGCCAAA-3’, 产物121 bp。反应条件: 95 ℃变性15 s, 60 ℃退火30 s, 95 ℃变性15 s。Western blot验证稳转株中E-cadherin蛋白表达。
4.4CCK-8法检测细胞活力 细胞经过消化重悬计数,取处于对数生长期的AGS细胞以及E-cadherin过表达AGS细胞,设置3个密度梯度,分别为以每孔2×106/L、5×106/L和1×107/L的密度接种于14块96孔板中,每个96孔板设6个复孔,每孔加入200 μL,分别培养12 h、24 h、48 h、72 h、96 h、120 h和144 h后,每孔加入100 μL CCK8溶液,用酶联检测仪检测490 nm波长处各孔的吸光度(A)值。
4.5Western blot检测 取对数期生长的细胞裂解并提取总蛋白。半干转膜法将蛋白转移到聚偏氟乙烯(PVDF)膜,5%脱脂牛奶封闭后用Tris-HCl缓冲液(TBST)洗净,分别加入Ⅰ抗4 ℃过夜,TBST洗后加人辣根过氧化物酶(HRP)Ⅱ抗,1 h后洗膜,增强型化学发光试剂(ECL)底物显影。
5 统计学方法
采用SPSS 19.0软件进行统计学分析。数据以均数±标准差(mean±SD)表示。计数资料数据比较采用2检验,两指标相关性采用Spearman相关分析,两样本比较采用独立样本t检验。以P<0.05为差异有统计学意义。
结 果
1 E-cadherin在胃癌及癌旁组织中的表达
E-cadherin以细胞膜或细胞质内出现棕黄色颗粒为阳性表达,见图1。E-cadherin在胃癌组织中的阳性表达率显著低于癌旁组织(P<0.01),见表1。E-cadherin阳性表达与胃癌组织分化程度和TNM有关(P<0.05),与年龄、性别、部位、T分期及淋巴结转移无关,见表2。
2 FOXO3a在胃癌及癌旁组织中的表达
FOXO3a以细胞核或细胞质内出现棕黄色颗粒为阳性表达,见图1。 FOXO3a在胃癌组织中的阳性表达率显著低于癌旁组织(P<0.01),见表1。FOXO3a在胃癌组织中的表达与分化程度有关(P<0.05),与年龄、性别、部位、T分期、TNM分期及淋巴结转移无关,见表2。

Figure 1.The expression of E-cadherin and FOXO3a in gastric cancer and corresponding adjacent tissues was detected by immunohistochemistry (SP method). A: E-cadherin was negatively expressed in adjacent tissues of gastric cancer; B: E-cadherin was positively expressed in adjacent tissues of gastric cancer; C: E-cadherin was negatively expressed in gastric cancer tissues; D: E-cadherin was positively expressed in gastric cancer tissues; E: FOXO3a was negatively expressed in adjacent tissues of gastric cancer; F: FOXO3a was positively expressed in adjacent tissues of gastric cancer; G: FOXO3a was negatively expressed in gastric cancer tissues; H: FOXO3a was positively expressed in gastric cancer tissues.
图1免疫组化检测胃癌及对应癌旁组织中E-cadherin和FOXO3a的表达
表1E-cadherin和FOXO3a在胃腺癌及癌旁正常组织中表达的关系
Table 1.The expression of E-cadherin and FOXO3a in gastric adenocarcinoma and their adjacent normal tissues (Mean±SD.n=53)
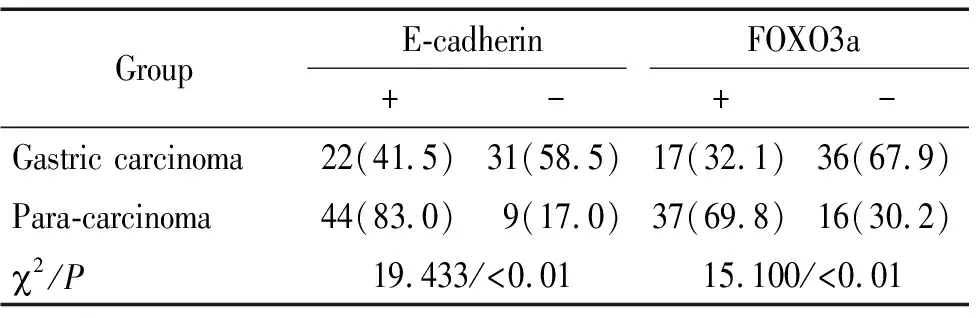
GroupE-cadherinFOXO3a+-+-Gastric carcinoma22(41.5)31(58.5)17(32.1)36(67.9)Para-carcinoma44(83.0)9(17.0)37(69.8)16(30.2)2/P19.433/<0.0115.100/<0.01
3 E-cadherin与FOXO3a在胃癌组织中表达的相关性
在E-cadherin蛋白阳性表达组中,FOXO3a蛋白的阳性表达率为22.6%,在E-cadherin阴性组中,FOXO3a蛋白的阳性表达率为9.4%,E-cadherin与FOXO3a蛋白在胃癌组织中的表达呈显著正相关(r=0.376,P=0.003),见表3。
4 E-cadherin在稳转AGS细胞中的表达验证
Real-time PCR检测2组细胞中E-cadherin的mRNA相对表达,结果显示过表达基因转染的AGS细胞中E-cadherin的mRNA水平显著升高(P<0.05)。Western blot分析显示过表达基因转染后,AGS细胞中E-cadherin蛋白可见明显表达(P<0.01),见图2。
5 免疫细胞化学分析E-cadherin过表达对AGS细胞中FOXO3a表达的影响
表2E-cadherin和FOXO3a在胃腺癌中的表达及其与临床病理特征的关系
Table 2.Expression of E-cadherin and FOXO3a in gastric adenocarcinoma and their relationship with clinicopathological features (Mean±SD.n=53)
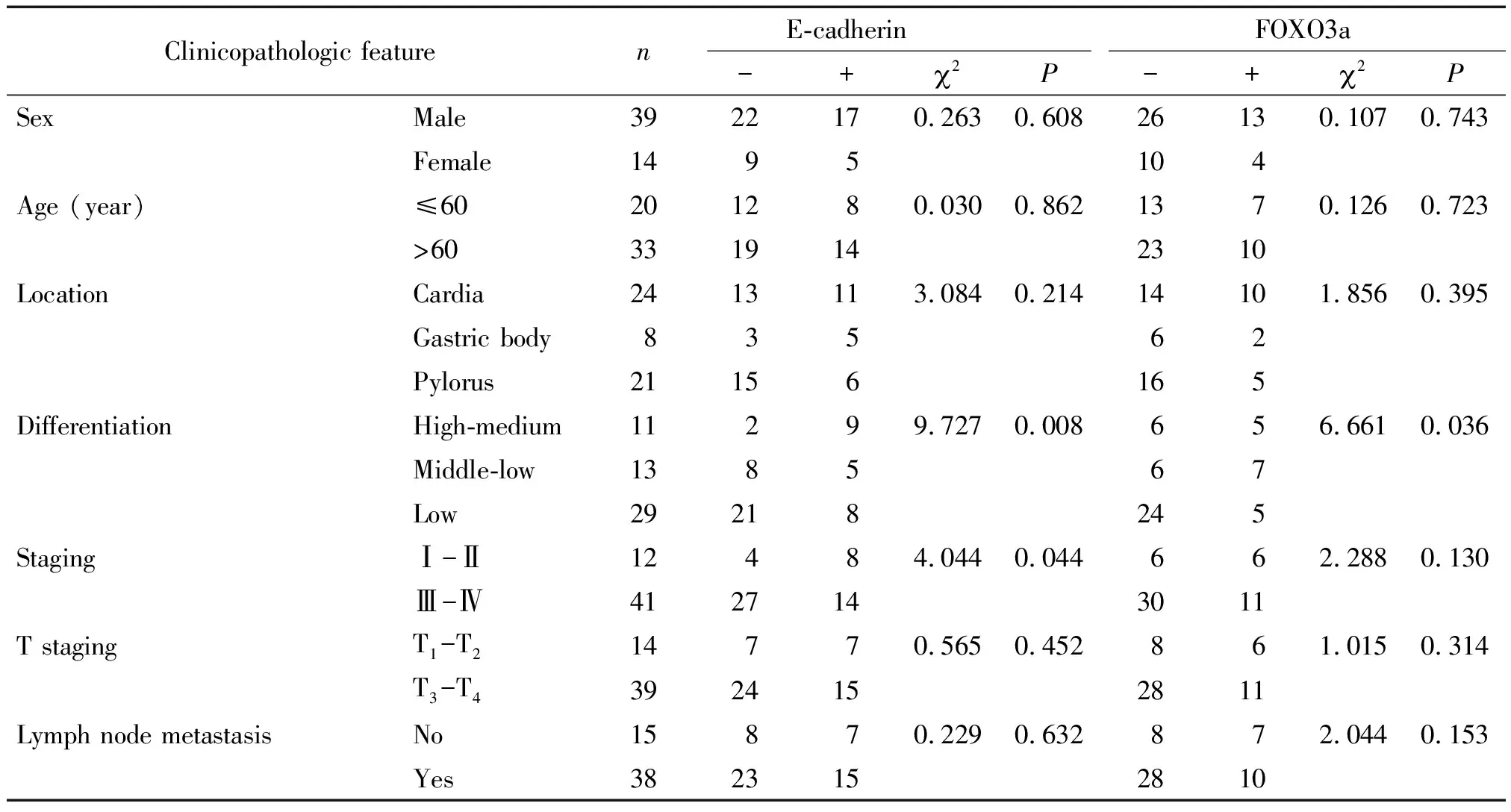
Clinicopathologic featureE-cadherinFOXO3an-+2P-+2PSexMale3922170.2630.60826130.1070.743Female1495104Age (year)≤60201280.0300.8621370.1260.723>603319142310LocationCardia2413113.0840.21414101.8560.395Gastric body83562Pylorus21156165DifferentiationHigh-medium 11299.7270.008656.6610.036Middle-low138567Low29218245StagingⅠ-Ⅱ12484.0440.044662.2880.130Ⅲ-Ⅳ4127143011T stagingT1-T214770.5650.452861.0150.314T3-T43924152811Lymph node metastasisNo15870.2290.632872.0440.153Yes3823152810
表3E-cadherin和FOXO3a在胃腺癌中表达的相关性
Table 3.Correlation between E-cadherin and FOXO3a expression in gastric adenocarcinoma
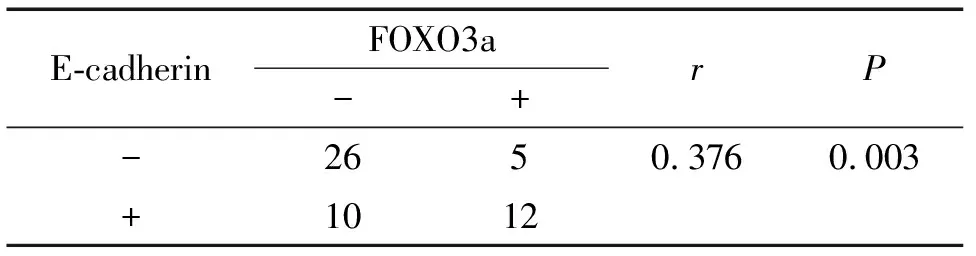
E-cadherinFOXO3a-+rP-2650.3760.003+1012
与NC组相比,对照组AGS细胞呈分散性生长,E-cadherin过表达的AGS细胞呈团簇状生长。E-cadherin过表达的AGS细胞之间黏附能力增加,更易成团。E-cadherin过表达后,细胞中FOXO3a的表达量明显增高,见图3。
6 CCK-8法分析E-cadherin过表达对AGS细胞活力的影响
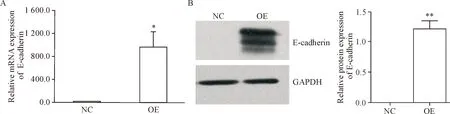
Figure 2.Verification of E-cadherin mRNA (A) and protein (B) expression in stably transfected AGS cells. NC: negative control AGS cells; OE: E-cadherin-over-expressing AGS cells. Mean±SD.n=3.*P<0.05,**P<0.01vsNC group.
图2稳转AGS细胞中E-cadherinmRNA和蛋白表达验证
与对照AGS细胞相比,E-cadherin过表达的AGS细胞活力明显下降,12 h、72 h和96 h的对照组和E-cadherin过表达的AGS细胞组细胞活力的差异均无统计学显著性,24和48 h的细胞活力差异有统计学意义(P<0.05),见图4。
7 Western blot检测E-cadherin过表达对FOXO3a、Akt、Bcl-2和Bax蛋白表达的影响
与正常AGS细胞组相比,E-cadherin过表达的AGS细胞中FOXO3a、Bax和Bcl-2蛋白表达量显著升高,Akt蛋白表达量显著降低,内参调整后的Bax/Bcl-2相对表达比值显著升高(P<0.05),见图5。
讨 论
E-cadherin对上皮细胞黏附性起着重要作用,能够抑制细胞迁移,保持细胞之间的连接以及组织的完整性,在多数肿瘤中表达下调或缺失,从而促进了肿瘤的发生发展[4-6]。E-cadherin与胃癌发生发展及预后关系密切,可调节多种信号传导通路发挥作用,在胃癌诊断、预后判断和治疗方面具有重要价值[2, 7]。本研究结果也表明E-cadherin在肿瘤组织中表达显著下调,且与胃癌组织的分化程度和临床分期显著相关,提示E-cadherin表达下调可能促进了胃癌发生,这与部分文献报道不一致[8],可能存在人群和种族差异。

Figure 3.The expression of E-cadherin and FOXO3a in AGS cells was detected by immunocytochemistry. A: strong positive expression of E-cadherin in E-cadhe-rin-over-expressing gastric cancer AGS cells; B: negative expression of E-cadherin in gastric cancer AGS cells; C: strong positive expression of FOXO3a in E-cadherin-over-expressing gastric cancer AGS cells; D: negative expression of FOXO3a in gastric cancer AGS cells.
图3免疫细胞化学分析AGS细胞中的E-cadherin和FOXO3a表达
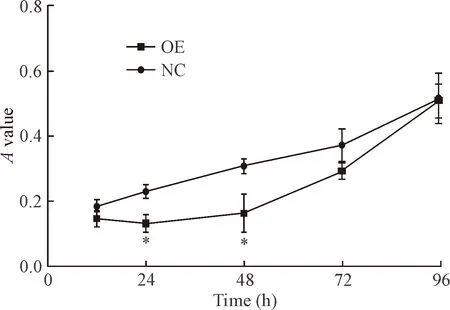
Figure 4.Difference of theAvalues between the 2 groups of cells at different time points. NC: negative control AGS cells; OE: E-cadherin-over-expressing AGS cells. Mean±SD.n=3.*P<0.05vsNC group.
图42组细胞培养不同时间的A值差异
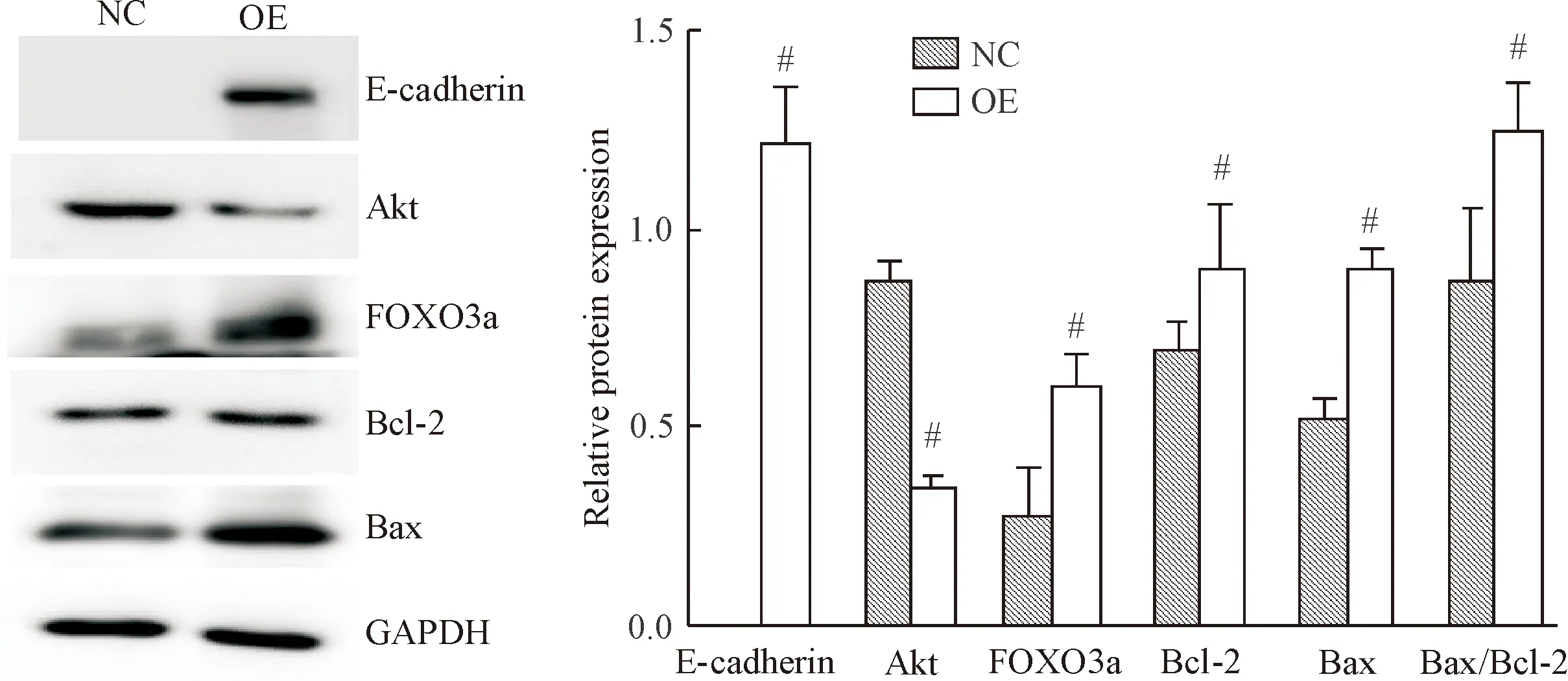
Figure 5.Relative expression of FOXO3a, Akt, Bcl-2 and Bax proteins analyzed by Western blot. NC: negative control AGS cells; OE: E-cadherin-over-expressing AGS cells. Mean±SD.n=3.#P<0.05vsE-cadherin overexpressed gastric cancer AGS cells group.
图5Westernblot分析FOXO3a、Akt、Bcl-2和Bax蛋白的相对表达水平
FOXO3a是叉头转录因子家族重要成员,多数研究表明其是一种肿瘤抑制因子,其导致肿瘤的发生可能与DNA损伤有关,并与肿瘤侵袭转移、预后和肿瘤耐药关系密切[9-10]。FOXO3a在胃癌发生发展中的作用还不清楚,现有研究中出现了截然相反的结果[11-13]。本研究结果显示,胃癌组织中FOXO3a的表达显著低于对应癌旁组织,提示其可能是肿瘤抑制因子,与Yang等[11]研究结果相一致,与其它研究结果不一致的原因可能在于胃癌分子表型的个体化差异和结果判定标准差异等因素的影响,还需要同一标准下的大样本病例研究进一步验证。
本研究结果首次表明E-cadherin和FOXO3a在胃癌组织中表达均下调,并存在显著正相关,胃癌AGS细胞中E-cadherin过表达可导致FOXO3a表达相应增加,说明E-cadherin和FOXO3a可能共同参与了胃癌的发生,其可能的机制与两者显示的抑癌基因功能有关,两者共同下调促进了胃癌的发生,两者是否参与了共同分子机制尚需进一步研究。也有研究观察到FOXO3a可通过调节E-cadherin表达影响肿瘤细胞生物学特性[14-15],说明两者存在共同的信号传导机制,两者之间是否存在交叉对话尚需进一步研究。Akt/FOXO3a信号传导通路在多种肿瘤发生发展中发挥重要作用[16-17]。本研究结果也显示,E-cadherin过表达能有效抑制AGS细胞的增殖,促进细胞间黏附,并导致Akt表达抑制,同时FOXO3a、Bcl-2和Bax表达上调,这提示E-cadherin可能通过影响Akt/FOXO3a信号传导抑制胃癌AGS细胞增殖。
综上所述,本研究表明E-cadherin和FOXO3a在胃癌组织中表达下调并存在显著正相关,过表达E-cadherin可上调FOXO3a表达,E-cadherin过表达抑制胃癌细胞增殖可能与调节Akt/FOXO3a信号传导有关,可能是胃癌个体化治疗潜在治疗靶点。
