响应面法优化双孢菇鲜味物质提取工艺的研究
2019-03-19卢朝婷刘江王晓君沈秋霞刘洪李明元吉礼
卢朝婷,刘江,王晓君,沈秋霞,刘洪,*,李明元,吉礼
(1.西华大学食品与生物工程学院,四川成都610039;2.四川省食品生产安全协会,四川成都610061)
双孢蘑菇(Agaricus bisporus)又称白蘑菇、洋蘑菇,是天然的绿色食品原料,具有药用价值高和营养丰富等特点,为当今最广泛、产量最大、消费量最高的食用菌之一。近几年来,我国蘑菇栽培发展迅速,产量和出口量超越美国跃居世界第一,是我国近年来出口量最大的食用菌之一[1]。其氨基酸组成全面,并含有人体所需的8种必需氨基酸[2],尤其是含有丰盛的呈鲜核苷酸(如:肌苷酸、鸟苷酸、胞苷酸等)和呈味氨基酸(如:谷氨酸、天冬氨酸等),不仅富含营养物质,而且还有特殊的菇味,具有“素中之王”的称号。双孢菇营养丰富,肉质肥厚,味道鲜美,且热能低,是高蛋白质、低脂肪食品[3]。我国是双孢菇生产大国,双孢菇含有丰富的营养,具有医疗保健作用,气味独特味道鲜美,深得消费者喜爱,国内消费逐年增加。但由于采摘后双孢蘑菇中的多酚物质易发生褐变,使双孢蘑菇风味变坏,失去商业价值,阻碍了双孢蘑菇深加工的发展[4]。目前,国内外对双孢蘑菇的探讨研究只在双孢菇的采后生理、贮藏保鲜及活性物质提取等方面,市面上双孢蘑菇加工大多是干制、罐藏、盐制等技术,产品质量参差不齐且较单一,产业链短,深加工产品不足,因此,市场急需开发新型的双孢蘑菇深加工产品类型来满足需求,提高双孢菇利用率和质量,促进其产业的发展[5]。
氨基酸是非常重要的呈味呈鲜物质,其中,呈鲜氨基酸在金针菇等食用菌中的含量超过氨基酸总量的40%,而谷氨酸则是重要的呈味氨基酸,其与食盐共用鲜味明显[6]。双孢菇中含有非常丰富的呈味氨基酸,其中的谷氨酸、天冬氨酸、胞苷酸以及鸟苷酸等核苷酸均具有较强的呈鲜效果[7]。通过将这些具有鲜味的成分作为鲜味剂应用于调味品中,对于延长双孢菇产业链,丰富双孢菇市场具有积极作用[8]。本研究以双孢菇为原料,利用纤维素酶来提取双孢菇中的鲜味物质,并结合响应面法,应用Box-Behnken试验设计的原理,以α-氨基氮含量为主要考核指标,对双孢菇中鲜味物质的提取工艺进行优化,为更好的开发双孢菇产品提供参考,丰富食用菌市场,为双孢蘑菇的深加工和综合利用提供理论基础。
1 材料与方法
1.1 材料与试剂
双孢蘑菇子实体:市售,选取外形完整、无褐变、已干燥的双孢菇备用;纤维素酶(5万U/g):和氏璧生物有限公司;β-环糊精:郁南县永光环状糊精有限公司;营养琼脂、月桂基硫酸盐胰蛋白胨肉汤(LST):北京奥博生物技艺有限公司;其它试剂均为分析纯。
1.2 仪器与设备
FB124型电子分析天平:上海舜宇恒平科学仪器有限公司;XT-100L型多功能粉碎机:水康市红太阳电机有限公司;DK-98-ⅡA型电热恒温水浴锅:天津市泰斯特仪器有限公司;PHS-320型多功能酸度计:成都世纪方舟科技有限公司;WFJ2000紫外可见分光光度计:江苏金坛市金城国胜试验仪器厂;RE-52AA抽真空蒸发器、电热式XFH不锈钢立式压力蒸汽灭菌锅:上海亚荣生化仪器厂;EYELA超微喷雾干燥仪:瑞士BUCHI公司;SH420型石墨消解仪、K1100型全自动凯氏定氮仪器:山东海能科学仪器有限公司;HXGZXA4恒温干燥箱:浙江光合力通世纪有限公司。
1.3 试验方法
1.3.1 制备工艺
双孢蘑菇→除杂→粉碎→酶解→过滤→浓缩→喷雾干燥→双孢蘑菇粉状鲜味料
1.3.2 双孢菇的预处理
将购买的外形完整、无褐变、已干燥的双孢菇,经粉碎机粉碎后过60目筛,菇粉备用。
1.3.3 双孢菇的水解
取一定量粉碎后的双孢蘑菇,加入一定水浸泡,混合均匀,加入一定量的纤维素酶,调节pH值,放入恒温水浴锅中振荡酶解一段时间。酶解结束后,在沸水浴中灭酶10 min后,4 000 r/min离心10 min,取上清液,即得双孢菇水解液[9-10]。
1.3.4 α-氨基氮含量的测定——茚三酮比色法[11]
在碱性溶液中氨基酸(除脯氨酸外)能与茚三酮反应生成蓝紫色化合物,用吸光光度法可测定。蓝紫色化合物的颜色深浅与甘氨基酸含量成正比,最大吸收波长为570 nm,故以此能够测定样品中氨基酸的含量。
标准曲线的绘制:分别取1 μg/mL氨基酸标准溶液 0、0.2、0.4、0.6、0.8、1.0、1.2 mL 于 7 个 25 mL 容量瓶中,各加水补充至容积为1.2 mL,然后加pH5.4乙酸-乙酸钠缓冲液和茚三酮(质量分数为2%)各1.0 mL,加抗坏血酸溶液0.1 mL,混合均匀,在沸水浴中加热15 min,取出用冷水快速冷却至室温,定容,摇匀,静置15 min,在570 nm波长下,以空白试剂为参比测定各溶液吸光度A,以氨基酸质量浓度(μg/mL)为横坐标,吸光度A为纵坐标,绘制标准曲线。
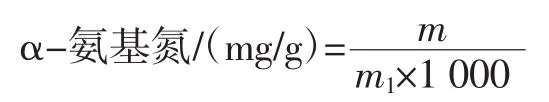
式中:m为标准曲线上查得氨基氮质量,μg;m1为测定样品的质量,g。
1.3.5 蛋白质的测定
蛋白质的测定参照GB 5009.5《食品安全国家标准食品中蛋白质的测定》[12]第一法凯氏定氮法进行测定。
1.3.6 单因素试验及设计方案
对加酶量、酶解pH值、酶解温度和酶解时间4个单因素分别进行单因素试验,每个因素取6个梯度,每个梯度各做3个平行处理,并对其α-氨基氮含量及蛋白质含量进行测定,结果取平均值,各因素变量的梯度水平见表1。
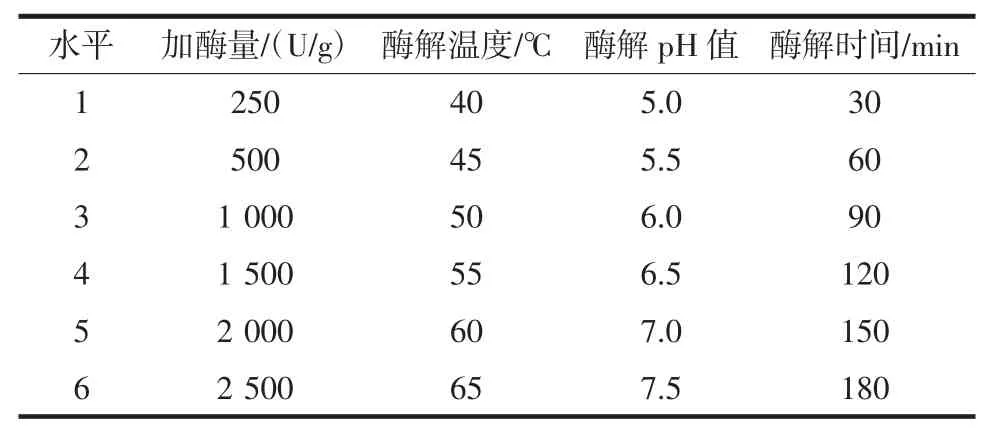
表1 各单因素变量的梯度水平Table 1 Gradient levels of each single factor variable
1.3.7 响应面设计
根据单因素试验的结果,选取加酶量、酶解温度和酶解时间这3个对双孢菇香味物质影响较显著的单因素为自变量,以α-氨基氮含量为响应值进行响应面试验设计,研究在各单因素共同作用下的最佳工艺参数,试验因素水平及编码见表2。

表2 Box-Behnken试验设计因素与水平Table 2 Box-Behnken experimental design factors and levels
1.3.8 双孢菇风味料产品分析
双孢蘑菇风味料是一种具有丰富营养价值的调味料,具有菇类风味、速溶等特点,参照SB/T 10484《菇精调味料》[13]和 SB/T 10371《鸡精调味料》[14]对产品进行分析。
2 结果与分析
2.1 α-氨基氮标准曲线的绘制
以甘氨酸标准液的质量(μg)为横坐标,A570nm处的吸光度值为纵坐标,绘制标准曲线。如图1所示,得到的标准曲线回归方程为Y=1.211 5 X+0.006 1,相关系数为0.999 1。
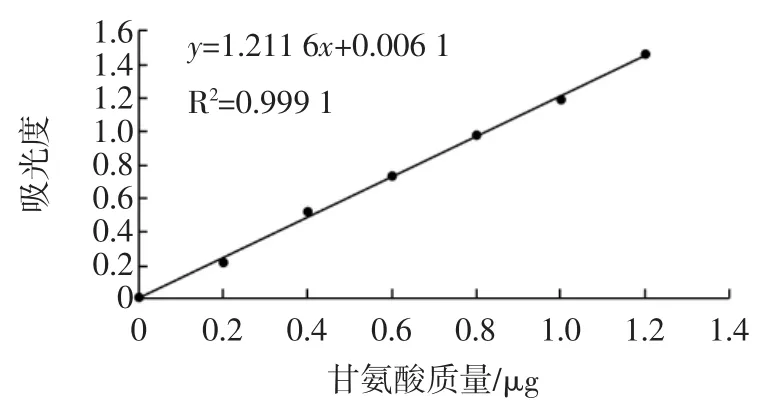
图1 α-氨基氮标准曲线Fig.1 Standard curve of α-amino nitrogen
2.2 单因素试验
2.2.1 不同加酶量对鲜味物质提取的影响
加酶量对鲜味物质提取的影响见图2。
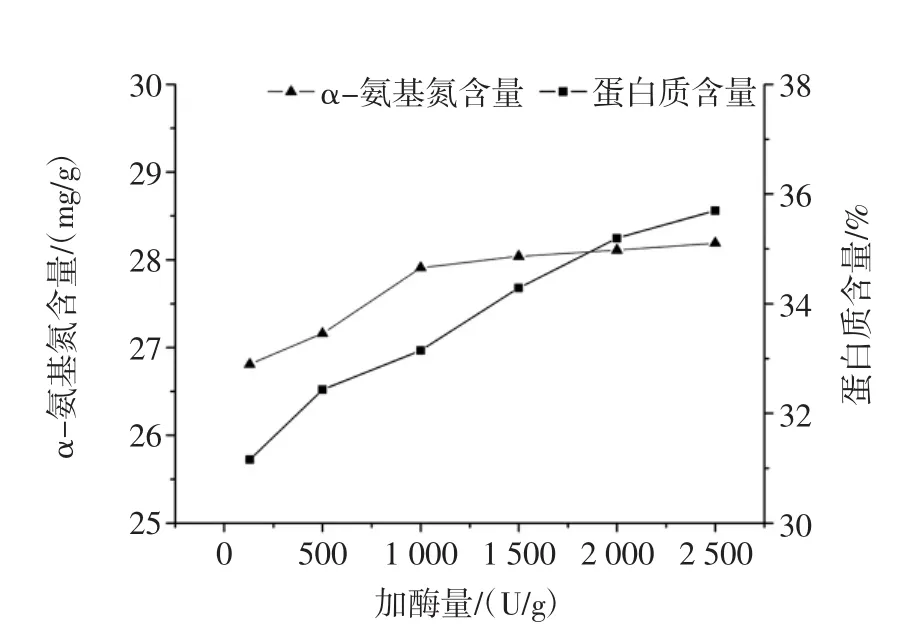
图2 加酶量对鲜味物质提取的影响Fig.2 The effect of enzyme addition on flavor extraction
由图2可知:随着纤维素酶添加量的增加,α-氨基氮含量先急速增加再趋于平缓,在1 000 U/g后趋于平稳,继续添加酶量对α-氨基氮含量影响不大。蛋白质含量逐渐增加,并随着加酶量加大后,蛋白质含量上升缓慢。这可能是加酶量在低水平时,酶浓度偏低,因此酶可以与底物充分结合,所以α-氨基氮和蛋白质均上升,随着加酶量的不断增加,底物已经与酶结合,多余的酶无法与底物充分结合,因此导致酶的作用受到抑制[15]。当加酶量在1 000 U/g后α-氨基氮含量趋于平稳,继续添加酶量对α-氨基氮含量影响不大。因此从节约成本和实际考虑,选择较佳酶量为1 000 U/g。
2.2.2 不同温度下纤维素酶的酶解效果的影响
温度对鲜味物质提取的影响见图3。

图3 酶解温度对鲜味物质提取的影响Fig.3 Effect of digesting temperature on flavor extraction
由图3可知:随着酶解温度的增加,α-氨基氮含量和蛋白质含量均呈现先逐渐上升再下降的趋势,α-氨基氮含量在55℃达到最大。这可能是因为温度对酶活性影响较大,在温度低于酶的最适温度时,随着温度的上升其酶活性不断增强,因此其对细胞壁的破损能力增强,并在最适温度时活力最大,随着温度的不断增加,当其超过最佳酶解温度时,随着温度的升高,其活力逐渐下降[16],因此酶解温度过低或过高都会抑制酶的活力,导致酶解效果不好,因此纤维素酶的较佳酶解温度为55℃。
2.2.3 不同酶解pH值对纤维素酶的酶解影响
pH值对鲜味物质提取的影响见图4。
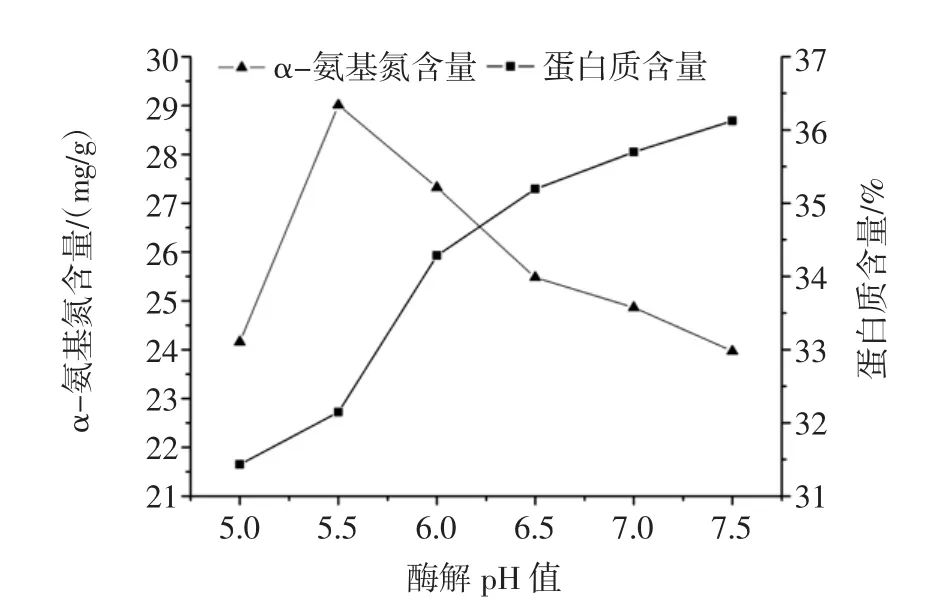
图4 酶解pH值对鲜味物质提取的影响Fig.4 Effect of enzymolysis pH value on flavor extraction
由图4可知:随着pH值的升高,蛋白质含量均随着pH值的增加而增加,α-氨基氮含量随着pH值的升高,先升高后逐渐下降,pH值继续增大,α-氨基氮含量下降趋于平稳。这有可能是pH值过高或过低影响了酶的构象,降低了酶解效率,故选pH5.5为较佳初始pH值。
2.2.4 不同酶解时间下对纤维素酶的酶解影响
酶解时间对鲜味物质提取的影响见图5。
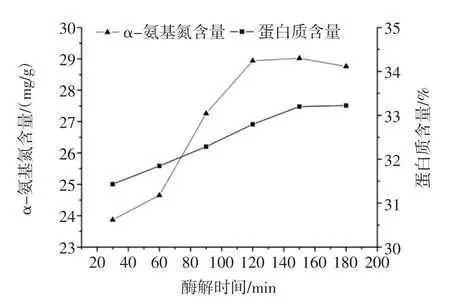
图5 酶解时间对鲜味物质提取的影响Fig.5 Effect of enzymolysis time on flavor extraction
由图5可知:随着酶解时间的增长,α-氨基氮含量和蛋白质含量在上升,当酶解时间超过120 min时,α-氨基氮含量开始下降。这可能是随着酶解时间的延长,反应混合物中溶解性肽慢慢增加、底物浓度变小,这些反应产物与未水解的双孢蘑菇粉对酶产生竞争性结合。由于酶解时间的延长会增加试验的成本,故选择最佳酶解时间为120 min。
2.3 响应面优化工艺
在单因素试验的基础上,选择A加酶量、B酶解时间、C酶解温度3个因素所确定的水平范围,利用Design-expert软件进行响应面试验设计。根据Box-Benhnken的设计原理,以α-氨基氮含量为响应值,进行三因素三水平共17组试验的响应面分析,结果如表3所示。
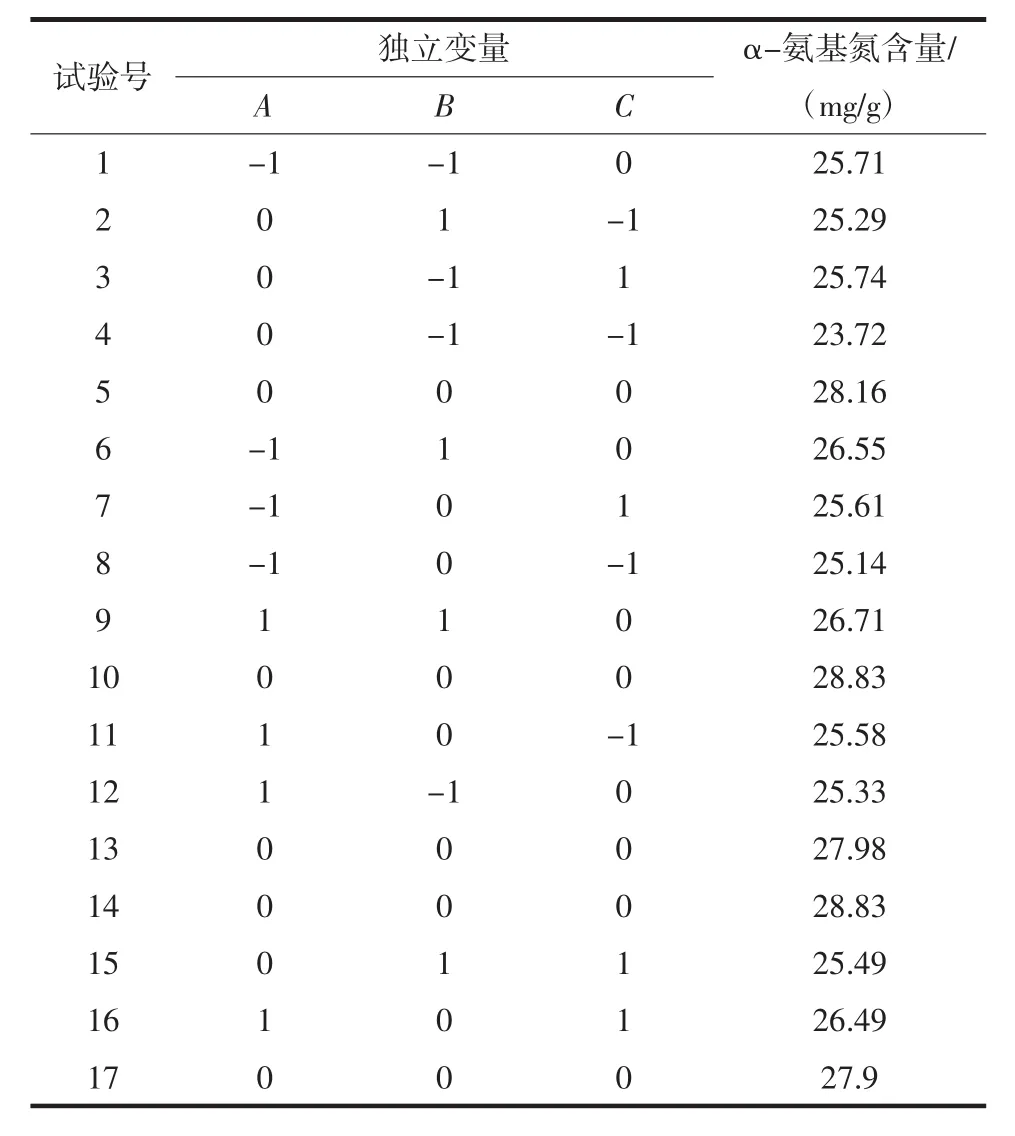
表3 响应面试验设计及结果Table 3 Experimental design and results for response surface analys
2.4 纤维素酶响应面方差分析
2.4.1 以α-氨基氮含量为响应值的方差分析
纤维素酶响应面方差分析结果见表4。
由表4可知,对α-氨基氮含量所建立的二次多项回归模型具有高度的显著性(P=0.000 4<0.01),失项P=0.508 0>0.05,表示水平不显著,说明试验有极小的概率受到受到未知因素干扰,即模型符合要求;模型的调整确定系数R2=0.961 1说明回归方程对试验拟合较好,回归效果好,可以用此模型对α-氨基氮含量进行分析和预测。通过比较各项F值,研究各因子对纤维素酶酶解双孢蘑菇的影响,确定各因子影响到主次关系,即B(酶解时间)>C(酶解温度)>A(加酶量)。
2.4.2 以α-氨基氮含量为响应值的拟合模型
以α-氨基氮含量为响应值,对纤维素酶酶解双孢蘑菇试验进行二次多元回归拟合,对数据进行多元回归分析,得到回归方程:
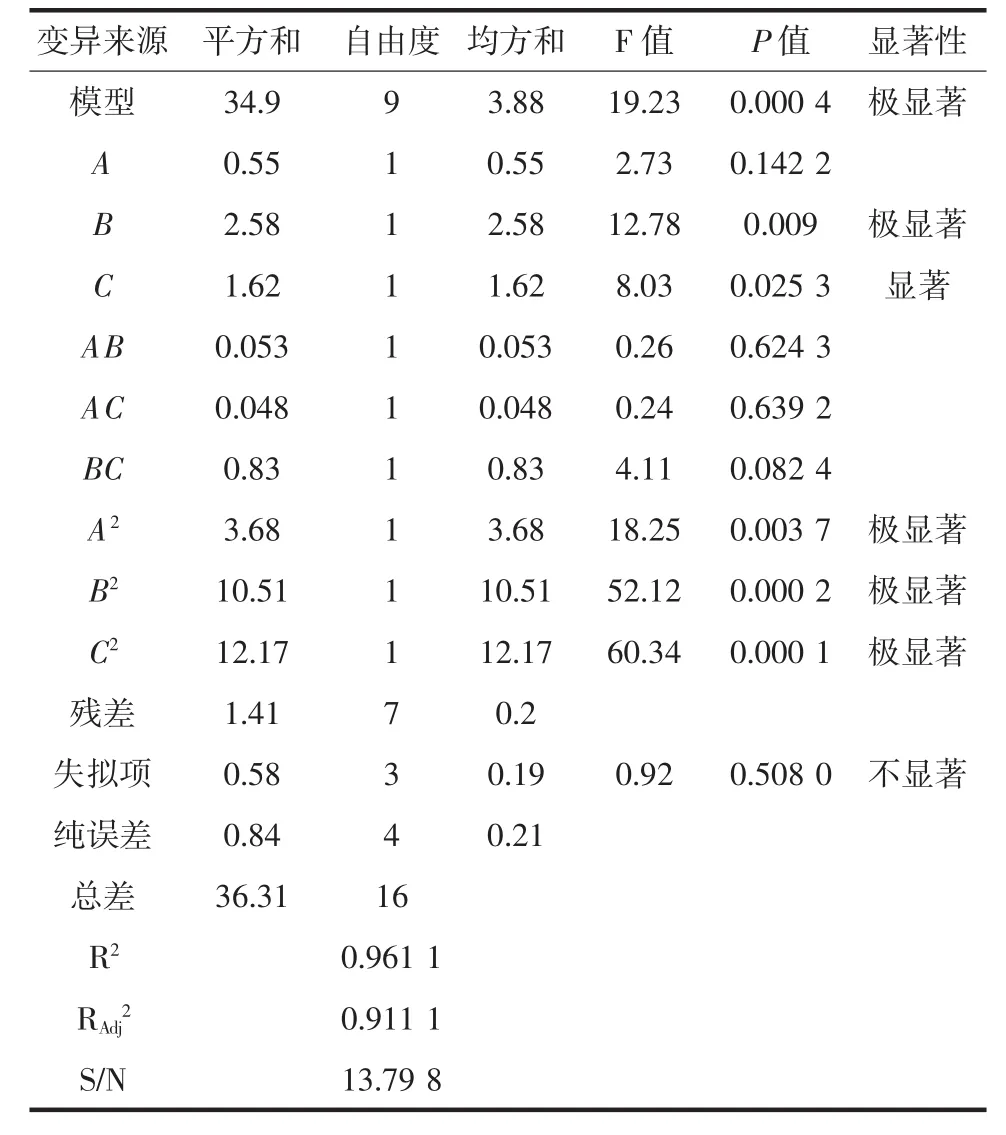
表4 纤维素酶响应面方差分析结果Table 4 The cellulose variance analysis of RSM

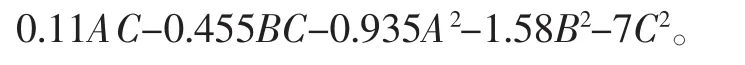
2.4.3 以α-氨基氮含量为响应值的响应面图分析
响应面模型是A、B、C各试验因子所构成的三维空间曲面图,从响应面分析图上能够看出纤维素酶加酶量、酶解时间、酶解温度任意一变量取零水平时,其余两个变量对双孢蘑菇α-氨基氮含量的影响见图6。
从图6可以看出,α-氨基氮含量随各两因素的增加均是呈现先上升后缓慢下降的趋势。等高线的形状为椭圆形,则表示两因素的交互作用强;等高线的形状为圆形时,则表示两因素的交互作用弱[17]。从图6可以看出,不论是加酶量和酶解时间、加酶量和酶解温度以及酶解时间和酶解温度之间交互作用的等高线均为椭圆形,这就说明各两因素之间的交互作用显著。从其三维空间曲面图可以看出,加酶量、酶解时间和酶解温度两两交互时,对α-氨基氮含量的影响均呈现抛物线形状,即随着加酶量、酶解时间和酶解温度的升高,α-氨基氮含量先增加后降低,因此,在酶解时,适当的增加加酶量、酶解温度,延长酶解时间可以提高α-氨基氮的含量。
2.5 优化验证试验的结果及分析

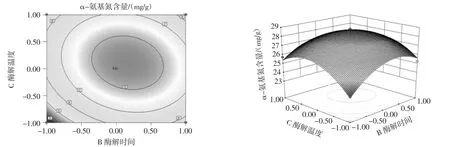
图6 不同因素对双孢菇α-氨基氮含量影响的响应曲面和等高线Fig.6 Response surface and contour of different factors affecting α-amino nitrogen content of Agaricus bisporus
为精确的计算纤维素酶的最佳酶解条件,利用回归方程对各自变量(A、B、C)求极值,得到极值点为0.63、0.41、C=0.05,即纤维素酶加酶量 1 257.04 U/g、酶解时间110.09 min、酶解温度50.2℃,此条件下α-氨基氮含量为28.085 5 mg/g,得到纤维素酶酶解双孢蘑菇的最优工艺参数。结合实际,调整各因素为:加酶量1 000 U/g、酶解时间110 min、酶解温度50℃。此条件下进行3次平行试验验证,结果如表5所示,α-氨基氮含量为27.94 mg/g,与预测值相差为0.5%,证明了该模型的可靠性。

表5 纤维素酶最佳工艺试验表Table 5 The best process test of cellulose
2.6 指标测定
2.6.1 感官指标
色泽:浅灰黄色。
香气:有食用菌特殊的芳香气味,无不良气味和异味。
滋味:鲜美滋味,口感柔和,口味适中,无刺激性。
形态:粉状,无霉变和结块。
2.6.2 理化指标
双孢蘑菇粉状调味料的理化指标如表6所示。
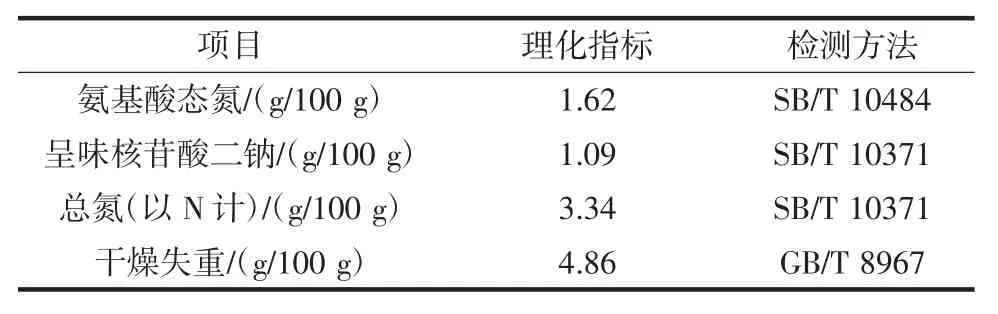
表6 理化指标Table 6 The index of physics and chemistry
2.6.3 卫生指标
双孢蘑菇粉状调味料的卫生指标如表7所示。
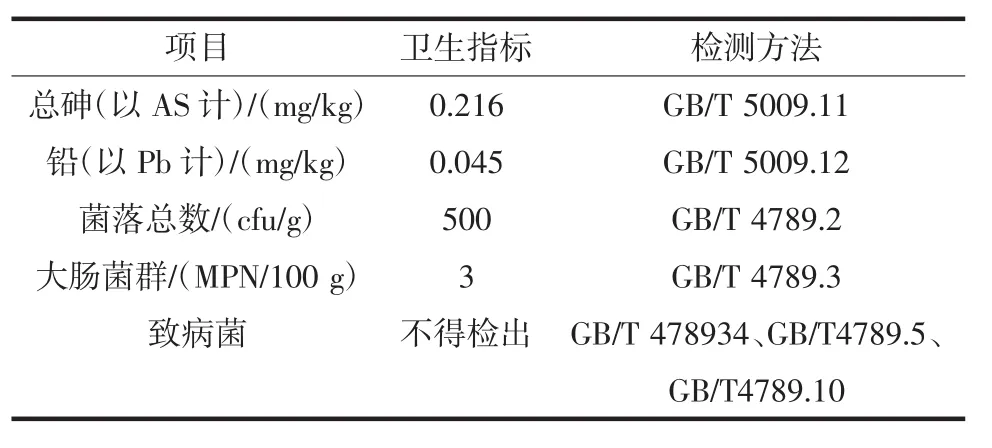
表7 卫生指标Table 7 The index of microbiological
3 结论
试验结果表明,通过单因素试验可以得出,当其他条件相同的情况时,每个单因素对双孢菇香味物质提取的影响情况以及最佳值,结果显示,在单因素试验中,选择最佳加酶量为1 000 U/g、最佳酶解pH值为5.5、酶解最佳温度为50℃、最佳酶解时间为120 min。在单因素试验的基础上,设计响应面优化试验对双孢菇酶解工艺进行优化,最终得到最佳组合工艺条件为纤维素酶加酶量1 257.04 U/g、酶解时间110.09 min、酶解温度50.2℃,结合实际,调整各因素为:加酶量1 000 U/g、酶解时间110 min、酶解温度50℃,此条件下α-氨基氮含量为27.94 mg/g,与预测值基本相符。
