鲜味肽与鲜味受体的研究进展
2019-03-18王莉伍圆明孙伟峰车振明丁文武
王莉,伍圆明,孙伟峰,车振明,丁文武*
(1.西华大学 食品与生物工程学院,成都 610039;2.衡阳师范学院 生命科学与环境学院, 湖南 衡阳 421008)
鲜味作为五种基本味觉之一,可以给人带来愉悦感,代表了大部分氨基酸、核苷酸类营养物质的特征风味[1],是人体必不可少的味觉需求。鲜味肽作为近年来提出的一种新型鲜味物质,可通过与人体味蕾上的鲜味受体发生相互作用而呈现出一定的鲜味特征[2],且可在不影响食品其他味感的基础上,通过协同作用或美拉德反应,补充或增强食品的原有风味[3-5]。它不仅能带来愉悦的味觉感受,还能提供肽及氨基酸类营养成分,在食品调味品领域的应用中具有极大的发展前景。目前,已在鲜味肽提取、序列鉴定、序列特征分析以及鲜味受体呈味机制分析等方面取得了一定的进展[6,7]。本文主要对鲜味肽的来源、序列结构特征、微生物生产和鲜味受体的种类、鲜味信号传导及其识别机制进行了综述,并结合当前研究中存在的问题进行分析,以期对鲜味肽的挖掘、改造、应用以及鲜味受体对鲜味肽的具体识别机制等研究提供参考。
1 鲜味肽的序列来源及其结构特征
1.1 鲜味肽的序列来源
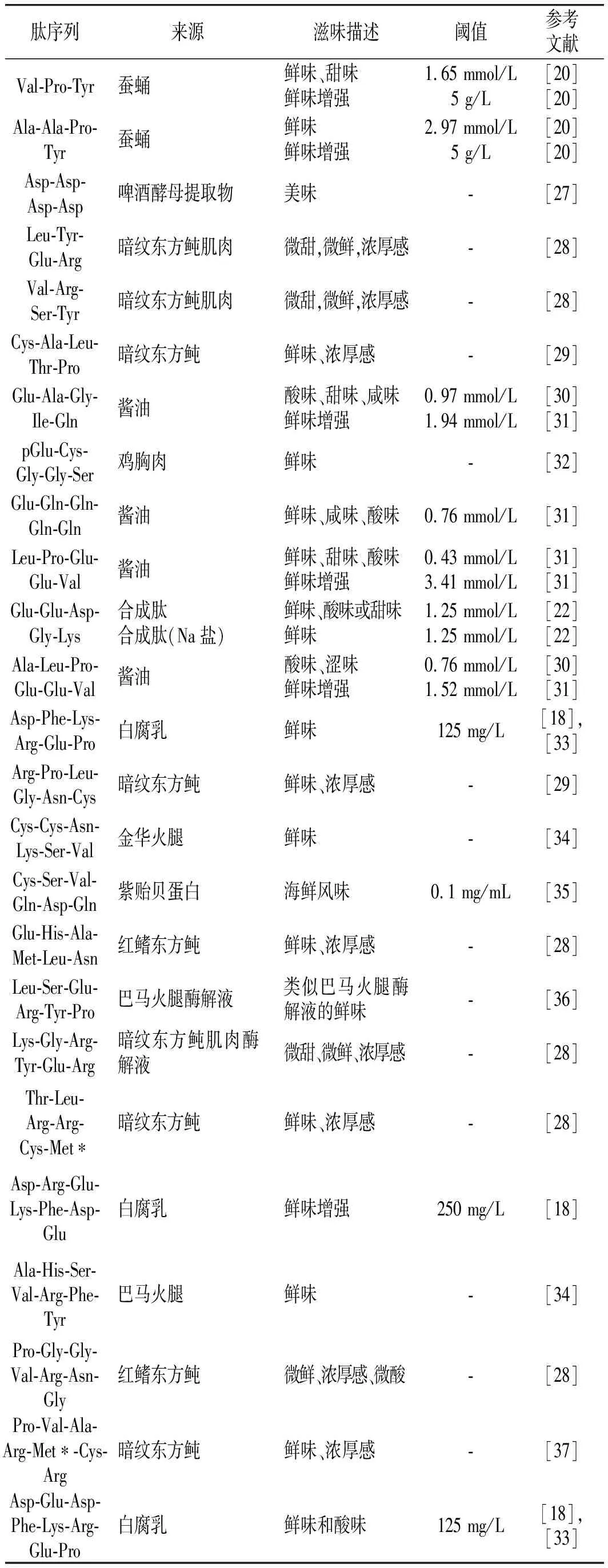
鲜味肽作为继谷氨酸钠(monosodium glutamate,MSG)、鸟苷酸(guanosine monophosphate,GMP)和肌苷酸(inosine monophosphate,IMP)之后的一种理想的天然鲜味物质,是近年来鲜味调味剂领域的研究焦点。在早期研究中,鲜味肽的呈味描述形式各不相同,在1972年,Arai等[8]首次在大豆蛋白中提取出4条谷氨酰寡肽,被描述为具有肉汤味;在1975年,Noguchi等[9]在鱼肉蛋白中提取出一系列呈味多肽,具有类似MSG的味道;在1978年,日本学者Yamasaki又从牛肉的木瓜蛋白酶水解液中分离、提取、纯化出一种美味的多肽——牛肉八肽(beefy meaty peptide,BMP),其氨基酸序列为Lys-Gly-Asp-Glu-Glu-Ser-Leu-Ala[10],且阈值为1.41 mmol/L,稍低于MSG(1.56 mmol/L)[11]。随后,逐渐在肉类酶解物、小麦面筋、火腿、花生、水产品等[12-16]富含蛋白质的食物中也提取出一系列具有鲜味的多肽,同时,一些合成的肽也被报道具有鲜味[17]。此外,已有研究表明部分肽组分本身不具有风味,但当与其他鲜味成分共同存在时可引起风味增强效果,如Glu-Glu,Glu-Val,Ala-Asp-Glu,Ala-Glu-Asp,Asp-Glu-Glu和Ser-Pro-Glu等一系列短肽组分均可以使鲜味显著增强。近年来,对于新型鲜味肽的探索仍在继续,依次从白腐乳、茶褐牛肝菌和蚕蛹水解物中提取出鲜味肽,并经合成验证,其中部分鲜味肽还具有鲜味增强作用[18-20]。目前已报道的大部分鲜味肽的序列、来源和呈味信息见表1。

表1 鲜味肽的序列来源和呈味信息Table 1 The sequence source and taste information of umami peptides

续 表
续 表

续 表
1.2 鲜味肽构效关系
1.2.1 鲜味肽的肽链长度对其呈鲜效果的影响
肽链的长度与鲜味肽的鲜味密切相关。研究表明,引起鲜味的肽组分通常是小分子量肽[40],鲜味肽氨基酸骨架一般结构式为-O)(C)n(O-,n介于3~9之间,且当n取值为4~6之间时鲜味最强,这意味着鲜味肽通常为具有3~9个碳原子的脂链,C原子可以被替换为O,N,S,P[41]。王丽华等在谷朊粉鲜味肽的呈味规律研究中发现,分子量<1000 u的肽鲜味较强[42];Ogasawara等[43]通过水解大豆蛋白发现,相对分子质量在1000~5000 u之间的肽段经美拉德反应后具有鲜味或鲜味增强的呈味特性。此外,Rhyu等[44]对韩国豆酱水提物的分级研究也表明,分子质量在500~1000 u的短肽鲜味最强,对增强豆酱的风味起决定性作用。总体而言,鲜味肽的肽链长度在一定程度上影响着其鲜味强度。
1.2.2 鲜味肽的氨基酸组成对其呈鲜效果的影响
鲜味肽的氨基酸组成直接影响着其呈味效果。据报道,鲜味肽序列中通常含有Glu和Asn酸性基团的1种或2种[45],或是含有一定的亲水性氨基酸残基Tyr,Gly,Thr,Phe,Asp等[46],且在碱性氨基酸和酸性氨基酸共同存在的情况下鲜味肽方可呈现出鲜味。此外,部分疏水性基团对鲜味肽的呈味效果也具有一定的影响,Yamasaki等[47]对BMP的序列结构分析发现,Lys-Gly-Asp-Glu-Glu-Ser-Leu-Ala中的疏水性基团-Ser-Leu-Ala呈苦味,而BMP整体呈现鲜味,这可能是肽链向N端增长降低了疏水基团的疏水性;另一项相关研究也表明鲜味肽中存在的部分疏水氨基酸对其呈鲜具有重要贡献[48]。
1.2.3 鲜味肽的氨基酸排列位置对其呈鲜效果的影响
各氨基酸的排列位置也会直接影响鲜味肽的呈味,但不同肽链长度的鲜味肽,其呈味结构特征存在一定的差异。对于鲜味二肽,Tamura等关于酸性基团和碱性基团的位置对鲜味的影响研究发现,N-端为酸性氨基酸、C-端为碱性氨基酸的二肽具有呈味特性,而相反的结构则不具有呈味特性,如Glu-Lys呈现鲜味而Lys-Glu无鲜味。Arai等对12种含有谷氨酸残基的合成二肽的研究也证实了上述观点,N端为谷氨酸,C端为疏水性较小的氨基酸时具有肉汤鲜味,如Glu-Asp,Glu-Thr,Glu-Ser和Glu-Glu。而对主链较长的鲜味多肽而言,呈现出相悖的规律。从Yamasaki等对BMP的结构分析发现,其N-端为带正电的碱性基团Lys-Gly-,带负电的酸性基团-Asp-Glu-Glu-紧邻其C-端位置,而疏水性基团-Ser-Leu-Ala位于C端,它们的协同作用使得牛肉辛肽产生了鲜味。总体而言,鲜味肽分子必须具有带正电、带负电和疏水性基团,且3种分子团能分别置于鲜味受体的相应位置并被识别,才能令人感受到较强烈的鲜味。
2 鲜味肽的微生物生产
在探索新型鲜味肽序列的同时,其生产应用研究也取得了一定的进展。鲜味肽可以通过酶解提取、化学合成和微生物表达获得,在这3种获得方式中,微生物表达无疑是最具工业应用前景的一种鲜味肽生产方式。早在2010年,王艳萍等学者就在毕赤酵母中以串联的方式成功表达了多拷贝BMP,并探索了其发酵控制条件,最终BMP产量达到142.42 mg/L[49,50]。随后,钱伟也在大肠杆菌中同样采用串联策略成功表达了3种鲜味二肽[51]。为了探索适合于鲜味肽单体的表达方式,张崟实验室近年来研究了在BMP的C-端引入硫氧还蛋白于微生物大肠杆菌中表达后再将硫氧还蛋白去除获得BMP的表达方式,最后成功表达带标签的BMP融合蛋白,并在该融合蛋白的断裂纯化技术上取得了一定的进展,最终获得BMP单体的纯度最高达到98%[52-54]。上述关于鲜味肽微生物表达的探索对鲜味肽及其他呈味肽的工业化生产奠定了一定基础。
3 鲜味受体
鲜味是由鲜味物质和位于味蕾中的鲜味受体之间的相互作用引起的,并且通过受体细胞的次级信使触发的级联信号传递而被大脑感知[55],因此,鲜味受体是感知鲜味的关键。目前确定了2种主要的候选鲜味受体:异源二聚体T1R1/T1R3(taste receptor type 1 member 1/3)与味型代谢性谷氨酸受体mGluR4(taste-metabotropic glutamate receptor 4),两者都是C型G-蛋白偶联受体(G-protein coupled receptors,GPCR),由N末端捕蝇草结构域(VFTD)、胞外富含半胱氨酸的结构域(CRD)和七跨膜结构域(TMD)组成,其中VFTD主要负责与鲜味配体识别。
3.1 异源二聚体T1R1/T1R3
随着苦味受体T2Rs和甜味受体异源二聚体T1R2/T1R3相继被鉴定[56,57],异源二聚体T1R1/T1R3(见图1中A)被鉴定为氨基酸受体,能对20种标准氨基酸中的大部分产生响应[58]。Grace等人在添加钠离子通道阻滞剂阿米洛利以去除钠离子影响的前提下,分别敲除T1R1,T1R2,T1R3亚基,发现亚基T1R1和T1R3同时存在时才能对谷氨酸钠、丝氨酸、L-AP4等多种鲜味物质的刺激产生响应,并且在核苷酸的存在下鲜味响应显著增强,因此,T1R1/T1R3被确定为鲜味受体的最佳候选[59]。
3.2 味型mGluR4
mGluR4最初发现于大脑中(脑型mGluR4),随后的研究表明mGluR4在舌的轮廓乳头和叶状乳头的味觉受体细胞中也有表达(味型mGluR4)[60],但味型mGluR4是脑型mGluR4的截断形式,其胞外N末端氨基酸序列长度比脑型的短约50%(见图1中B)[61]。味型mGluR4主要由MSG及其某些类似物激活,未报道对核苷酸敏感。Nirupa等人通过RT-PCR、原位杂交等手段发现味型mGluR4能响应MSG类似物L-AP4的刺激,并将其作为鲜味受体的候选之一。目前关于味型mGluR4的生理作用究竟是识别鲜味物质还是参与鲜味信号传导还未达成共识[62],因此,还需更多证据来阐述味型mGluR4在鲜味感知中的具体功能。
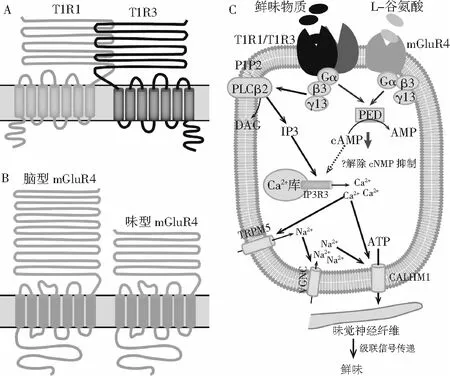
图1 鲜味受体及鲜味信号传导示意图Fig.1 Schematic diagram of umami receptor and umami signal transduction
4 T1R1/T1R3受体的鲜味识别机制
鲜味肽与鲜味受体相互作用是研究鲜味肽呈味特征、总结其呈味规律的有效途径,但对于鲜味肽的具体识别机制当前并没有定论,且目前关于鲜味配体与鲜味受体T1R1/T1R3相互作用的研究主要基于小分子鲜味物质。

5 鲜味信号传导途径
鲜味受体T1R1/T1R3能感知大多数鲜味物质,包括氨基酸、肽和核苷酸等[68],其鲜味传导主要由Gβγ介导(见图1中C)。鲜味物质与受体结合激活Gβ3γ13,导致磷脂酶Cβ2(PLCβ2)被活化并将膜脂PIP2转化为二酰基甘油(DAG)和1,4,5-肌醇三磷酸(IP3),IP3与III型IP3受体(IP3R3)结合,使Ca2+从离子库中释放到细胞内,从而激活Ca2+依赖性阳离子通道TRPM5,而激活的TRPM5会使味觉细胞去极化,进一步激活电压门控Na+通道并通过钙稳态调节蛋白1(CALHM1)[69,70]释放ATP至味觉细胞外,随后ATP信号传入味觉神经纤维上的离子型嘌呤受体,并通过级联信号传递被大脑感知味觉[71]。值得注意的是,在蕈状味蕾和腭味蕾中T1R1/T1R3的鲜味信号传导由Gα介导[72]。
对于味型mGluR4,其鲜味主要由Gα介导(见图1中C)。L-谷氨酸与受体结合激活Gα,进而活化磷酸二酯酶(PDE),使胞质内cAMP浓度降低,从而解除了环核苷酸(cNMP)对Ca2+离子通道的抑制作用,使Ca2+从离子库中顺利释放到胞内,进一步导致味觉细胞膜去极化和神经递质释放[73],后续的信号传导与T1R1/T1R3的一致。
在Gβγ介导的信号传导途径中,多项研究已证明由TRPM5通道引起的神经递质ATP的释放与味觉刺激引起的动作电位的频率成比例[74,75],因此该信号传导途径受到大部分学者认可,也一定程度证明了T1R1/T1R3是鲜味受体的最佳候选。在Gα介导的信号传导途径中,cAMP在该信号传导中的具体作用尚不清楚,并且其解除cNMP对离子通道的抑制作用也只是一种假设[76]。另外两项在其他组织中关于PLCβ2和IP3R3生理功能的研究表明两者通过cAMP依赖性磷酸化可降低胞内Ca2+的释放[77,78],因此,Sue认为在Gα介导的鲜味信号传导中cAMP的功能更可能调节Ca2+信号的释放,而不是激活Ca2+的释放。Clapp则详细地指出cAMP通过调节cAMP依赖性蛋白激酶A的活性可增强或抑制Ca2+的释放[79]。总的来说,对鲜味信号传导还需进一步的研究以加深对鲜味受体多样性及鲜味信号感知的理解。
6 展望
最近几年,为了加速鲜味肽的应用研究,学者们逐步对鲜味肽复合基料的酶解工艺及其美拉德反应等应用方面进行了一定的探索。鲜味通常与其他味感之间具有协同作用,故鲜味肽的应用并不需执着于提取单个鲜味肽,而可利用酶水解法制作复合的鲜味肽基料,直接作为鲜味调味料应用于食品中[80,81]。如刘通讯等直接将大豆复合呈味肽应用于酱油中的研究,提升了酱油的鲜味协调性[82];周超等人也直接研究了茶褐牛肝菌的酶解工艺,制作获得了鲜味突出,并含丰富呈味肽的复合基料[83]。这些研究为鲜味肽的具体应用提供了一定的参考,鲜味肽与其他呈味剂之间的复配应用可能是今后研究的主体方向。
当前,关于鲜味肽一级氨基酸序列的探究仍在继续,但新型鲜味肽的研究进度受到了限制,利用鲜味受体制备生物传感器检测鲜味物质的发展为鲜味肽的识别鉴定提供了一个高效快速的检测方式[84-86]。同时,在鲜味肽的结构特征方面,目前的研究侧重于其氨基酸性质和二级序列的初步分析上,对于鲜味肽三级结构上的呈味特征尚未完全定论。此外,对于鲜味肽与鲜味受体分子水平上的相互作用分析等研究也较少,且鲜味受体对不同鲜味物质的识别位点也各不相同,例如,鲜味受体识别L-Glu的关键残基为:Thr-149,Ser-172,Asp-192,Tyr-220和Glu-301,而识别IMP的关键残基为:His-71,Arg-277,Ser-306和His-308[87]。因此,需结合鲜味受体和鲜味肽的相互作用关键位点的分析,加深受体对鲜味肽识别机制的理解,并在此基础上有目的地改造、设计或合成新型鲜味肽,以期获得呈鲜效果更好的鲜味肽序列。
