电针对不同阶段SAMP8小鼠学习记忆能力、神经元超微结构及β-淀粉样蛋白、Tau蛋白水平的影响
2019-03-18杨文丹骆雍阳李斐斐洪苗苗王丰郑雪花董卫国
杨文丹 骆雍阳 李斐斐 洪苗苗 王丰 郑雪花 董卫国

摘要:目的 观察电针“百会”“大椎”“肾俞”对3月龄及9月龄SAMP8小鼠学习记忆能力及海马区β-淀粉样蛋白(Aβ)、Tau蛋白表达的影响,探讨电针治疗阿尔茨海默病的时机。方法 将SAMP8小鼠随机分为早期电针组(3月龄电针干预)、晚期电针组(9月龄电针干预)、模型组,以同龄正常老化SAMR1小鼠为对照组,并均于10月龄取材。采用Morris水迷宫实验检测小鼠学习记忆能力,透射电镜观察小鼠海马CA1区神经超微结构变化,免疫组化检测小鼠海马区Aβ、Tau蛋白的表达。结果 与晚期电针组比较,早期电针组小鼠逃避潜伏期明显缩短(P<0.05),原平台象限停留时间明显延长(P<0.05),跨越原平台次数明显增加(P<0.05),海马区Aβ、Tau蛋白异常表达明显减少(P<0.05),突触结构较完整,数量增加。结论 电针能提高SAMP8小鼠学习记忆能力,降低小鼠海马区Aβ、Tau蛋白的异常表达,改善神经元超微结构,且其疗效早期介入优于晚期介入。
关键词:阿尔茨海默病;电针;学习记忆;超微结构;β-淀粉样蛋白;Tau蛋白;SAMP8小鼠
中图分类号:R245 文獻标识码:A 文章编号:1005-5304(2019)02-0057-05
DOI:10.3969/j.issn.1005-5304.2019.02.013
开放科学(资源服务)标识码(OSID):
Abstract: Objective To observe the effects of electroacupuncture (EA) “Baihui”, “Dazhui”, and “Shenshu” on learning memory ability, ultrastructure of neurons, and expressions of Aβ and Tau in three-month old and nine-month old SAMP8 mice; To discuss the timing of EA for the treatment of Alzheimer disease (AD). Methods SAMP8 mice were randomly divided into three groups: early-stage-EA group (3-month-old EA), advanced-stage-EA group (9-month-old EA) and model group. Normally aged SAMR1 mice of the same age were set as the control group. Finally all mice were sacrificed in ten-month old. The learning and memory ability of mice was detected by Morris water maze test. The ultrastructural changes of hippocampal CA1 region were observed by transmission electron microscopy. The expressions of Aβ and Tau in hippocampus of mice were detected by immunohistochemistry. Results Compared with the advanced-stage-EA group, the escape latency of the early-stage-EA group was significantly shortened (P<0.05); the time spent in target quadrant was prolonged (P<0.05); the number of crossing was expanded (P<0.05); the aberrant expressions of Aβ and Tau in hippocampal CA1 region was attenuated (P<0.05); synaptic structure was more complete and the synaptic number increased. Conclusion EA can improve the learning and memory ability of SAMP8 mice, reduce the abnormal expressions of Aβ and Tau protein in hippocampus of mice, and ameliorate the ultrastructure of neurons. Especially the early intervention is superior to the late intervention.
Keywords: Alzheimer disease; electroacupuncture; learning and memory; ultrastructure; Aβ; Tau; SAMP8 mice
阿尔茨海默病(Alzheimer disease,AD)是一种与年龄相关的以进行性认知功能障碍和记忆损害为特征的中枢神经系统退行性疾病[1]。AD的主要病理特征为细胞外β-淀粉样蛋白(Aβ)沉积形成的老年斑(SP)和细胞内高度磷酸化Tau蛋白形成的神经纤维缠结(NFTs)[2]。在AD早期即出現突触障碍等特征[3-4]。针灸治疗AD具有多途径、多水平、多方式、多靶点的作用特点,且疗效可靠、不良反应少[5-6]。我们前期研究表明,益肾调督法电针能改善SAMP8小鼠学习记忆能力和突触超微结构,且能抑制Aβ的产生[7-8]。本实验以SAMP8小鼠为AD模型,比较电针对不同年龄段(3月龄和9月龄)SAMP8小鼠学习记忆能力、海马神经元超微结构及Aβ、Tau蛋白水平的影响,为电针治疗AD的时机选择提供依据。
1 材料与方法
1.1 动物
SAMP8小鼠36只及对抗快速老化小鼠亚系 SAMR1小鼠12只,3月龄,雄性,体质量20~25 g,北京大学医学部(实验动物科学部),动物许可证号SCXK(京)2016-0010。饲养于福建中医药大学动物实验中心SPF级动物实验室,温度(22±2)℃,相对湿度(55±15)%,12 h明暗交替,自由摄食饮水,适应性喂养1周。实验过程均严格按照国际动物保护及使用指南的规定进行,按实验动物3R原则给予人道关怀。
1.2 主要试剂与仪器
华佗牌无菌针灸针(0.25 mm×15 mm)、华佗牌SDZ-Ⅱ电针仪,苏州医疗用品厂有限公司;Morris水迷宫系统,中国医学科学院药物研究所;H-7650型透射电镜,日本Hitachi公司;电镜CCD相机-图像采集分析系统,德国Soft-Imaging-System公司。Tau (Tau-5)单克隆抗体(AHB0042),Thermo Fisher Scientific公司;Anti-β-Amyloid(6E10)单克隆抗体(SIG-39300),Covance/Biolegend公司;UltraSensitive TMS-P超敏试剂盒 (鼠/兔)与DAB试剂盒,福州迈新生物工程有限公司;Motic Med 6.0数码医学图像分析系统。
1.3 分组
将36只SAMP8小鼠随机分为模型组、早期电针组、晚期电针组(由3月龄SAMP8小鼠喂养至9月龄),每组12只。将12只SAMR1小鼠作为空白对照组。
1.4 干预
根据前期研究,采用自制网兜固定小鼠,选取“百会”“大椎”及双侧“肾俞”进行电针治疗[7-8],取穴参照《实验针灸学》[9],“百会”向前斜刺2 mm,“大椎”向下斜刺2~3 mm,“肾俞”稍向内斜刺3~4 mm,其中电针正负极分别施于“大椎”“肾俞”(双侧交替)。进针后,不进行手法刺激,连接电针仪进行治疗,施以连续波,频率2 Hz,电流强度以小鼠肢体微颤为宜。留针20 min,每日1次,8 d为1个疗程,疗程间隔2 d,共3个疗程,计30 d。早期电针组和晚期电针组分别在3月龄和9月龄进行电针干预,模型组和空白对照组不进行电针干预,在相同时间以相同方式固定和抓握。最终48只小鼠均在10月龄于水迷宫实验后进行取材。
1.5 Morris水迷宫实验
水迷宫测试包括定位航行实验和空间探索实验。水迷宫外观为直径120 cm、高60 cm、水深15 cm的圆形水池,水池侧面均光滑;控制水温为(25±2)℃,给予小鼠圆形站立平台直径为8 cm,平台位于第三象限,没于水下1 cm。定位航行实验:实验每日分上午、下午2个时间段,每个时间段小鼠训练4次,将小鼠分别从4个入水点(各象限池壁中点)面向池壁放入水中,记录小鼠爬上平台所需时间,即逃避潜伏期,如90 s内未找到平台则将其引至平台并在平台停留10 s,记录逃避潜伏期为90 s,连续进行5 d。空间探索实验:第6日撤去平台,将小鼠从第一象限池壁中点放入池中,自由游泳90 s后结束实验;记录小鼠在原平台象限停留时间与跨越平台次数。
1.6 透射电镜观察
水迷宫实验结束后,小鼠腹腔注射10%水合氯醛(350 mg/kg)麻醉,迅速取出脑组织,置于2.5%戊二醛固定液中,分离出海马,切取左右两侧海马CA1区约1 mm×1 mm×1 mm,左右两侧各取3~4小块,3%戊二醛-1.5%多聚甲醛前固定3 d,1%锇酸水溶液4 ℃后固定2 h,梯度乙醇、丙酮脱水,环氧树脂包埋剂包埋,37、45、60 ℃分别聚合,常规半薄切片,美兰-天青染色,光镜观察并定位,常规超薄切片,铜网捞片,切片分别经2%醋酸铀水溶液染色20 min,柠檬酸铅染色15 min;透射电镜观察切片,先在低倍镜下全面定位和观察海马神经元,再在高倍镜下观察突触形态,并用电镜CCD相机进行图像采集与分析。
1.7 免疫组化染色
水迷宫实验结束后,小鼠腹腔注射10%水合氯醛(350 mg/kg)麻醉,仰卧位固定于手术台上,剪开胸腔,暴露心脏,从心尖插入灌注针至左心室,同时剪开右心耳,快速注入37 ℃生理盐水80 mL冲洗,后注入4%多聚甲醛80 mL灌流固定。取全脑修块后迅速放入4%多聚甲醛内4 ℃固定24~48 h。常规梯度乙醇脱水、透明、浸蜡、石蜡包埋。自上丘至视交叉节段作冠状连续切片(厚4 μm)。二甲苯脱蜡,梯度乙醇水化,将黏附脑组织的载玻片置于0.01 mol/L柠檬酸修复液(pH 6.0),微波炉法抗原修复8 min,降至室温。UltraSensitive TMS-P超敏试剂盒(鼠/兔)检测,严格按照试剂盒说明书操作。一抗加入Tau-5抗体(1∶200)、6E10抗体(1∶100),4 ℃湿盒中孵育过夜。加入生物素标记的羊抗鼠/兔IgG二抗,DAB显色,脱水,透明,封片。用PBS代替一抗作阴性对照。用Motic Med 6.0数码医学图像分析系统对海马CA1区Aβ、Tau-5的图片进行分析,计算Aβ及Tau-5的平均光密度(MOD)。
1.8 统计学方法
采用SPSS21.0统计软件进行分析。实验数据以±s表示,采用方差分析,组间两两比较用LSD法。P<0.05表示差异有统计学意义。
2 结果
2.1 Morris水迷宫实验结果
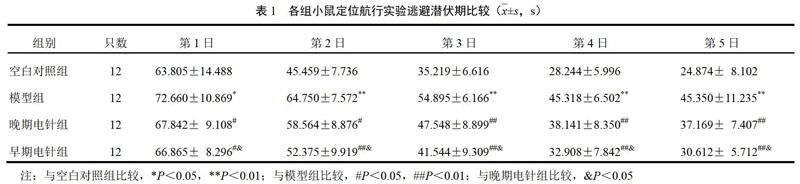
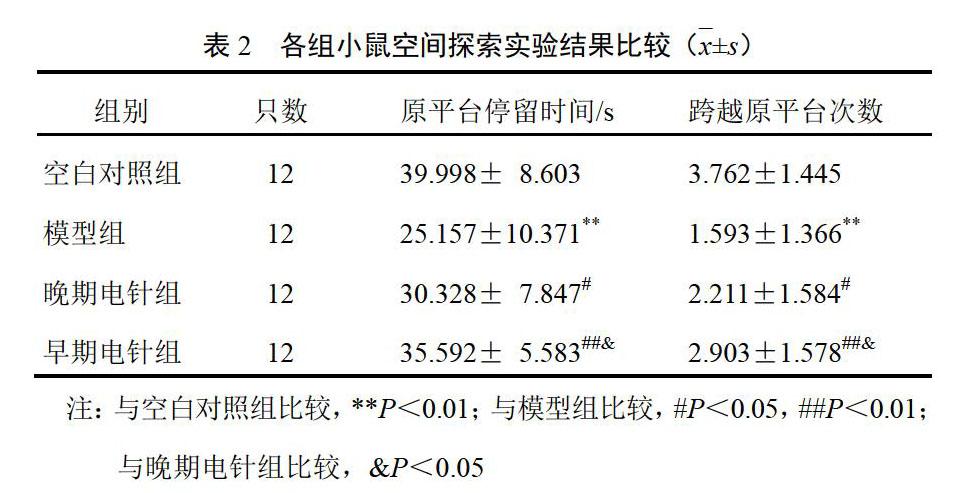
与空白对照组比较,模型组小鼠逃避潜伏期延长,原平台象限停留时间缩短,跨越平台次数减少(P<0.05,P<0.01);与模型组比较,早期电针组和晚期电针组小鼠逃避潜伏期缩短,原平台象限停留时间延长,跨越原平台次数增加(P<0.05,P<0.01);与晚期电针组比较,早期电针组平均逃避潜伏期、停留时间及跨越原平台次数差异均有统计学意义(P<0.05)。见表1和表2。
2.2 透射电镜观察结果
空白对照组突触结构完整,突触前、后膜分界清晰,突触小泡密集,溶酶体与脂褐素数量较少;模型组突触结构不完整,突触前、后膜分界不清,突触小泡密集溶酶体与脂褐素数量最多;晚期电针组和早期电针组突触数量较多,结构清晰完整且早期电针组较晚期电针组突触结构更好。
2.3 免疫组化染色结果
光镜下小鼠海马CA1区Aβ主要沉积于神经元外,微管相关蛋白Tau主要位于神经元胞质中。与空白对照组比较,模型组小鼠Aβ阳性表达不明显,Tau阳性表达明显,MOD值均明显升高(P<0.01);与模型组比较,晚期电针组和早期电针组小鼠Aβ和Tau MOD值明显降低(P<0.01),且早期电针组降低更明显(P<0.05,P<0.01)。见表3。
3 讨论
AD属中医学“呆症”“健忘”等范畴,人至老年,肾精渐衰,髓海不足,加之脾虚生痰,痰浊蒙窍则呆钝善忘。百会位于头之巅顶,为百脉之所会,内应于脑,《黄帝明堂灸经》记载百会主治“忘前失后,心神恍惚”。其具有开窍醒神、补脑益智之功,为治疗髓海不足健忘、老年性痴呆的要穴。大椎为手足三阳经与督脉之交会穴,总督一身之阳气,是升阳开窍,健脑调神的效穴。大椎与百会均在督脉上,两穴结合可使诸经通调,促进经气的运行,增强了联络各脏腑经絡的功效,增加了濡养脑髓的气血,促进了阴阳平衡的调节;肾俞位于膀胱经上,具有补益肾脏、充填脑髓、健脑的功效,《灵枢·经脉》记载“足太阳膀胱之脉……其直者,从巅入络脑”。肾为先天之本,藏精、生髓。肾俞是肾脏的背俞穴,肾中精气都汇集于此穴,肾经与督脉相连,一起入髓联络脑海,共同主宰一身的阳气。三穴相配共奏益肾调督的作用。因此,结合经典论述并参考“益肾调督”电针法治疗AD的相关文献[10-13]及我们前期研究[7-8],本实验选取大椎、百会、肾俞为治疗腧穴。
AD主要病理特征是Aβ沉积、高度磷酸化Tau蛋白及突触障碍等,集中发生在和学习记忆功能与信息处理密切相关的海马、大脑皮质等部位。Aβ是由β-淀粉样前体蛋白(APP)降解所产生,其在脑内位于细胞外,主要以Aβ40和Aβ42形式存在,其中含量较低的Aβ42易于聚集为原纤维而沉积形成弥漫性SP。AD大脑中Aβ异常表达,高浓度Aβ对成熟的神经元有毒性作用,可致细胞凋亡、Tau蛋白过磷酸化,最终形成SP和NFTs等。Tau蛋白是一种能与微管蛋白相结合,并对微管的形成起促进与稳定作用的细胞骨架相关蛋白。AD患者脑中Tau蛋白发生异常修饰,有过度糖基化、磷酸化和泛素化而形成双螺旋结构。异常磷酸化的Tau蛋白有不可溶性,会阻碍微管组装,导致神经元骨架蛋白结构异常和神经元死亡。因此,Aβ和Tau蛋白常作为AD的治疗靶点和观测指标。本实验结果显示,与晚期电针组和模型组比较,早期电针组能显著降低AD模型Aβ和Tau蛋白的水平。
SAMP8小鼠是由日本京都大学竹田俊男培育成功并被广泛应用于AD研究的动物模型,其特点是学习记忆功能随年龄进行性快速衰退。SAMP8小鼠脑内的神经病理学变化能较好地模拟AD脑内的病理变化。有研究表明,4月龄SAMP8小鼠即出现包括学习记忆力损害的行为异常改变表型,5月龄SAMP8小鼠脑内即出现Tau蛋白增多及Tau蛋白高度磷酸化,6月龄SAMP8小鼠脑内海马区即有Aβ蛋白的异常沉积[14-16]。本实验采用SAMP8小鼠为AD模型;SAMR1小鼠有与SAMP8小鼠相似的遗传背景,但未表现衰老相关的神经显型,作为空白对照。
美国国立老化研究院(NIA)和阿尔茨海默病协会(AA)于2011年发表NIA-AA诊断标准,该标准进一步强调AD的连续性,病理生理进程在AD临床症状出现的15~20年前就已开始,并将AD分为3个阶段,即AD临床前阶段、AD源性轻度认知障碍和AD痴呆阶段。将AD的临床前无症状阶段也纳入了AD,这大大地前移了AD的诊断。IWG-1诊断标准首次将生物标记物(包括脑脊液Aβ1-42的下降、总Tau蛋白或磷酸化Tau蛋白的升高等)纳入AD诊断,并将早期轻度认知障碍阶段也归入AD的诊断;此外,基因检测为AD的早期临床治疗提供了可能性。
大量研究显示,电针可改善AD模型学习记忆能力与突触超微结构,并抑制其脑内Aβ及Tau蛋白的异常表达[7-8,17-19]。已有研究显示电针“早治疗”的优势,与缺血形成后治疗比较,早期督脉电针慢性脑缺血大鼠可明显降低炎性因子含量[20];早期电针治疗能显著增加局灶性脑缺血大鼠缺血脑皮质胰岛素样生长因子-1的蛋白和mRNA表达[21]。本实验结果显示,早期电针对AD模型疗效较好,这一结果正契合中医“未病先防,既病防变”的“治未病”理论。
本研究以3月龄SAMP8小鼠模拟AD早期,即未见明显记忆力减退及Aβ、Tau蛋白异常表达时期;以9月龄SAMP8小鼠模拟AD晚期,即记忆力减退及Aβ、Tau蛋白显著异常表达时期。2组均采取电针干预,检测并对比行为学及病理状态均不同的2个时点电针干预后的效果,为临床电针治疗AD时机的选择提供参考。目前,AD发病机制尚不明确且缺乏特效药,临床多是在AD中晚期才发现并介入治疗,效果差强人意。
综上,AD早期电针介入能有效改善SAMP8小鼠的学习记忆能力、突触超微结构,减少Aβ、Tau蛋白的异常表达,其疗效优于AD晚期电针介入治疗。这一结果与“AD应早期治疗”的观点相吻合。但电针对SAMP8小鼠的疗效是否随月龄成几何相关及其具体机制仍待进一步研究。
参考文献:
[1] HARDY J, SELKOE D J. The amyloid hypothesis of Alzheimer's disease:progress and problems on the road to therapeutics[J]. Science,2002,297(5580):353-356.
[2] QUERTURTH H W, LAFERLA F M. Alzheimer's disease[J]. N Engl J Med,2010,362(4):329-344.
[3] SHENG M, SABATINI B L, S?DHOF T C, et al. [Molecular Pathology] Synapses and Alzheimer's disease[J]. Cold Spring Harbor Perspectives in Biology,2012,4(5):747-749.
[4] SELKOE D J. Alzheimer's disease is a synaptic failure[J]. Science,2002,298(5594):789-791.
[5] 岳进,聂慧,李荣华.针灸治疗老年性痴呆的神经生物机制实验研究进展[J].上海针灸杂志,2009,28(3):183-185.
[6] CHENG H Y, YU J C, JIANG Z G, et al. Acupuncture improves cognitive deficits and regulates the brain cell proliferation of SAMP8 mice[J]. Neuroscience Letters,2008,26(8):111-116.
[7] DONG W G, WANG F, CHEN Y, et al. Electroacupuncture reduces Aβ production and BACE1 expression in SAMP8 Mice[J]. Frontiers in Aging Neuroscience,2015,10(7):148-155.
[8] 李斐斐,楊珺,杨文丹,等.电针百会、大椎、肾俞穴对SAMP8小鼠学习记忆与海马CA1区神经元突触的影响[J].中国康复理论与实践,2017, 23(11):1278-1283.
[9] 余曙光,郭义.实验针灸学[M].北京:人民卫生出版社,2012:252.
[10] 陈阳阳,孔立红,孙国杰,等.“益肾调督”针灸法对AD大鼠血清Aβ及海马APP表达的影响[J].时珍国医国药,2016,27(9):2289-2291.
[11] 何勋,于杰,孙国杰,等.益肾调督法针灸对阿尔茨海默病模型大鼠海马神经元线粒体融合蛋白的影响[J].中国预防医学杂志,2014,15(3):187-190.
[12] 崔翔,马冉,唐萁,等.益肾调督针灸法对AD大鼠海马线粒体CypD的影响[J].中华中医药杂志,2014,29(7):2374-2376.
[13] 沈峰,孙国杰,杜艳军,等.针灸从益肾调督论治老年痴呆探讨[J]. 湖北中医药大学学报,2013,15(2):44-46.
[14] YANAI S, ENDO S. Early onset of behavioral alterations in senescence-accelerated mouse prone 8 (SAMP8)[J]. Behavioural Brain Research,2016,308(4):187-195.
[15] CANUDAS A M, GUTIERREZ-CUESTA J, RODR?GUEZ M I, et al. Hyperphosphorylation of microtubule-associated protein tau in senescence-accelerated mouse (SAM)[J]. Mechanisms of Ageing & Development,2005,126(12):1300.
[16] DEL V J, DURAN-VILAREGUT J, MANICH G, et al. Early amyloid accumulation in the hippocampus of SAMP8 mice[J]. Journal of Alzheimers Disease Jad,2010,19(4):1303.
[17] 王鑫,加吾拉·阿不力孜,李芙,等.电针对APP/PS1双转基因小鼠行为学及皮层Aβ1-42、LRP1表达的影响[J].中华中医药杂志,2015, 30(5):1513-1518.
[18] 薛卫国,张忠,许红,等.电针对淀粉样前体蛋白转基因小鼠海马微血管淀粉样沉积的影响及其与低密度脂蛋白相关受体1的关系[J].针刺研究,2011,36(2):95-100.
[19] 郎尉雅,张海燕,刘忠锦.电针对SAMP8小鼠行为学及APPmRNA和BACE-1mRNA影响[J].中国临床解剖学杂志,2015,33(5):563-567.
[20] 刘丹,张子凡,赵小康.督脉电针早期干预对慢性脑缺血大鼠IL-1β和TNF-α表达的影响[J].辽宁中医杂志,2014,41(9):1844-1845.
[21] 肖娜,向珩,黄力平,等.早期穴位电针治疗对局灶性脑缺血大鼠脑缺血皮质胰岛素样生长因子-1表达的影响[J].中华物理医学与康复杂志, 2014,36(1):16-20.
