胃炎康方对慢性非萎缩性胃炎患者胃泌素相关基因调控通路影响
2019-03-18彭艳红蒋亦昕白光王庆峰
彭艳红 蒋亦昕 白光 王庆峰
摘要:目的 采用網络药理学预测胃炎康方的作用靶点,以临床样本验证该靶点的准确性,确定胃炎康方的分子机制。方法 采用随机数字表法将112例慢性非萎缩性胃炎患者分为治疗组和对照组各56例。对照组采用西医常规治疗;治疗组予胃炎康方,每日1剂,水煎,每日2次口服。2组均连续治疗4周。分析2组临床疗效。采用生物信息学手段挖掘胃炎康方潜在调控基因,预测其作用于胃炎的靶点。应用免疫组化法分析胃部组织样本以验证胃炎康方的作用机制。结果 治疗组总有效率为87.5%(49/56),对照组为78.6%(44/56),2组比较差异无统计学意义(P>0.05)。胃镜显示2组胃部病理学结构均好转,差异无统计学意义(P>0.05)。通过网络药理学对胃炎康方作用的靶基因进行预测,其胃泌素相关的靶基因包括前列腺素G/H合成酶2、B细胞κ轻肽基因增强子抑制因子、磷脂酰肌醇-3激酶催化亚基δ及前列腺素F2α受体。并预测胃炎康方可基由PTGS2→IKBKB的信号通路,抑制胃泌素所致的炎症反应。通过胃炎康方治疗的临床样本分析,基本验证以上推论。结论 胃炎康方通过对PTGS2、IKBKB、PIK3CD、PTGFR等靶基因的调控激活相应信号通路而发挥治疗作用。采用网络药理学手段可快速预测复方作用靶点,应用该方法可解释复方对相关疾病的治疗机制,并提供新的研究手段。
关键词:网络药理学;生物信息学;慢性非萎缩性胃炎;基因靶点;信号通路
中图分类号:R259.733.1 文献标识码:A 文章编号:1005-5304(2019)02-0042-05
DOI:10.3969/j.issn.1005-5304.2019.02.010
开放科学(资源服务)标识码(OSID):
Abstract: Objective To predict the targets of Weiyankang Prescription by means of network pharmacology; To verify the accuracy of the targets with clinical samples to determine the molecular mechanism of Weiyankang prescription. Methods Totally 112 cases of chronic non-atrophic gastritis were divided into treatment group and control group, with 56 cases in each group. The control group was treated with Western medicine, and the treatment group was given Weiyankang Prescription, one dosage a day, decoction, orally twice a day. All were treated continuously for 4 weeks. The bioinformatics method was used to mine the potential regulatory genes of Weiyankang Prescription and predict its target in the treatment of gastritis. The gastric tissue samples were analyzed by immunohistochemistry to verify the mechanism of Weiyankang Prescription. Results The total effective rate was 87.5% (49/56) in the treatment group and 78.6% (44/56) in the control group, without statistical significance (P>0.05). Gastroscopic examination showed that the pathological structure of the stomach in both groups improved, without statistical significance (P>0.05). The target genes of Weiyankang Prescription were predicted by network pharmacology. The gastrin-related target genes included: prostaglandin G/H synthetase 2, B cell kappa light peptide gene enhancer inhibitor, phosphatidylinositol-3 kinase catalyzes the subunit δ and prostaglandin F2α receptor. It was predicted that Weiyankang Prescription could inhibit the inflammatory response caused by gastrin by the signal pathway of PTGS2→IKBKB. Through the analysis of clinical samples of Weiyankang Prescription treatment, the above inferences were basically verified. Conclusion Weiyankang Prescription can activate the corresponding signal pathway by regulating the target genes of PTGS2, IKBKB, PIK3CD and PTGFR, to realize the treatment of chronic gastritis. The use of network pharmacology can quickly predict the target of the compound acting on the disease. This method provides a new means to explain the therapeutic mechanism of compound prescription for related diseases.
Keywords:network pharmacology; bioinformatics; chronic non-atrophic gastritis; gene targets; signal pathway
慢性非萎缩性胃炎(chronic non-atrophic gastritis,CNAG)表现为胃部黏膜处慢性炎症细胞浸润,并未伴随胃黏膜萎缩性病变,仅影响胃黏膜表层上皮,未至胃黏膜深处腺体。CNAG日久会导致萎缩性胃炎,引发胃黏膜固有腺体萎缩、肠上皮化生及不典型增生等,增加进一步癌变的风险。CNAG发病机制目前尚不明确,其发病原因与幽门螺杆菌(Hp)感染,胆汁反流,血管活性因子、细胞因子失调及免疫相关因素等有关[1]。该病分子靶点涉及血管活性肠肽[2]、趋化因子10[3],及白细胞介素(IL)-11[4]等。林志强等[5]研究表明,TLR信号通路在CNAG发病过程中具有调控作用。胃炎康方为辽宁中医药大学附属医院(以下简称本院)院内制剂,功效疏肝泄热、和胃止痛。为探讨该方改善胃部炎症的路径,本研究对胃炎康方进行网络药理学分析,获取其潜在作用靶点,并通过string数据库找到同上述潜在靶点相关的互作基因,并检测胃黏膜样本,明确上述基因的调控情况,以探究胃炎康方作用机制。
1 资料与方法
1.1 一般资料
选择本院消化内科2017年1月-2018年1月CNAG患者112例,采用数字随机表法分为对照组和治疗组各56例。对照组男性36例,女性20例,平均年龄48.6岁;治疗组男性31例,女性25例,平均年龄49.2岁。2组患者一般资料比较差异无统计学意义(P>0.05)。本研究经由本院伦理委员会审查批准[2017028ND(KT)-031-07]。
1.2 诊断标准
参照《中国慢性胃炎共识意见(2017年,上海)》[6]及《慢性胃炎内镜的分型分级标准及治疗的试行意见》[7]确定诊断标准。①病程较长,且均呈现各种程度的胃脘胀痛;②胃部感觉胀满,厌食,餐后出现恶心反酸;③内窥镜确诊胃部炎症,目镜下可见胃部黏膜有红斑、黏膜皱襞变平甚至消失,胃部黏膜水肿或有渗出,可见血管透出;④胃部经内窥镜确认,无萎缩症状发生。
1.3 排除标准
①伴胃部萎缩性病变者;②3个月内出现消化系统感染者;③存在其他免疫系统疾病史者;④伴癌症、器官衰竭等严重疾病者;⑤伴精神疾病及不愿配合本研究开展者。
1.4 治疗方法
对照组采用常规西医治疗(克拉霉素、奥美拉唑、曲昔匹特)。治疗组予胃炎康方(黄连10 g、蒲公英15 g、栀子15 g、黄芩10 g、佩兰10 g、佛手10 g、陈皮10 g、砂仁10 g、白术10 g、甘草5 g,本院药剂科制备),水煎服,每日1剂,每日2次口服。2组均治疗4周。
1.5 疗效标准
参照《中药新药临床研究指导原则(试行)》[8]制定。临床痊愈:临床症状体征消失,胃镜复查及病理组织活检证实黏膜慢性炎症明显好转达轻度;显效:临床主要症状体征消失,胃镜复查及病理组织活检证实黏膜慢性炎症好转;有效:主要症状、体征明显减轻,胃镜复查及病理组织活检证实慢性炎症减轻1个级度以上;无效:临床症状无改善,胃镜复查及病理组织活检证实黏膜慢性炎症无变化或加重。
1.6 网络药理学分析
根据药物的君臣佐使构成,将胃炎康方分为4个簇(cluster)。cluster1为君药蒲公英、栀子;cluster2为臣药黄连、黄芩、佩兰、佛手;cluster3为佐药陈皮、砂仁、白术;cluster4为使药甘草。以BATMAN- TCM数据库对胃炎康方进行模拟以获得其作用靶点,其中,设定划界分数为20,P值为0.05。根据BATMAN-TCM数据库所获得的数据挖掘结果,对所获得的靶基因进行KEGG及GO分析,推测其对应的疾病/基因/信号通路信息,并进一步进行功能富集。
1.7 靶基因及信号通路验证
PTGS2(abcam公司,Anti-COX2/Cyclooxygenase2抗体,兔单克隆抗体,批号ab21704),IKBKB(abcam公司,Anti-IKKα+IKβ抗体,兔单克隆抗体,批号ab178870),PIK3CD(天津赛尔生物技术有限公司PIK3CD抗体,兔单克隆抗体,批号SRP01115),PTGFR(abcam公司Anti-PTGFRN抗体,兔多克隆抗体,批号ab224392)。
患者治疗前后经内窥镜取胃黏膜组织,首先进行样品预处理,常规免疫组化法进行测定[9]。组织冷冻切片后,常规二甲苯脱蜡,水化;3%H2O2处理15 min封闭内源性的过氧化物酶,5%山羊血清处理30 min封闭非特异性结合位点;以抗体进行孵育,稀释比例1∶100,过夜。再按说明书选用对应的免疫组化检测试剂孵育,常规DAB染色,苏木精复染,脱水透明后封片。免疫组化染色结果判定[10]:随机抽选片内5个高倍視野(×400)进行观察,无染色阳性细胞计0分,染色阳性细胞百分率<10%计1分,10%~50%计2分,>50%~80%计3分,>80%计4分。根据多数阳性细胞呈现的染色强度计分:无着色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分。病理阅片及染色积分判定由2名病理医师采用双盲评估法观察完成。计算染色强度积分与阳性细胞百分率积分的乘积,<6分判为低表达,≥6分判为高表达[11]。
1.8 统计学方法
采用SPSS20.0统计软件进行分析。组间比较采用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 2组临床疗效及胃镜结果比较
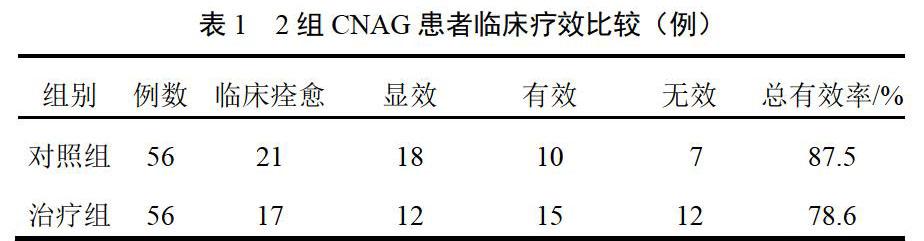
2组总有效率比较,差异无统计学意义(P>0.05),见表1。
胃镜显示,2组患者治疗前胃镜下见黏膜皱襞变平甚至消失,黏膜红白相间,以白色为主,可见血管透出,炎症反应明显。2组治疗后患者胃部病理学结构均有好转,可见炎症好转或消失,血管无透出,黏膜皱襞恢复。
2.2 胃炎康方靶基因及信号通路预测
胃炎康方君臣佐使4个簇中,重叠的靶基因共计254个。进一步对所获得的数据进行分析,以确定其改善胃炎症状的信号通路。
最终推知胃炎康方作用于CNAG的主要靶点集中在以下方面。①炎症抑制:主要基于核因子-κB(NF-κB)信号通路,调控的靶点为基因IL-1β→NF-κB;②Hp所致胃炎机制调控:主要基于对IL-1β的调控作用;③胃泌素调控通路[13]:主要基于PTGS2、IKBKB、PIK3CD、PTGFR基因实现对胃酸分泌抑制的调控。其基因互作关系(string数据库),预测作用于胃泌素信号通路的方式(OmicsNet数据库)。
2.3 临床样本验证
选择部分患者胃黏膜组织进行HE染色,依据全部的观察组染色片,对PTGS2、IKBKB、PIK3CD、PTGFR基因在治疗组治疗前后的高表达情况制作维恩图。
治疗前2例患者的4个对应靶基因均呈现高表达状态。有患者亦出现了3个或2个靶基因重叠高表达状态。表明所选定的靶点基因与CNAG高度相关。治疗后患者临床症状好转,靶基因表达大幅下降,在患者组织样本内呈现低表达或表达抑制,未出现3个或4个靶基因重复高表达,2个以上靶基因重复高表达的样本也大幅降低(由15例降低至3例)。治疗后,PIK3CD、PTGFR表达均大幅下降,仅1例患者呈现PIK3CD高表达(治疗前为15例),2例患者呈现PTGFR高表达(治疗前为22例)。
3 讨论
CANG为胃黏膜上皮遭受反复损害导致固有腺体的减少,或伴纤维替代肠腺化生和/或假幽门腺化生。发病过程为正常胃黏膜→Hp感染→急性Hp感染→慢性Hp感染→非萎缩性胃炎→萎缩性胃炎→肠上皮化生→上皮内瘤变[13],可见,Hp参与了关键环节。人体感染Hp后,胃泌素生成明显增加,刺激胃酸分泌[14],从而诱发/加重胃炎症状。故治疗上除根除Hp外,还应阻遏胃泌素诱发胃部炎症反应。
本研究显示,患者胃部病理学特征明显改善。为了进一步确定其作用机制,我们应用网络药理学手段对胃炎康方进行分析。基于结果预测可知,胃炎康方直接抑制炎症,或基于IL-1β分子抑制Hp所致的胃部炎症。根据临床样本免疫组化结果可知,胃炎康方主要作用于PTGS2、IKBKB、PIK3CD、PTGFR。PTGS2为双功能酶,作为前列腺素内氧化酶还原酶,具有环氧化酶和过氧化氢酶活性,可催熟花生四烯酸转化为前列腺素,在胃炎发病的过程中常同胃泌素表达呈正相关。有研究显示,随着Hp的感染与刺激,患者体内胃泌素不断分泌[15],PTGS2在胃部组织内表达亦会上调[16],从而增加组织内前列腺素含量,诱发炎症反应。从OmicsNet及string数据库的预测结果可以看出,作为PTGS2的下游蛋白,IKBKB的表达会随着PTGS2表达上/下调而上/下调。二者相关性亦在巨噬细胞的药物实验中得到验证[17]。
IKBKB是复合物中介导NF-κB活化经典途径的关键上游蛋白[18],NF-κB又介导后续的炎症反应。PIK3CD同上游蛋白的IKBKB互相作用,虽并未在胃炎患者的人体内证实,但二者密切相关,常出现于胰岛素代谢异常的患者体内[19]。研究显示,PIK3CD在胃癌的发病过程中起到了重要作用,常在胃癌患者的癌旁组织内过表达[11,20-21]。而且,其在消化系统癌患者的发病过程中与IKBKB的表达存在相关性[22]。本研究显示,虽然在患者体内IKBKB表达出现异常,仅2例出现PIK3CD高表达异常,且治疗后均呈现明显下调趋势。由此推测,IKBKB→PIK3CD在萎缩性胃炎→肠上皮化生→上皮内瘤变的阶段发挥了重要作用。
同IKBKB→PIK3CD类似,PTGFR表达仍较低,PTGFR的过表达常出现于肿瘤或炎症患者,其可通过ROCK途径参与胆管等器官纤维化过程[23-24]。其上游启动子为COX等酶类。在本研究中,PTGS2与PTGFR的表达关系密切。可以推测,随着萎缩性胃炎的发生,PTGS2会进一步上调PTGFR,发生胃壁纤维化,从而介导后续的肠上皮化生。鉴于本研究仅以CNAG患者为样本进行研究,无法确认PIK3CD及PTGFR与患者胃炎发病分级间的相关性,其相互关系尚需进一步研究。
綜上所述,胃炎康方可显著下调患者黏膜PTGS2、IKBKB表达,进一步调节二者下游PIK3CD、PTGFR,由此改善患者胃炎症状。
参考文献:
[1] 奚锦要,朱永钦,朱永苹,等.中药复方辨证论治慢性萎缩性胃炎的临床研究进展[J].时珍国医国药,2016,27(12):2978-2980.
[2] 郭昱,郭霞,姚希贤.慢性萎缩性胃炎胃泌素、生长抑素、表皮生长因子、血管活性肠肽的测定及临床意义[J].世界华人消化杂志,2003, 11(5):531-534.
[3] 何甜,唐慧,郭强,等.趋化因子10在慢性非萎缩性胃炎、胃癌癌前病变及胃癌中的表达及意义[J].重庆医学,2014,43(4):388-390.
[4] 黄懋敏,董丹丹,亓丹丹,等.慢性萎缩性胃炎患者Hp感染与TGF-βRⅡ、IL-6和TNF-α的表达研究[J].中国免疫学杂志,2018,34(5):751-756.
[5] 林志强,王大璇,洪珊珊,等.香砂六君子汤对菌致慢性萎缩性胃炎TLR信号通路的影响[J].中国中药杂志,2016,41(16):3078-3083.
[6] 中华医学会消化病学分会.中国慢性胃炎共识意见(2017年,上海)[J].中华消化杂志,2017,37(11):721-738.
[7] 中华医学会消化内镜学分会.慢性胃炎的内镜分型分级标准及治疗的试行意见[J].中华消化内镜杂志,2004,21(2):77-78.
[8] 郑筱萸.中药新药临床研究指导原则(试行)[M].北京:中国医药科技出版社,2002.
[9] CUI M, YU W, DONG J, et al. Downregulation of ABI1 expression affects the progression and prognosis of human gastric carcinoma[J]. Med Oncol,2010,27(3):632-639.
[10] 崔梅花,张欣焱,乙国兴,等.酿酒酵母菌抗原在炎症性肠病结肠组织中的表达及意义[J].中华临床医师杂志(电子版),2011,5(4):986-989.
[11] 乔世峰,王季堃,李世正,等.PIK3CD基因沉默可抑制胃癌HGC-27细胞的体外增殖和迁移[J].肿瘤,2015,35(1):24-30.
[12] 陈国胜.胃泌素/CCK2R通过JAK2/STAT3通路上调COX-2表达诱导胃癌细胞增殖[D].南京:南京医科大学,2015.
[13] 张利红,程静静,夏和先,等.幽门螺杆菌感染与慢性胃炎和胃癌的致病机制研究进展[J].国际检验医学杂志,2016,37(22):3165-3167.
[14] CAO X, TSUKAMOTO T, NOZAKI K, et al. Severity of gastritis determines glandular stomach carcinogenesis in helicobacter pylori-infected mongolian gerbils[J]. Cancer Sci,2007,98(4):478-483.
[15] 喻德林,胡希亚.幽门螺杆菌根除性治疗对慢性胃炎患者胃泌素及细胞因子的影响[J].现代消化及介入诊疗,2016,21(4):619-622.
[16] SAUKKONEN K, RINTAHAKA J, SIVULA A, et al. Cyclooxygenase-2 and gastric carcinogenesis[J]. APMIS,2003,111(10):915-925.
[17] WANG Q S, XIANG Y, CUI Y L, et al. Dietary blue pigments derived from genipin, attenuate inflammation by inhibiting LPS-induced iNOS and COX-2 expression via the NF-κB inactivation[J]. PLoS One, 2012,7(3):e34122.
[18] 陈文标,杨维群,刘立飞,等.胃癌组织中Keap1、IKKβ蛋白表达及意义[J].胃肠病学和肝病学杂志,2016,25(6):638-641.
[19] VELLA V, NICOLOSI M L, GIULIANO S, et al. PPAR-γ agonists as antineoplastic agents in cancers with dysregulated IGF axis[J]. Front Endocrinol (Lausanne),2017,8:31.
[20] 王雷,蔡冰.PIK3CD表達量检测对胃癌临床病理分期及恶性程度的评估价值[J].海南医学院学报,2016,22(9):924-927.
[21] 乔世峰,李世正,佟鑫.PIK3CD表达上调与胃癌临床病理特征及患者预后的相关性[J].中国肿瘤生物治疗杂志,2015,22(1):62-66.
[22] BR?CHER B L, LI Y, SCHNABEL P, et al. Genomics, microRNA, epigenetics, and proteomics for future diagnosis, treatment and monitoring response in upper GI cancers[J]. Clin Transl Med,2016, 5(1):13.
[23] OLMAN M A. Beyond TGF-beta:a prostaglandin promotes fibrosis[J]. Nat Med,2009,15(12):1360-1361.
[24] 李常恩,姚英民,韩少山,等.胆管良性瘢痕组织中前列腺素F2α受体及前列腺素合酶2的表达及意义[J].中国普外基础与临床杂志,2011, 18(12):1283-1287.
