超声微泡靶向基质金属蛋白酶抑制剂1下调的腺病毒治疗大鼠肝纤维化效果
2019-03-08张燕范晓翔章美武庄鲁辉毛达峰
张燕 范晓翔 章美武 庄鲁辉 毛达峰
宁波市第二医院介入治疗科(浙江宁波315010)
肝纤维化是肝硬化的基础,可由多种原因引起,病情呈动态进展,最终进入肝纤维化的不可逆期,即肝硬化阶段[1-2]。目前针对性治疗肝纤维化的方案甚少,仅少数药物处于临床试验阶段,其有效性尚不清楚[3]。国内外最新研究提示基质金属蛋白酶(MMPs)-基质金属蛋白酶抑制剂(TIMP)系统能调节细胞外基质的降解,且TIMP-1 的强表达会促进肝纤维化的进展[4]。此外,张燕等[5]发现转染反义TIMP-1 质粒载体可以显著降低大鼠肝纤维化模型中TIMP-l 及MMP-13 蛋白的表达,改善肝纤维化程度。以上提示肝纤维化的基因治疗方向可从抑制TIMP-1 入手,而如何有效导入下调TIMP-1基因表达的载体则令人困扰。腺病毒转染虽有较高效率,但其靶向性差、免疫原性偏大等缺陷使其开发应用停滞不前,改善腺病毒载体并降低机体免疫反应已成为临床工作亟需攻克的难点[6]。超声介导靶向微泡造影是国内较新的研究方向,多篇研究报道[7]显示其能安全有效地增加病毒转染,是一种重要的基因和药物载体,但其介导下调TIMP-1 基因表达载体影响肝纤维化的研究甚少报道。因此,本研究欲建立下调TIMP-1 基因的重组腺病毒(Ad-shTIMP-1),探究超声微泡的转染效率,分析基因治疗的价值,为肝纤维化的治疗提供有力证据。
1 材料与方法
1.1 实验材料
1.1.1 动物及分组 清洁级SD 大鼠由宁波市第二院实验动物中心提供,雌雄各半,平均体质量(200±20)g,每笼4 只,给予适宜温度(22 ℃),相对湿度保持在55%~70%,自由饮水及进食,每天光照∕黑暗各12 h,适应性喂养1周后进行后续实验。
1.1.2 试剂 CCl4AR 级(上海展云化工有限公司)、橄榄油CP 级(山东浩中化工科技有限公司);超声微泡造影剂SonoVue(意大利Bracco 公司);兔抗鼠MMP-13、TIMP-1 单克隆抗体、β 肌动蛋白(action)一抗及辣根过氧化物酶(HRP)标记二抗IgG(美国Santa Cruz 公司);丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、羟脯氨酸(Hyp)检测试剂盒(上海百祥生物科技有限公司);透明质酸(HA)、Ⅳ型胶原(CⅣ)、层粘连蛋白(LN)定量测定试剂盒(上海酶联生物科技有限公司);苏木素-伊红(HE)染色试剂盒、Masson 染色试剂盒(上海歌凡生物科技有限公司);RIPA 细胞裂解液、BCA 定量试剂盒和ECL 化学发光液(北京赛百盛基因技术有限公司)。
1.1.3 仪器 V-5100H 型可见分光光度计(上海元析仪器有限公司)、P5 彩色多普勒超声波诊断仪(美国GE)、3K15 离心机(德国Sigma 公司)、DXC800 全自动生化分析仪(美国Beckman 有限公司)、全自动冷冻石蜡切片机(广州兆康生物科技有限公司)、ECLIPSE Ts2R-FL 多功能倒置荧光显微镜(日本NIKON)、ELX800 酶标分析仪(美国Bio Tek)、Wellwash 全自动洗板机(美国Thermo 公司)。
1.2 下调TIMP-1 基因的重组腺病毒的构建、提纯及滴度测定 本研究所用靶向TIMP-1 的shRNA( 正 义 链 :GCCTTCGTAAAGACCTATAGTACTATAGGTCTTTACGAAGGC;反义链:GCCTTCGTAAAGACCTATAGTACTATAGGTCTTTACGAAGGC)重组腺病毒Ad-shTIMP-1 在上海汉恒生物科技有限公司辅助下涉及并构建,用增强绿色荧光蛋白(EGFP)标记,其构建方法及包装参考李汇等[8]的研究。腺病毒穿梭质粒构建成功并经酶切鉴定后,将重组正确的腺病毒质粒在大肠杆菌DH5a 扩增,凝胶回收。将重组腺病毒转染至HEK-293 细胞(融合达70%~80%)进行扩增,密切观察细胞病变效应(出现噬斑),3 000 r∕min 离心5 min,收集上清液。取部分上清液再次感染293 细胞,反复冻融、离心收集上清液,如此感染多次后在293 细胞中扩增到所需滴度1 × 1010pfu∕mL,定期监测EGFP 的表达。利用氯化铯密度梯度离心法纯化,TCID50 测定病毒滴度,同时采用实时荧光定量PCR 测定重组腺病毒TIMP-1 的表达。删选阳性表达者,-80 ℃保存于病毒保存液(Tris pH 8.0 + Mg-Cl2+蔗糖)中,用于后续实验。
1.3 制备重组腺病毒超声造影剂 SonoVue 为内含六氟化硫,外包磷脂的冻干粉末,使用时需用生理盐水溶解为白色乳状混悬液。完全溶解后,其微泡浓度约为2 × 108个∕mL,平均直径在2.5 μm 左右。将上述重组腺病毒用有限稀释法调整其滴度为5×107pfu∕mL,置于24 孔板中,取1 mL SonoVue 微泡和1ml 腺病毒混合震荡,冰上孵育2 h,使重组腺病毒与微泡表面结合。静置分层后弃去下清液,PBS 重悬,此时重组腺病毒滴度约为2×107pfu∕mL。
1.4 建立肝纤维化模型 实验首次以5 mL∕kg 皮下注射50%CCl4混合液(橄榄油2:3 稀释),随后剂量改为3 mL∕kg,每周2 次,持续8 周。对照组以等量橄榄油进行皮下注射。第8 周时,处死对照组及建模的大鼠各3 只剖取肝脏标本,HE 染色以确定肝纤维化模型成功复制。
1.5 动物分组及处理 选取建模成功的40 只大鼠随机分为5 组,每组8 只。包括:(1)模型组;(2)腺病毒组(仅给予Ad-shTIMP-1 重组腺病毒);(3)腺病毒微泡组(微泡造影剂+Ad-shTIMP-1 重组腺病毒);(4)实验组(超声辐照+ 微泡造影剂+ AdshTIMP-1 重组腺病毒);(5)超声腺病毒组(超声辐照+ Ad-shTIMP-1 重组腺病毒)。大鼠经10%水合氯醛腹腔麻醉后,注射器抽取1 mL 造影剂∕重组腺病毒∕重组腺病毒造影剂混合液,经尾静脉快速推注,随后追加1.0 mL 生理盐水将管腔冲洗干净。模型组以等量0.9%生理盐水注射。注射后,实验组及超声腺病毒组大鼠仰卧位固定,腹部剃毛(8%硫化钠),将超声探头定位于肝脏区,采用电子凸阵探头,设置其频率为1.6 MHz、接受频率3.2 MHz、声强为2 W∕cm2,聚焦深度定在3 cm,机械指数调至最大,超声辐照5 s,间歇5 s,共30 次。实验过程中,保持仪器设置一致。喂养48 h 后禁食8 h,腹主动脉取血,处死大鼠,检测相关指标。
1.6 检测指标
1.6.1 转染效率检测 大鼠处死后,取其肝脏,冰冻切片,后用冷丙酮固定,PBS 漂洗。倒置荧光显微镜下观察各组EGFP 的表达情况。在波长为488 nm 的紫外光激发下,EGFP 可显示绿色荧光。每片随机取6 个视野,统计荧光阳性细胞数,计算转染率。
1.6.2 组织学检测 取各组大鼠新鲜肝左叶,投入10%福尔马林溶液中固定24 h。经修剪后放入包埋盒中,酒精脱水,二甲苯透明,常规浸蜡、包埋、切片,片厚4 μm。经二甲苯脱蜡、酒精至水后,HE、Masson 染色剂染色。观察肝组织结构变化并由病理科医生判断肝纤维化分期(S):(1)0级,无纤维化;(2)1 级,汇管区纤维化扩大,小叶中央纤维化;(3)2 级,纤维沉积扩展于汇管区周围,存在纤维间隔;(4)3 级,小叶边缘纤维化,小叶结构紊乱;(5)4 级,肝硬化,假小叶形成。
1.6.3 肝纤维化指标检测 取各组大鼠腹主动脉血液,静置30 min,3 000 r∕min 离心10 min 分离血清,赖氏法测定各组大鼠AST、ALT 含量,放射免疫法测定各组大鼠HA、CIV、LN 含量,酸水解法测定Hyp 含量。
1.6.4 Western blot 大鼠处死后,取20 mg 新鲜肝脏组织,研磨粉碎,于4 ℃下加入RIPA 缓冲液、PMSF(10 mg∕mL)匀 浆,15 000 r∕min 离 心1 min。再次加入PMSF,冰育30 min,后移入离心管中,4 ℃离心15 min(15 000 r∕min),取上清,-20 ℃保存。BCA 试剂盒测定蛋白浓度,取相同质量的RIPA 裂解液,并加等体积的2 × 电泳上样缓冲液。沸水浴3 min,上样,以5%浓缩胶和12%分离胶进行电泳(每孔100 μg),再390 mA 40 min 转膜,膜用丽春红染色,胶用考马斯亮蓝染色。室温下,用5%脱脂牛奶封闭2 h,分别加入MMP-13、TIMP-1一抗(稀释1∶200),保持4 ℃,过夜孵育。PBS 洗3次,加入HRP 标记的二抗(稀释1∶5 000),37 ℃下轻摇3 h。ECL 显影,Image J 软件分析,以β-actin为内参蛋白。
1.7 统计学方法 SPSS 19.0 软件分析实验所得数据,正态分布的定量数据以均数±标准差表示,单因素方差分析显示各组转染率、血清检测指标及蛋白表达差异,两组间比较采用SNK-q检验。各组大鼠肝纤维化等级比较采用非参数检验Kruskal-WallisH,所有计算均采用双侧检验。
2 结果
2.1 重组腺病毒载体微泡造影剂 光学显微镜下,Ad-shTIMP-1 重组腺病毒超声微泡混合物形态类圆形,粒径较小,表面光滑,大小较一致,分布较为均匀,单个微泡居多,分散度较好;与未携带腺病毒的超声微泡相比,其形状、大小并无明显改变。在400 倍倒置荧光显微镜下可见微泡被绿色荧光包裹,见图1。

图1 Ad-shTIMP-1 重组腺病毒超声微泡混合物特征Fig.1 Characteristics of ultrasound microbubble mixture of Ad-shTIMP-1 recombinant adenovirus
2.2 各组转染效率检测 转染48 h 后,荧光显微镜下观察到腺病毒组、腺病毒微泡组、实验组、超声腺病毒组细胞内存在强度不一的绿色荧光,主要集中于细胞胞浆。其中,实验组荧光表达较强;而腺病毒组、腺病毒微泡组、超声腺病毒组仅有少量荧光表达,强度较弱。经计算,腺病毒组、腺病毒微泡组、实验组、超声腺病毒组的转染率分别为(32.39 ± 4.07)% 、(35.68 ± 5.15)% 、(54.81 ±7.22)%、(30.90 ± 3.44)%。单因素方差分析显示:实验组转染率高于腺病毒组(q= 3.418)、腺病毒微泡组(q= 3.756)、超声腺病毒组(q= 5.502),差异有统计学意义(P<0.05),见图2。
2.3 各组肝纤维化分级比较 病理检查可见模型组、腺病毒组大鼠肝组织内肝小叶结构不清,炎性细胞浸润程度较重,肝细胞有明显增大肿胀及点状坏死现象,同时汇管区扩大,胶原纤维明显聚集,粗大增生的胶原纤维从汇管区和中央静脉伸出分割、破坏正常肝小叶,纤维间隔形成。腺病毒微泡组及超声腺病毒组大鼠纤维组织增生及胶原纤维沉积相对减少,气球样变性及脂肪变性有所缓解,但仍存在纤维化。实验组纤维间隔变细,炎症减轻、肝小叶结构破坏程度及肝细胞坏死程度均得以改善,纤维化程度较轻,见图3。对比5 组大鼠肝纤维化等级,Kruskal-WallisH检验显示差异有统计学意义(H= 15.507,P= 0.001);两两比较结果显示:实验组肝纤维化分级优于其余4 组,而腺病毒微泡组及超声腺病毒组肝纤维化分级低于模型组与腺病毒组,差异有统计学意义(P<0.01),见表1。
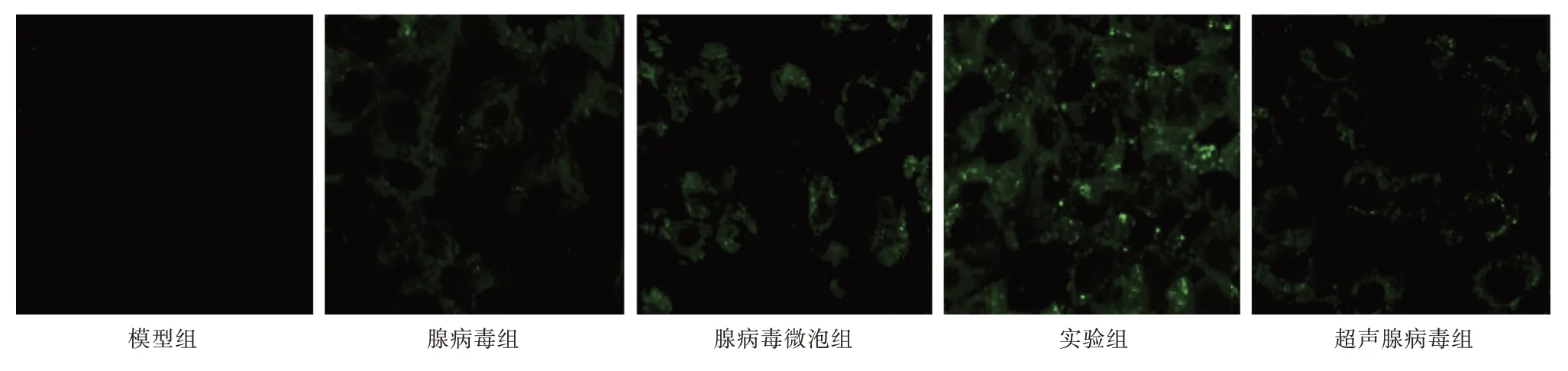
图2 各组转染效率比较(×40)Fig.2 Comparison of transfection efficiency in each group(×40)

图3 各组大鼠肝组织学检测结果比较(×100)Fig.3 Comparison of liver histology results of rats in each group(×100)

表1 各组大鼠肝纤维化分级比较Tab.1 Comparison of liver fibrosis grades in rats of each group只
2.4 各组大鼠血清检测指标结果 与模型组进行比较,腺病毒组、腺病毒微泡组、超声腺病毒组、实验组大鼠血清ALT、AST、HA及LN活性下降,其中,以实验组大鼠ALT、AST、HA、LN含量活性最低,差异有统计学意义(P<0.05);腺病毒组、腺病毒微泡组、超声腺病毒组3组间差异并无统计学意义(P>0.05)。对比各组CIV、Hyp含量差异,结果显示:模型组与腺病毒组、腺病毒微泡组、超声腺病毒组CIV、Hyp含量相近,差异无统计学意义(P>0.05),而实验组CIV、Hyp活性低于上述4组(P<0.05),见表2。
2.5 各组大鼠MMP-13、TIMP-1 蛋白表达差异目的基因与β-actin 得灰度比值结果显示:与模型组相比,其余4 组TIMP-1 蛋白表达均升高,而MMP-13 的表达含量则降低,差异有统计学意义(P<0.05);实验组相对腺病毒组、腺病毒微泡组、超声腺病毒组,其TIMP-1 蛋白表达更高,MMP-13 蛋白表达则更低(P<0.05);而腺病毒组、腺病毒微泡组、超声腺病毒组3 组MMP-13、TIMP-1 比较则无统计学意义(P>0.05),见图4、5。
表2 各组大鼠肝纤维化生化指标差异Tab.2 Differences in biochemical markers of liver fibrosis in rats of each group ±s

表2 各组大鼠肝纤维化生化指标差异Tab.2 Differences in biochemical markers of liver fibrosis in rats of each group ±s
注:与模型组进行比较,aP <0.05;与腺病毒组进行比较,bP <0.05;与腺病毒微泡组进行比较,cP <0.05;与实验组比较,dP <0.05
组别模型组腺病毒组腺病毒微泡组实验组超声腺病毒组ALT(U∕L)269.0±140.7 243.1±152.8a 230.4±65.3a 173.2±71.5abc 237.6±84.1ad AST(U∕L)305.6±104.8 254.4±72.3a 263.8±90.1a 203.5±64.4abc 259.3±85.7ad HA(μg∕L)289.4±42.5 262.0±33.4a 270.6±55.2a 175.8±34.0abc 264.0±32.9ad CIV(μg∕L)8.3±0.7 8.1±0.9 7.5±0.6 6.0±0.5abc 7.7±0.4d LN(μg∕L)112.4±15.6 95.9±18.2a 101.6±13.5a 74.7±11.8abc 96.5±12.4ad Hyp(mg∕g)15.3±0.9 13.4±0.3 12.8±0.5 9.3±0.7abc 14.5±0.6d
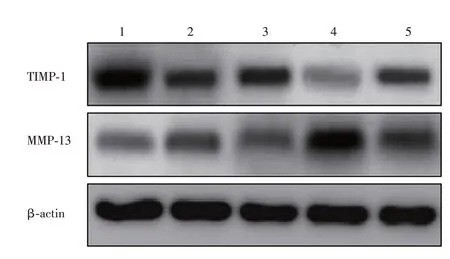
图4 各组Western blot 结果分析Fig.4 Analysis of western blot results in each group

图5 各组大鼠MMP-13、TIMP-1 蛋白表达差异Fig.5 Differential expression of MMP-13 and TIMP-1 protein in rats of each group
3 讨论
研究显示病因治疗可以逆转肝纤维化[9]。以干扰素等药物干预为主的病因治疗在改善患者预后,降低远期肝硬化、肝细胞癌发生率及提高生存率方面均有较为明显的优势,但其逆转进展性肝纤维化和改善各类组织学指标的能力并不理想[10]。随着疾病研究的不断深入及分子生物学的快速发展,临床发现肝纤维化的发生涉及复杂的信号传导系统,其最主要的病理特征是以Ⅰ、Ⅲ型胶原为主的细胞外基质在肝内过度堆积。ARFFA等[11]的研究显示肝细胞持续受损可激活肝星形细胞,后者在多种活化细胞因子的作用下,转化为肌纤维细胞,分泌转化生长因子,作用于肝星形细胞本身,加速其向肌纤维细胞转化的速度。同时,肌纤维细胞可分泌MMPs∕TIMPs,打破细胞外基质的合成∕分解平衡,造成细胞外基质大量沉积,引起肝细胞一系列组织学变化[12]。由上述机制可知,采用基因治疗从分子层面阻断肝纤维化进展的治疗方案有一定理论依据和应用前景。目前,基因治疗的重点集中在抑制肝星形细胞活性、靶向调节MMPs∕TIMPs 及控制炎症反应这三方面。本研究主要以抑制TIMPs 为方向,分析基因治疗的临床价值及可行性。
基因治疗的效应高低依赖于载体,以往所用载体包括逆转录病毒、腺病毒、脂质体等。其中,腺病毒因其具有细胞感染性强、感染条件少、基因承载量大、无插入突变型及滴度高等优势成为当前基因治疗的常见载体。夏冬等[13]将携带人TIMP-1 的重组腺病毒转染至肝癌Hepc2 细胞后,发现该载体对癌细胞侵袭、转移均有明显抑制作用,此结论进一步肯定了基因治疗的益处,但在随后沈宇宙等[14]的研究中可以看到,重组腺病毒载体亦存在毒性副作用、靶向性差且机体转染效率低等不可忽视的缺陷。因此,寻找安全无毒兼有靶向高转染率的理想载体成为基因治疗肝纤维化的又一难题。声学微泡属于新型的体内基因转染非病毒载体,是近年来的研究热点,其使用方便,能克服常规载体的不足,亦能针对性调节剂量和强度;此外其还能在运输过程中保护目的基因∕药物,极具研究价值[15]。本研究所用重组腺病毒超声微泡混合剂的粒径大小、分散度、浓度同一般声学微泡相似,符合转染要求,镜下荧光强度较好,可见其制备简单、感染力强、性状稳定。对比常规腺病毒载体,超声微泡联合超声辐照的转染率更强。与重组腺病毒超声造影剂及重组腺病毒联合超声辐照这两种转染方式相比,其转染率仍处于较高水平,所介导的目的基因能够在特定组织中稳定表达。上述现象提示超声微泡需联合超声辐照才可成为较为理想的转染载体。一定强度的超声辐照利于靶向运输,外壳表面黏附着腺病毒的微泡在辐照的作用下逐渐膨胀,达到临界值时,微泡破裂,靶基因释放于肝细胞内。而由微泡的破裂引起的局部高压可导致细胞膜通透性增高,促使携带靶基因的重组腺病毒更为容易的通过破裂的毛细微血管和细胞膜,以此增强了目的基因的转染率和剂量[16]。
成功进入细胞是基因治疗的关键步骤,而介导的靶基因发挥治疗作用则是最终目的。笔者检测了大鼠组织病理学指标及相应蛋白的变化,据此评估转染的靶基因对肝纤维化大鼠的治疗效果。结果显示,成功转染了shTIMP-1 的大鼠肝纤维化程度得以改善,肝纤维化等级较轻,相应的血清指标ALT、AST、HA 及LN 活性也比其他转染方案者低,提示超声微泡靶向的下调TIMP-1 基因表达载体与超声辐照联合转染后,发挥作用的靶基因高于常规腺病毒载体及腺病毒超声造影剂混合物单独应用。Western blot 检测结果表明,与其他处理措施相比,腺病毒超声造影剂联合超声辐照治疗后,肝纤维化大鼠的TIMP-1 蛋白表达更高,MMP-13 蛋白表达更低。在肝纤维化形成过程中,TIMP-1 起着十分重要的作用,可通过抑制MMP-1、MMP-13 活性,减慢细胞外基质的降解,推进肝纤维化的发生[17]。故封闭TIMP-1 表达即可释放MMP-13 活性,在一定程度上逆转肝纤维化。
由于课题内容较多,预实验摸索有限,本研究所选定的超声微泡的浓度和超声辐照的强度均是参考公司往期实验结论,未曾细分探讨各浓度或强度下转染效率的高低。加之,纳入分析的TIMP-1 上下游分子不够全面,对实验结果可能有一定干扰。笔者将在日后的研究中针对上述不足进行改正,以验证我们的结论。
综上,超声微泡微泡靶向TIMP-1 下调的腺病毒治疗能抑制TIMP-1 活性,改善肝纤维化程度,基因治疗具有潜在应用价值。
