黄嘌呤氧化酶在激素诱导成骨细胞凋亡过程中的作用及机制*
2019-03-08黄冠予彭昊刘阳张雷梁世博
黄冠予 彭昊* 刘阳 张雷 梁世博
股骨头缺血性坏死(osteonecrosis of the femoral head,ONFH)是一种常见的难治性骨科疾病。ONFH可大致分为两类:一类为创伤引起的股骨头缺血性坏死,称为创伤性ONFH;另一类为非创伤因素引起的股骨头缺血性坏死,称为非创伤性ONFH。其中,创伤性ONFH的发病原因通常较为明确,大多是因为外伤引起的股骨头滋养血管(尤其是旋股内侧动脉)受损,引起股骨头血供不足,导致股骨头中骨细胞缺血性坏死。非创伤性ONFH的发病原因则通常比创伤性ONFH复杂,大致包括以下原因:长期或大剂量使用糖皮质激素;大量饮酒;肥胖;血液系统疾病;潜水病;类脂质增生;血管疾病;结缔组织病;肾移植;急性胰腺炎。其中,长期或大剂量使用糖皮质激素和酗酒是非创伤性ONFH最主要、最常见的两个发病原因。
目前,糖皮质激素作为治疗某些自身免疫性疾病(如肾病综合征、系统性红斑狼疮及类风湿性关节炎等)的有效手段,其使用率在不断增长,因此导致了糖皮质激素引起的ONFH的患者数量不断增多[1-2]。长期接受糖皮质激素治疗的患者9%~40%会发生激素性骨坏死(glucocorticoidinducedosteonecrosis,GIO),而短期大剂量的糖皮质激素的暴露也会发生骨坏死[3-4]。糖皮质激素诱导的股骨头缺血性坏死的病理机制十分复杂,受到广泛认同的观点包括:脂质代谢紊乱;血液循环障碍;髓内压升高;凝血纤溶系统障碍;微血管内皮损伤;细胞功能障碍;细胞凋亡[5-9]。地塞米松作为糖皮质激素中的代表药物,被广泛用于临床治疗及基础实验研究中。现今,国内外学者的研究重心逐渐集中于细胞凋亡学说。国内外多项研究表明,激素性ONFH的病理进程中包含了成骨细胞的凋亡。而且激素性 ONFH的实质并非是骨细胞的坏死,而是表现为成骨细胞的显著凋亡[10-12]。在激素诱导的成骨细胞凋亡过程中,氧化损伤要早于骨坏死,使用激素后,很快就会出现氧化损伤。糖皮质激素会使得小鼠骨组织内活性氧簇(reactive oxygen species,ROS)生成增加[13]。LinH和SatoAY等学者[14-15]的研究也证实,ROS与激素诱导的成骨细胞凋亡具有紧密的联系。
黄嘌呤氧化酶(xanthineoxidase,XOD)是一种底物专一性低,并且广泛存在于各类动物组织细胞的酶。其主要作用包括:参与机体内核酸的分解代谢;促进铁的吸收与转运;检查超氧化物歧化酶(superoxidedismutase,SOD)的活性;产生氧自由基。黄嘌呤氧化酶是大多数细胞胞质内ROS的主要来源之一。在外界压力增大的情况下,XOD活性增加导致细胞内ROS增多,ROS的剧烈增多导致了细胞内损伤的发生及亚细胞结构的改变。多项国内外研究表明,XOD高表达和活性增加导致细胞内的ROS增加,从而导致了细胞凋亡[16-18]。但从现有文献看,对XOD和细胞凋亡关系的研究大多集中在心肌细胞、肺泡上皮细胞及肿瘤细胞领域。并未有文献报导在激素性成骨细胞凋亡过程中XOD所起到的作用以及具体的信号传导通路。因此,本实验旨在探究在糖皮质激素诱导的成骨细胞凋亡的病理过程中,XOD的具体作用以及作用机制。并通过使用XOD的特异性抑制剂别嘌醇进行干预,以期阐述具体的信号调控通路以及调控机制,寻找到新方法治疗ONFH。
1 材料与方法
1.1 细胞及主要试剂
实验细胞为小鼠胚胎成骨细胞前体细胞(MC3T3-E1),由中科院细胞库提供。主要试剂包括:胎牛血清(Serapro公司)、别嘌醇(Selleck公司)、地塞米松(Sigma公司)、STAT-1抗体(Sigma公司)、Caspase-3抗体(Sigma公司)、Bcl-2抗体(Sigma公司)、Bax抗体(Sigma公司)、细胞内ROS检测试剂盒(红色荧光,Sigma公司)、黄嘌呤氧化酶试剂盒(Sigma公司)、JC-1试剂盒(Sigma公司)、MDA试剂盒(Sigma公司)。
地塞米松(Dexamethasone,DEX)原液:25 mg DEX粉末加入25 mL无水乙醇中混匀。
1 mg/mL别嘌醇原液:25 mg别嘌醇粉末加入25 mL PBS溶解混匀。
5mol/L别嘌醇DEX培养基:34L别嘌醇原液与15 mL的110-6mol/L DEX培养基混匀。
10 mol/L别嘌醇DEX培养基:68 L别嘌醇原液与15 mL的110-6mol/L DEX培养基混匀。
15mol/L别嘌醇DEX培养基:102L别嘌醇原液与15 mL的110-6mol/L DEX培养基混匀。
1.2 激素性成骨细胞凋亡模型的建立
1.3 CCK-8试剂盒
使用 CCK-8试剂盒检测在糖皮质激素诱导的条件下,加入不同浓度的别嘌醇时,细胞存活百分比。药物浓度分别选取 0、3、5、7、10、13、15、20 mol/L。
1.4 实验分组及干预方法
1.5 生化指标测定
通过 CCK-8试剂盒检测合适的干预药物浓度。流式细胞仪检测细胞凋亡情况以及细胞内ROS荧光强度。全自动荧光显微镜拍摄细胞内ROS荧光照片,并测算平均荧光密度。Western Blot检测凋亡相关蛋白表达情况。试剂盒检测细胞内XOD、MDA以及线粒体膜电位(mitochondrialmembrane potential,MMP)。
1.6 统计学方法
本次实验数据均使用SPSS21.0软件进行统计学分析,所有的计量资料以均数±标准差表示。使用单因素ANOVA分析进行多组数据之间的比较,多组数据间的两两比较则使用Bonferroni法校正检验结果。P<0.05表示差异有统计学意义。
2 结果
2.1 CCK-8试剂盒检测细胞活力
CCK-8试剂盒的检测结果显示,在DEX诱导凋亡的背景下,别嘌醇药物浓度小于5 mol/L时,没有显著的保护作用。当别嘌醇药物浓度大于5 mol/L且小于15 mol/L时,细胞存活率随着药物浓度增加而增加。当别嘌醇浓度超过15 mol/L时,细胞存活率无明显增高。根据CCK-8试剂盒各组吸光度结果,测算出各组细胞存活率后,用 GraphPad Prism-5软件制作曲线图并测算半最大效应浓度(concentration for 50%of maximal effect,EC50),得出的EC50值为8.898mol/L,因此本次实验设置的浓度梯度为5 mol/L、10 mol/L和15 mol/L,见图1。
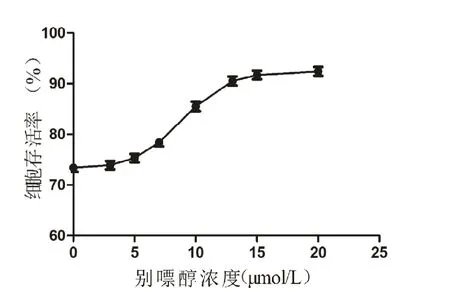
图1 在DEX诱导凋亡的背景下,不同别嘌醇浓度时的MC3T3-E1细胞活力
2.2 流式细胞仪(FCM)检测MC3T3-E1细胞凋亡情况
结果显示,在凋亡细胞占比方面,空白组为(5.96±0.446)%,模 型 组 为(12.86±1.671)%,5 mol/L 组 为(8.94±0.340)%,10 mol/L组为(7.94±0.079)%,15 mol/L组为(6.88±0.129)%。通过单因素ANOVA分析,发现空白组与模型组、5 mol/L组、10 mol/L组相比,差异有统计学意义(P<0.05);而空白组与15 mol/L组相比,差异无统计学意义(P=0.192)。模型组与空白组以及其他各干预组相比,差异有统计学意义(P<0.05)(见图2)。
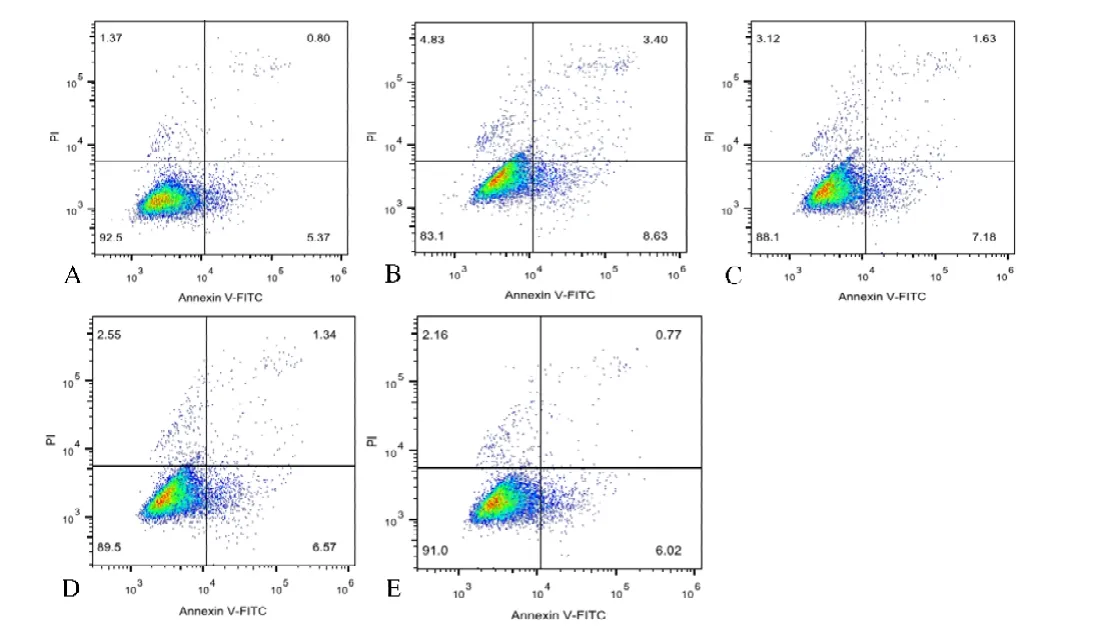
图2 A.空白组;B.模型组;C.5 mol/L组;D.10 mol/L组;E.15 mol/L组(n=6)
2.3 流式细胞仪(FCM)检测细胞内ROS荧光强度
结果显示,空白组ROS平均荧光强度为(16618.33±817.377);模型组ROS平均荧光强度为(39 449.67±1 532.136);5 mol/L组ROS平均荧光强度为(32688.33±1484.619);10 mol/L组ROS平均荧光强度为(28091.00±1434.407);15 mol/L组ROS平均荧光强度为(23639.67±1221.545)。空白组与其他各组相比,差异有统计学意义(P<0.05)。通过Bonferroni法校正,两两对比结果显示各组细胞内ROS的平均荧光强度差异有统计学意义(P<0.05,见图3)。
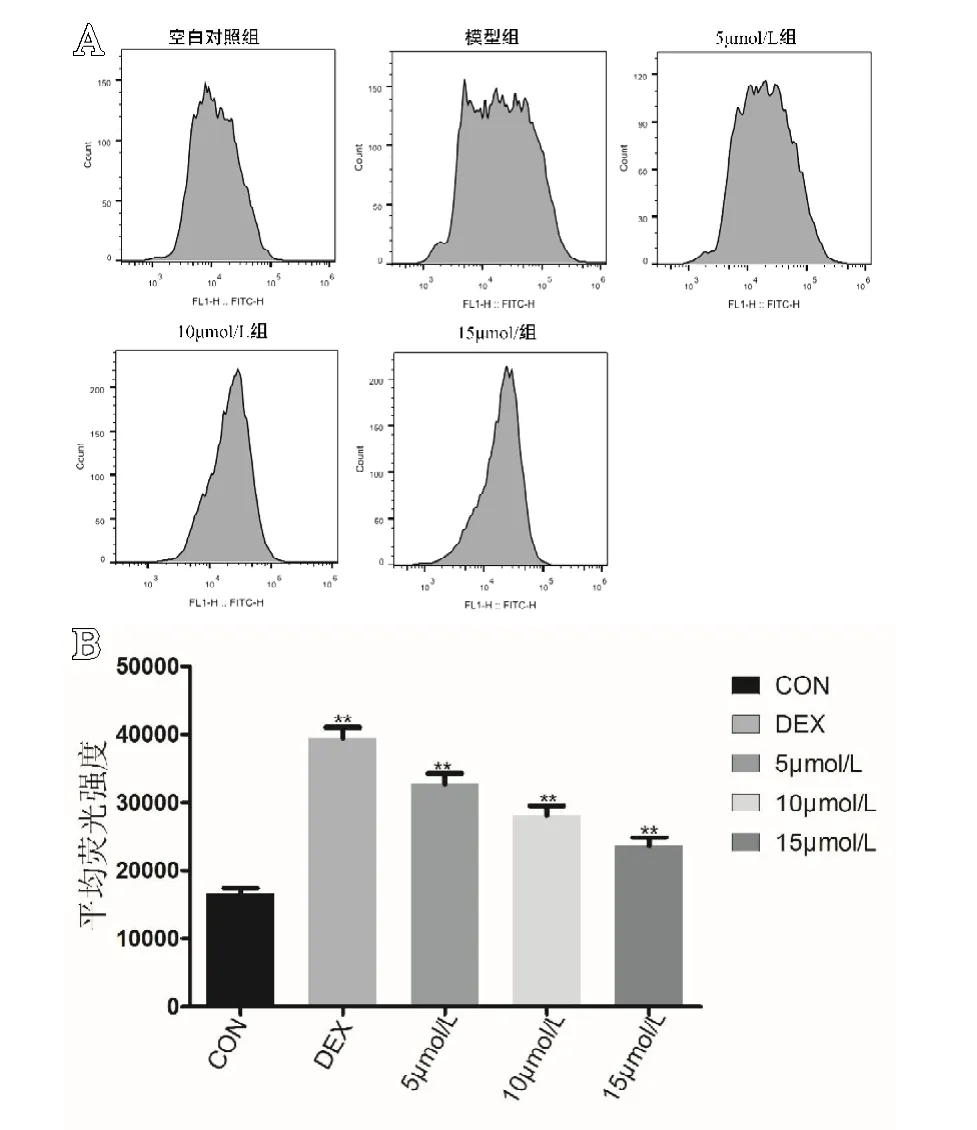
图3 A.各组细胞内ROS荧光强度分布图(n=6);B.各组细胞内ROS平均荧光强度(P<0.05,n=6)。**代表与空白组相比,差异有统计学意义(P<0.05)
2.4 荧光显微镜检测ROS荧光平均光密度
通过荧光显微镜对各组细胞的细胞爬片进行拍照记录,通过计算细胞ROS荧光平均光密度对比各组细胞中ROS含量。通过 ImageJ软件分析,空白组 ROS平均光密度为(0.052±0.0020),模型组 ROS 平均光密度为(0.130±0.0040),5 mol/L组ROS平均光密度为(0.093±0.0015),10 mol/L组ROS平均光密度为(0.077±0.0025),15mol/L组ROS平均光密度为(0.063±0.0025)。通过单因素ANOVA分析,空白组的ROS平均光密度与其他各组相比,差异有统计学意义(P<0.05)。各组间进行两两比较,各组的平均光密度数值差异有统计学意义(P<0.05)(见图4)。
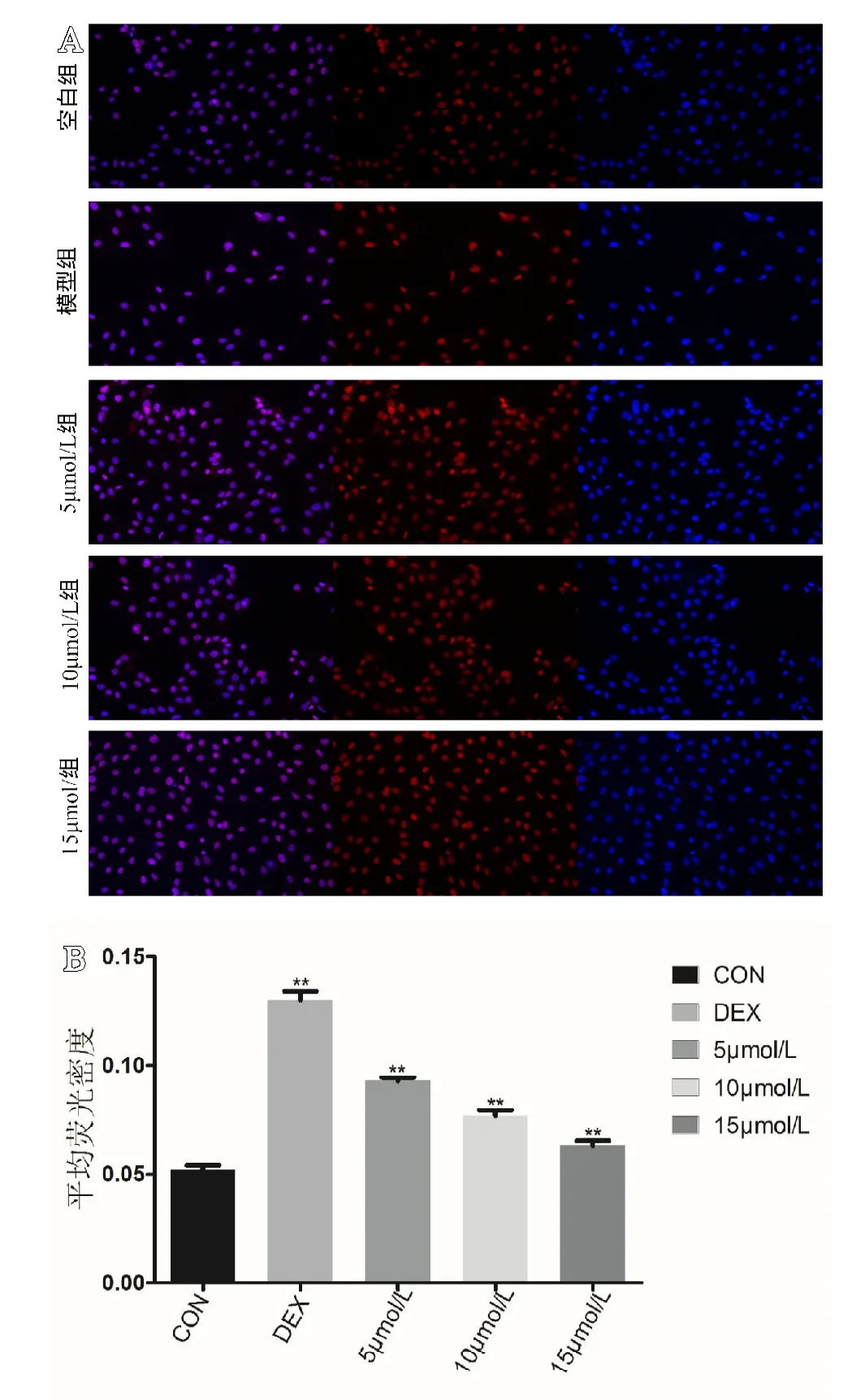
图4 A.各组细胞的ROS荧光照片,由左至右分别为整合图、ROS荧光图和未氧化的二氢乙啶荧光图;B.各组细胞内ROS平均荧光密度。**代表与空白组相比,差异有统计学意义(P<0.05)
2.5 Western Blot技术检测细胞内蛋白表达
结果显示,模型组与空白组相比促凋亡蛋白明显表达增加,如Caspase-3、STAT-1、Bax,而抗凋亡蛋白Bcl-2明显降低,通过单因素 ANOVA分析显示差异有统计学意义(P<0.05)。5 mol/L组、10 mol/L组、15 mol/L组与空白组相比,差异有统计学意义(P<0.05)。随着别嘌醇浓度的增加,STAT-1、Caspase-3和 Bax的表达量逐渐下降,而Bcl-2的表达量显著上升(见图5)。
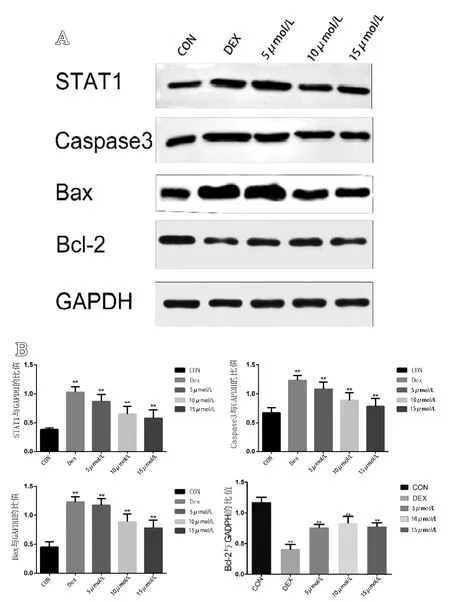
图5 A.各组细胞Western Blot蛋白条带图(n=6);B.各组细胞中STAT-1、Caspase-3、Bax、Bcl-2蛋白的蛋白印迹灰度值与内参蛋白GADPH灰度值的比值(n=6)。**代表与空白组相比,差异有统计学意义(P<0.05)
2.6 黄嘌呤氧化酶试剂盒检测细胞内黄嘌呤氧化酶(XOD)表达
结果显示,空白组的 OD值为(0.161±0.0113)A,模型组的OD值为(0.243±0.0144)A,5mol/L组的OD值为(0.166±0.0174)A,10 mol/L 组的OD值为(0.138±0.0150)A,15mol/L组的 OD 值为(0.113±0.0125)A。单因素ANOVA分析结果表明模型组与空白组进行比较,差异有统计学意义(P<0.05),通过两两比较发现,空白组和5 mol/L组之间差异无统计学意义,5 mol/L组和10 mol/L组比较差异无统计学意义(P≥0.05),其他各组间两两比较,差异有统计学意义(P<0.05)(见图6)。
2.7 JC-1试剂盒检测MMP
结果显示,空白组JC-1阳性细胞比例为(4.76±0.633)%,模型组JC-1阳性细胞比例为(15.31±1.262)%,5 mol/L组 JC-1阳性细胞比例为(9.16±0.419)%,10 mol/L组JC-1阳性细胞比例为(8.11±0.577)%,15 mol/L组 JC-1阳性细胞比例为(7.57±0.631)%。通过单因素ANOVA分析,模型组与空白组相比较差异有统计学意义(P<0.05),同时各个别嘌醇干预组与模型组和空白组相比较差异有统计学意义(P<0.05)。可见在模型组中JC-1阳性细胞比例显著上升,即MMP降低的细胞所占比例明显上升。随着别嘌醇的浓度增高,JC-1阳性细胞比例有所降低,但仍高于空白组(见图7A)。各组 FL2阳性细胞与 FL1阳性细胞的比值(见图7B),通过单因素ANOVA分析,空白组、模型组与各别嘌醇干预组组间比较差异有统计学意义(P<0.05)。别嘌醇干预组组间两两比较,差异无统计学意义(P≥0.05)。
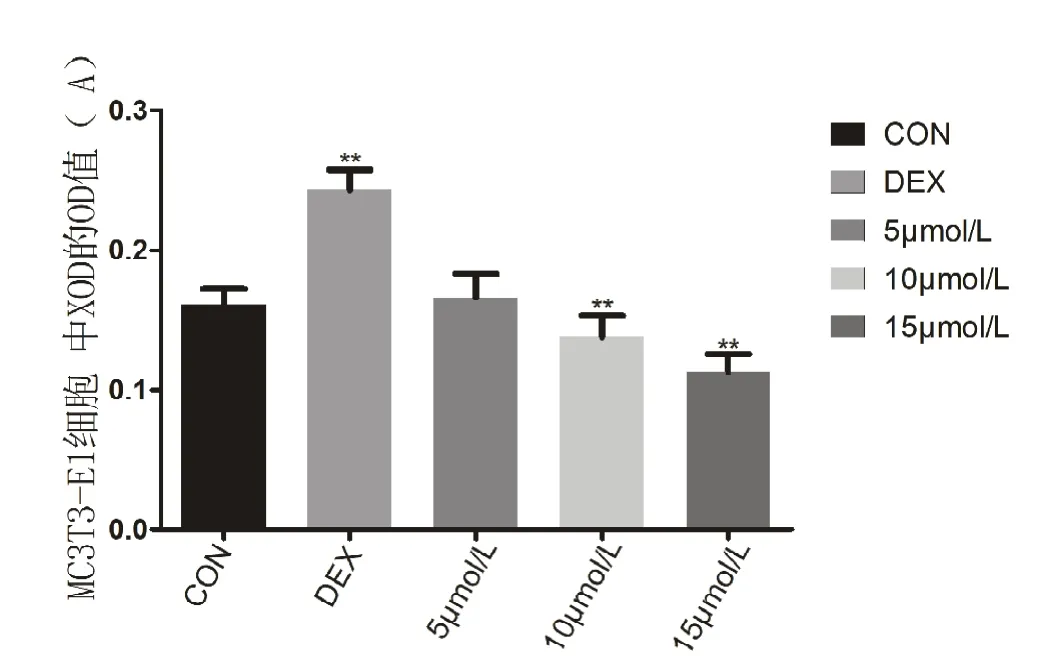
图6 各组细胞胞质内XOD的OD值(n=6)。**代表与空白组相比,差异有统计学意义(P<0.05)
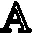
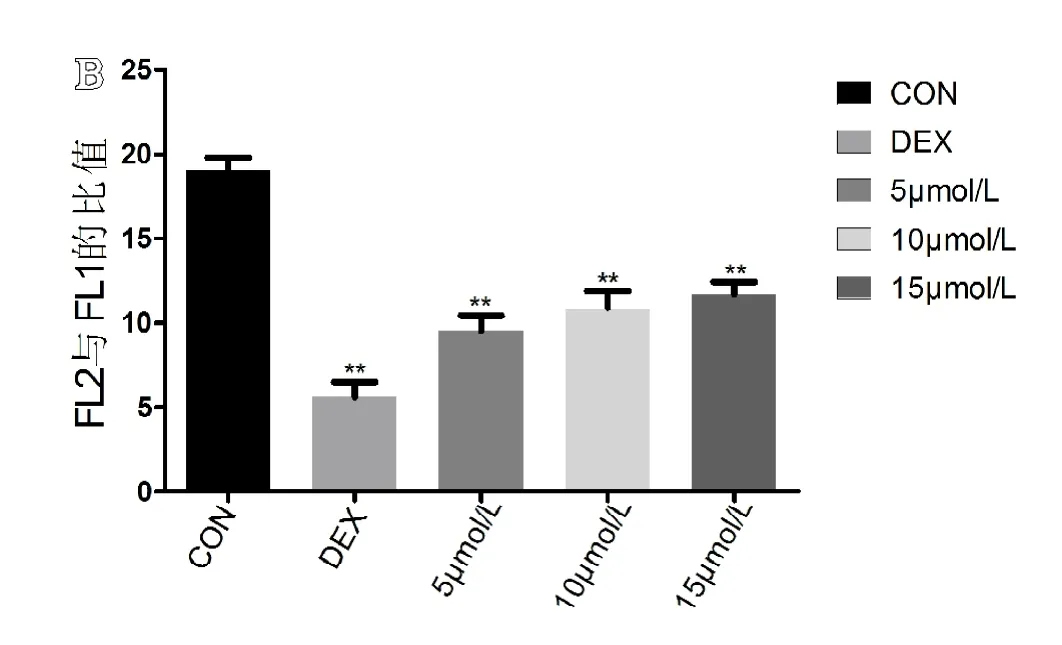
图7 A.右上象限代表FL1阳性细胞(即JC-1阳性细胞),右下象限代表FL2阳性细胞(即JC-1阴性细胞)(n=6);B.各组FL2阳性细胞与FL1阳性细胞的比值(n=6)。**代表与空白组相比,差异有统计学意义(P<0.05)
2.8 MDA试剂盒检测细胞内脂质过氧化作用
本实验中,空白组MDA含量为(1.18±0.126)nmol/mL,模型组 MDA 含量为(4.47±0.277)nmol/mL,5 mol/L 组MDA含量为(3.24±0.192)nmol/mL,10 mol/L组MDA含量为(2.29±0.297)nmol/mL,15mol/L 组 MDA 含量为(2.19±0.185)nmol/mL。通过单因素ANOVA分析,模型组细胞内 MDA含量与其他各组相比,差异有统计学意义(P<0.05)。10 mol/L组与15 mol/L组相比,差异无统计学意义(P≥0.05)。其他各组间进行两两比较,差异有统计学意义(P<0.05)(见图 8)。
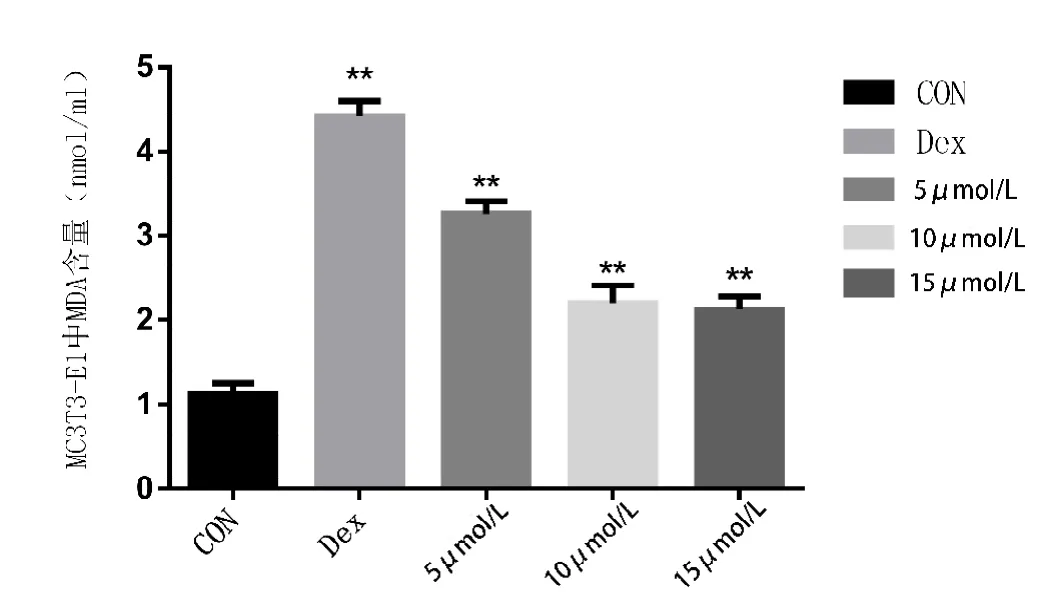
图8 各组MC3T3-E1细胞胞质内MDA含量(n=6)。**代表与空白组相比,差异有统计学意义
3 讨论
糖皮质激素诱导的成骨细胞凋亡是激素性 ONFH的病理实质,但因其细胞内的信号转导通路十分复杂,因此仍旧是研究的热点。在糖皮质激素诱导成骨细胞凋亡的病理过程中,氧化应激损伤、黄嘌呤氧化酶、ROS是否参与到了病理过程以及是否促进成骨细胞凋亡,至今仍未被明确阐述。在本次实验中,干预组加入了不同剂量的别嘌醇,目的是抑制细胞中XOD的活性,减少MC3T3-E1细胞内ROS的生成,降低 MC3T3-E1细胞所受到的氧化应激损伤和细胞凋亡比例。XOD是细胞内ROS的主要来源之一,当细胞受到外界刺激损伤时,细胞通过半胱氨酸残基介导的可逆性氧化或Ca2+介导的不可逆性氧化途径使得蛋白质水解,使得更多的黄嘌呤脱氢酶(xanthine dehydrogenase,XDH)转变为XOD,而XOD在参与细胞内氧化还原反应时,会将电子转移至氧分子上,从而产生大量ROS[19]。
本实验中使用别嘌醇抑制XOD后,细胞凋亡比例与模型组相比明显降低,说明抑制XOD活性可以抑制DEX诱导的MC3T3-E1细胞凋亡。在细胞内ROS含量方面,模型组ROS荧光强度以及平均光密度明显高于其余各组,表明在糖皮质激素诱导的 MC3T3-E1细胞凋亡的过程中,细胞内ROS浓度明显增加,而抑制XOD活性后,可以减少细胞内ROS的产生和积累,缓解细胞氧化应激损伤。在使用不同剂量别嘌醇干预后,细胞内ROS的荧光强度以及平均光密度显著降低,细胞凋亡比例也有所降低。再次说明XOD和ROS均参与了激素性成骨细胞凋亡的病理过程,并且有促凋亡的作用;而通过抑制细胞内XOD的活性,可以减少MC3T3-E1细胞内ROS的产生,从而减少细胞凋亡的比例。在 Guo F等学者对 HCT116细胞凋亡过程的研究中发现,ROS通过诱导MMP降低,使线粒体膜通透性增加并且增加Caspase-3、Bax等促凋亡蛋白的表达上调,抗凋亡蛋白Bcl-2下调,从而促进细胞凋亡过程[20]。Lee MH等学者[21]的研究也表明ROS可以通过线粒体途径诱导细胞凋亡,其机制与线粒体膜通透性增高后,线粒体释放细胞色素 C并引起下游的胱天蛋白酶(caspase)产生级联反应有关。本次实验中,WesternBlot的结果显示,模型组中促凋亡蛋白STAT-1、Caspase-3和Bax的表达明显上调,而STAT-1是Caspase-3上游的调控因子,可以说明糖皮质激素通过激活 STAT-1/Caspase-3信号通路途径和调节 Bax/Bcl-2比例来诱导MC3T3-E1细胞凋亡。结合WesternBlot的结果和JC-1检测结果可以发现,糖皮质激素可以通过上调Bax蛋白表达,下调Bcl-2蛋白表达,使得Bax转位至线粒体外膜并形成多聚体孔道,造成线粒体膜通透性增加和MMP稳态崩溃,线粒体膜间隙内的促凋亡物质被释放入细胞基质内,触发内源性线粒体促凋亡途径,导致细胞凋亡。在别嘌醇干预组中STAT-1、Caspase-3和Bax蛋白表达与模型组相比显著降低,Bcl-2的表达上调,说明ROS可以通过STAT-1/Caspase-3信号通路途径以及调节Bax/Bcl-2比例来诱导MC3T3-E1细胞凋亡。而别嘌醇可以通过抑制过量ROS的产生,减少STAT-1、Caspase-3和Bax蛋白表达,效果与剂量呈正相关,可以再次证明ROS是通过STAT-1/Caspase-3信号通路途径以及调节Bax/Bcl-2比例来诱导MC3T3-E1细胞凋亡的。但是在不同剂量的别嘌醇干预组中,Bcl-2蛋白表达与模型组相比有所上调,但与药物剂量未见显著正相关联系,可能是由于别嘌醇不是Bcl-2的特异性激动剂,而是通过降低ROS的产生来降低线粒体膜的氧化应激损伤。在 Zhong J等学者[22]对SH-SY5Y细胞的研究中,他们发现通过抑制ROS的生成可以扭转部分细胞膜电位的降低,并且减少Caspase-3和Bax蛋白的表达,从而抑制SH-SY5Y细胞凋亡。另一项对表柔比星诱导成骨细胞凋亡的研究中也表明,过量的ROS可以通过上调Caspase-3和Bax蛋白的表达,下调Bcl-2的表达导致成骨细胞通过内源性线粒体途径凋亡[23]。
本次实验中,模型组中细胞XOD的活性明显高于其他各组,且氧化应激损伤导致的膜脂质过氧化反应程度也显著高于其他各组,说明XOD和氧化应激反应参与到了该病理过程中。XOD在此过程中产生大量ROS,并且超出细胞自身清除ROS的能力范围,导致细胞凋亡。从别嘌醇干预组的结果来看,加入特异性XOD抑制剂别嘌醇可以有效地抑制XOD的活性,减少ROS的产生并降低氧化应激损伤,从而减少由ROS介导的线粒体途径细胞凋亡。结合MMP检测结果来看,在此过程中MMP下降并失稳,说明在此过程中ROS起到关键的作用,ROS通过介导对线粒体的氧化应激损伤,导致线粒体膜通透性增高和膜电位稳态失衡。通过别嘌醇干预,MMP降低细胞占比有所减少。其原因可能是因为过量ROS是导致MMP崩溃的主要诱因,而别嘌醇可以减少ROS的生成,从而减少线粒体的氧化应激损伤。在LiK等学者的研究中,使用ROS清除剂N-乙酰半胱氨酸可以显著减少硝普钠诱导的椎间盘髓核细胞的凋亡,其原理是通过清除ROS使得MMP恢复稳定,从而减少内源性线粒体途径所致的细胞凋亡[24]。在Jacob S等学者的研究中发现,使用特异性XOD抑制剂非布司他可以有效抑制气管上皮细胞的氧化应激损伤,显著降低细胞内XOD活性,减少ROS和MDA的含量[25]。
4 结论
XOD在激素性成骨细胞凋亡的病理过程中,产生过量的 ROS,引起细胞氧化应激损伤,并通过激活 STAT-1和Bax来诱导细胞凋亡,并且还可以导致MMP稳态崩溃诱发内源性线粒体凋亡途径。而别嘌醇可以特异性地抑制 XOD的活性,减少细胞内ROS的产生,减少STAT-1、Caspase-3和Bax蛋白表达,使细胞MMP稳态恢复,从而减少成骨细胞凋亡。
