改性羟基磷灰石制备及除氟特性研究
2019-02-19胡家朋刘瑞来赵瑨云饶瑞晔吴代赦
胡家朋,刘瑞来,林 皓,赵瑨云,饶瑞晔,吴代赦
(1.武夷学院生态与资源工程学院,福建省生态产业绿色技术重点实验室,武夷山 354300;2.南昌大学资源环境与化工学院,南昌 350007)
1 引 言
氟是人体内重要的微量元素之一,但饮用水中如果其浓度过高,将会对人体和环境造成很大危害。如何去除饮用水中的高浓度氟离子引起研究者广泛关注[1-2]。目前国内外主要采用吸附法除氟,例如采用天然矿物、金属氧化物、生物材料、类水滑石等吸附剂材料除氟[3-4]。因此,开发高效、环保的新型除氟材料成为除氟材料研究开发的热点。
羟基磷灰石(HAP)是钙磷灰石(Ca10(PO4)6(OH)2)的自然矿化物,作为一种生物活性体材料,具有良好的生物活性和相容性,除了应用于组织工程支架材料外,HAP作为吸附剂材料被广泛应用于重金属离子及其含氟废水的吸附处理[5-6]。研究表明HAP吸附水中F-主要通过双分解反应生成CaF2或OH-交换F-生成氟磷灰石Ca10(PO4)6F2或Ca10(PO4)6FOH[7],HAP对F-的交换吸附主要发生在晶体表面,吸附容量有限[8],因此研究者们采用表面改性、掺杂等方法提高HAP的除氟容量。Wang等[9]利用低分子量有机酸改性HAP,使其在HAP表面引入新的活性点,Prabhu等[10]采用阳离子表面活性剂改性HAP,利用静电吸附和离子交换作用,使改性后HAP的除氟容量从2.63 mg/g提高到9.37 mg/g。Sundaram等[11]将壳聚糖(CS)与HAP共混制备HAP/CS复合材料,为HAP表面提供更多的氨基和羟基,除氟容量得到提高。Teng和He等[12-13]研究表明,Al3+与F-之间具有强烈的亲和作用。本文利用简单的共沉淀法制备羟基铝(Al-OH)改性HAP复合材料(Al-OH-HAP),并系统研究Al-OH-HAP对水溶液中F-的吸附特性,探讨其吸附机理。
2 实 验
2.1 实验试剂
氯化钠、硫酸铝、氢氧化钠、磷酸氢二铵、柠檬酸钠、四水硝酸钙、冰乙酸、盐酸,以上试剂为分析纯购于上海国药化学试剂有限公司,其余试剂为市售分析纯。
2.2 Al-OH-HAP的制备
Al-OH溶胶的制备如下:将一定质量硫酸铝加入50 mL蒸馏水中,常温下磁力搅拌溶解。将1 mol/L NaOH溶液滴加到上述溶液中,磁力搅拌1 h,得到Al-OH溶胶。其中Al3+/OH-摩尔比(n(Al3+/OH-))分别为0.2、0.4、0.6、0.8、1.0、1.5和2.0。
Al-OH-HAP的制备如下:按照参考文献[14]将制备的HAP(1 g)分散在50 mL乙醇中,得到HAP悬浮液。将Al-OH溶胶逐滴加入HAP悬浮液中,其中Al-OH溶胶中Al-OH的量分别为5 mmol、10 mmol、15 mmol和20 mmol,Al-OH的量简写为n(Al-OH)。25 ℃下磁力搅拌反应1 h,抽滤、洗涤、干燥、研磨、过筛(200目)得到Al-OH-HAP样品,备用。在研究n(Al3+/OH-)对除氟效率影响时,n(Al-OH)的量为10 mmol。研究Al-OH量对除氟效率影响时,n(Al3+/OH-)为1.0。
2.3 分析测试方法
利用离子选择性电极法测定水质氟化物(GB/T 7484-1987): 将10 mL TISABII缓冲溶液分别加入含有1 mL、2 mL、3 mL、4 mL、5 mL F-(10 mg/L)标准溶液中,加蒸馏水稀释定容至50 mL,用F-选择性电极测定一系列标准溶液的E(mV)值,以E(mV)和相对应的logCF-作标准曲线图,利用该标准曲线计算出被测水质样品的氟离子浓度。
2.4 Al-OH-HAP复合材料表征
采用美国Thermo Nicolet公司的5700型FTIR对样品进行测试,样品采用KBr压片法制备,使用仪器配套OMNIC 软件对谱图进行分析。
利用荷兰飞利浦X'Pert MPD, Holland型XRD对样品进行物相结构分析,使用Cu Kα辐射(λ=0.154 nm),工作电压30 mA,工作电流40 kV,扫描速度2°/min,扫描范围2θ=10°~80°。
样品进行喷金处理(Engineering IB-2 Ion, Eiko, Japan),喷金电流30 mA,喷金时间100 s,采用日本JEOL公司的JSM-7500F型SEM进行观测分析。
利用美国麦克公司比表面积分析仪(Gemini-VII 2930)在液氮温度下(-196 ℃)测定样品N2吸附-脱附等温线,使用BET方法和BJH法分别计算比表面积和孔径及孔径分布。
2.5 吸附特性研究
2.5.1 pH值影响
分别向100 mL塑料离心管中加入50 mL 10 mg·L-1F-溶液,0.1 mol/L盐酸或氢氧化钠溶液调节pH值至3~11,再分别向离心管中加入0.0200 g 吸附剂,混合溶液在25 ℃水浴中恒温振荡12 h,静置30 min,取上清液用0.45 μm滤膜过滤后,测定滤液的F-浓度。
2.5.2 吸附热力学
分别向100 mL塑料离心管中加入50 mL F-溶液(2~20 mg·L-1),使用0.1 mol/L盐酸或氢氧化钠溶液调节pH值至5,再分别向离心管中加入0.0200 g Al-OH-HAP吸附剂。上述溶液分别在15 ℃、25 ℃、35 ℃、45 ℃下振荡12 h,静置30 min,取上清液用0.45 μm滤膜过滤后,测定滤液的F-浓度。
吸附效率(η)和吸附容量(qe)计算如(1)和(2)式所示:
(1)
(2)
式中:C0和Ce分别为吸附前后F-浓度(mg/L),V为溶液体积(L),m为吸附剂的质量(g)。
2.5.3 吸附动力学
取1.0 g Al-OH-HAP吸附剂放入1 L F-溶液(10 mg/L)烧杯中,分别在25 ℃、35 ℃和45 ℃水浴中恒温振荡。每隔一段时间取5 mL上清液,上清液用0.45 μm滤膜过滤后,测定滤液的F-浓度。
2.5.4 共存阴离子影响
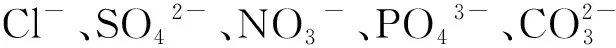
3 结果与讨论
3.1 制备条件对除氟效率的影响
图1(a)为n(Al3+/OH-)对除氟效率的影响,n(Al3+/OH-)从0.2增加到1时,除氟效率从75.5%增加到92.71%,相对应的除氟容量从7.556 mg/g增加到9.271 mg/g。后随着n(Al3+/OH-)的进一步增大,除氟效率逐渐降低。对比HAP除氟容量,改性后HAP得到显著提高[14]。
图1(b)为n(Al-OH)对除氟效率的影响,随着n(Al-OH)的增大,除氟效率和吸附容量迅速提高,当n(Al-OH)大于10 mmol后,除氟效率和吸附容量趋于平缓,考虑到经济成本及Al3+量过大,在水溶液中释放引起Al中毒的可能性,本实验研究制备的Al-OH-HAP吸附剂选择n(Al3+/OH-)=1、n(Al-OH)=10 mmol。论文中无特殊说明,测试和实验所用Al-OH-HAP样品制备条件均为n(Al3+/OH-)=1、n(Al-OH)= 10 mmol。
3.2 Al-OH-HAP结构表征
3.2.1 红外分析

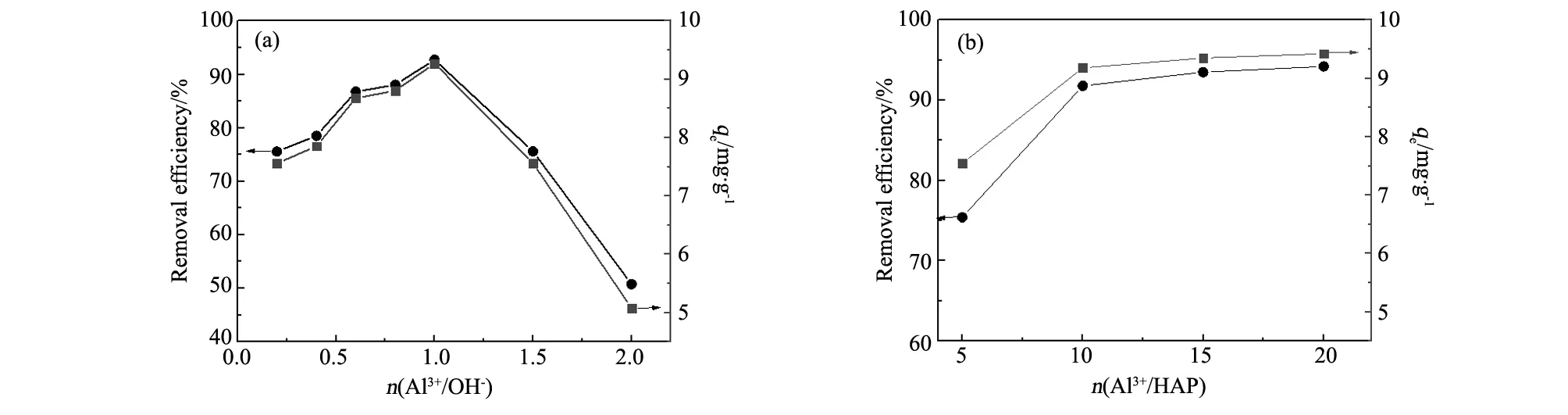
图1 制备条件对Al-OH-HAP除氟效率的影响 Fig.1 Effect of various parameters on removal efficiency and absorption capacity of Al-OH-HAP (a) n(Al3+/ OH-), (b) n(Al-OH) C0=10 mg/L,m=0.05 g,t=12 h,T= 25 ℃)
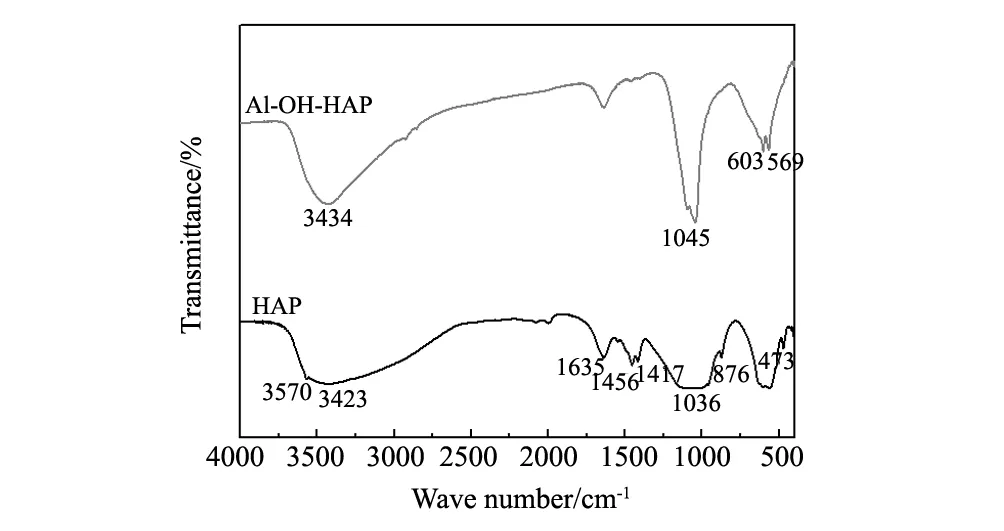
图2 HAP和Al-OH-HAP红外谱图Fig.2 FTIR spectra of HAP and Al-OH-HAP
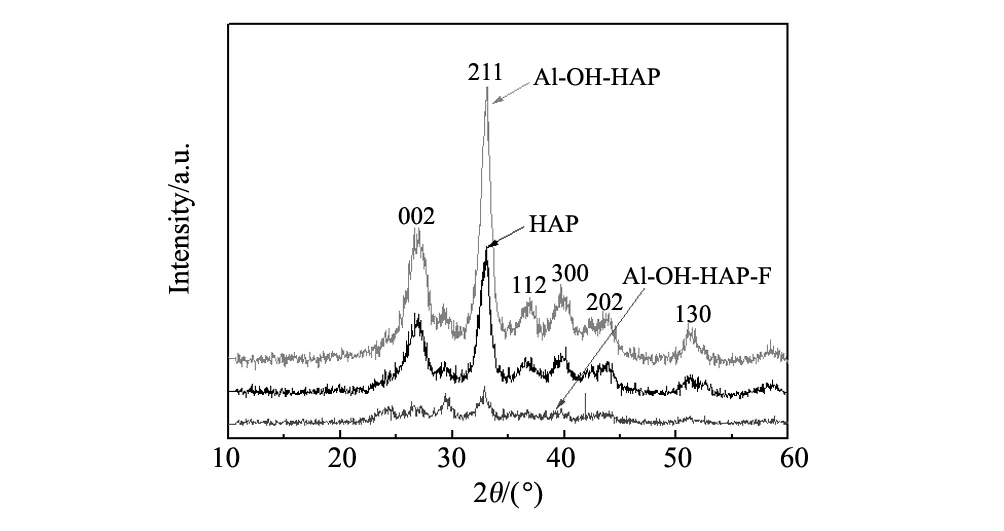
图3 HAP、Al-OH-HAP和Al-OH-HAP-F的XRD谱图Fig.3 XRD patterns of HAP, Al-OH-HAP and Al-OH-HAP-F
3.2.2 XRD分析
图3为HAP、Al-OH-HAP和 Al-OH-HAP-F的XRD图,根据JCPDS No.74-0566可知,2θ=26.92°、32.98°、36.98°、39.73 °、43.73°和51.17°分别对应于HAP (002)、(211)、(112)、(300)、(200)、和(130)晶面的特征吸收峰[15-16]。相比较改性前后晶体晶面对应的特征吸收峰位置没有发生变化,只是强度增大,说明改性后的HAP,晶粒更加完整,结晶度更高[17]。而Al-OH-HAP吸附F-后,结晶度大幅度减弱,主要因为F-不仅取代OH-进入了样品晶格中,而且与Al3+形成AlF3结构,导致了Al-OH-HAP结晶度减弱。
3.2.3 SEM分析

图4 扫描电镜图(a) HAP,(b) Al-OH-HAP Fig.4 SEM images of (a) HAP, (b) Al-OH-HAP
图4a和b分别为HAP和Al-OH-HAP样品的SEM图。HAP由性状不规则的片状小晶粒团聚而成,然而经过Al-OH-HAP改性后,片状小晶粒团聚减弱,分散更加均匀,有利于比表面积的提高,HAP外观形貌并无发生明显的变化。
3.2.4 BET分析
图5(a)和(c)为Al-OH改性前后HAP的N2吸附-脱附等温线图。该等温线呈现典型的IV等温线和H3滞后环[18-19]。图 5B和D为相对应的HAP和Al-OH-HAP孔径分布。HAP和Al-OH-HAP的孔径分布中心分别为26.13 nm(图5(b))和26.46 nm(图5(d))。根据国际纯粹与应用化学协会规定,微孔大小为<2 nm,介孔为2~50 nm,大孔为>50 nm,因此本研究制备的Al-OH-HAP大部分孔为介孔结构。由Brunauer-Emmett-Teller(BET)分析法得到HAP和Al-OH-HAP比表面积分别为106.75 m2/g和220.45 m2/g。改性后比表面积得到大幅度的增加,主要因为Al3+的结晶学半径小于Ca2+,当Al3+取代部分Ca2+进入到HAP晶格结构中,由于晶格常数的变小,导致Al-OH-HAP晶体颗粒尺寸有所减小[20],使得Al-OH-HAP具有更大比表面积。
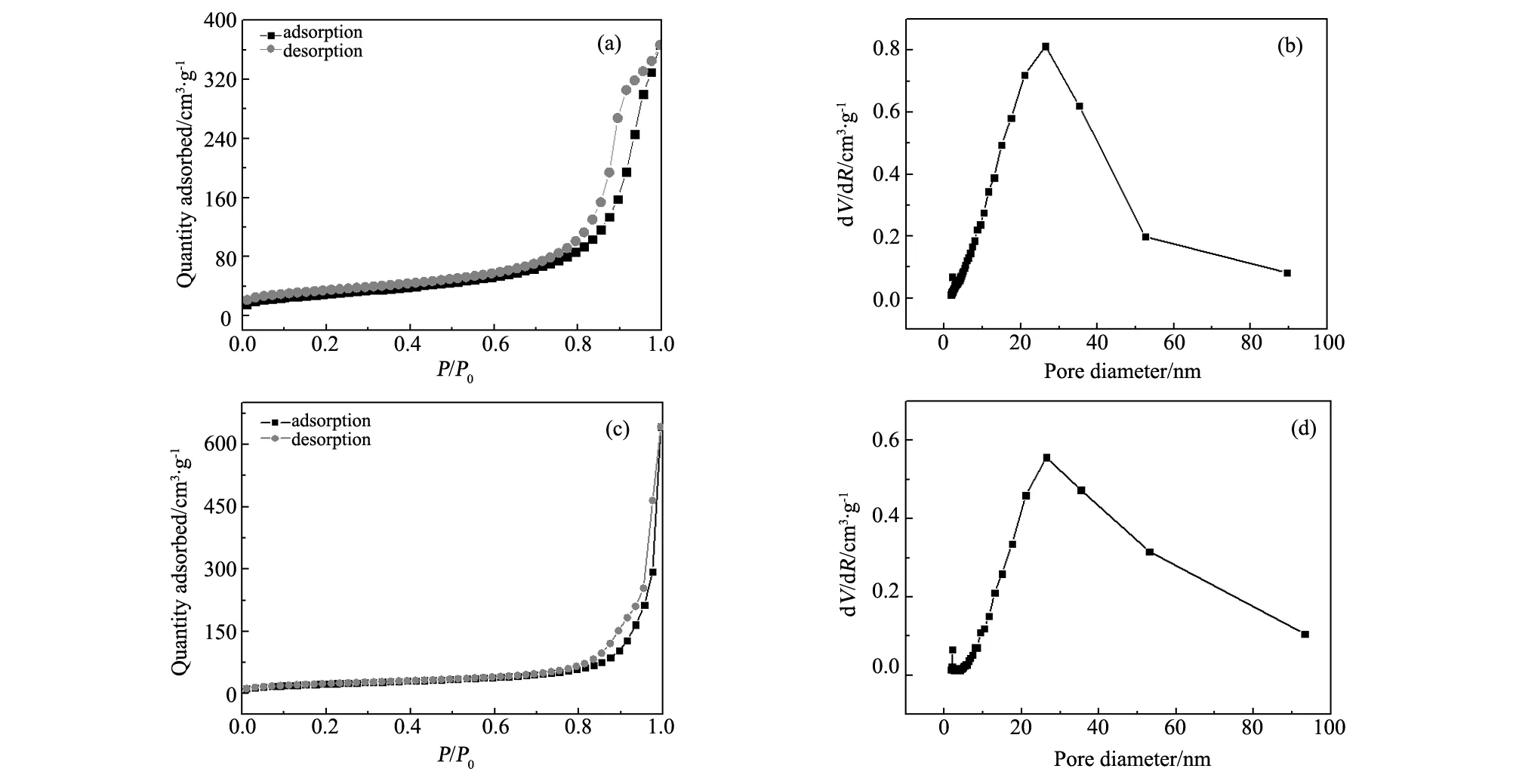
图5 N2吸附-脱附曲线和孔径-孔容分布(a, b) HAP, (c, d) Al-OH-HAP Fig.5 N2 adsorption-desorption isotherms and pore size-pore volume distribution plots (a, b) HAP and (c, d) Al-OH-HAP
3.3 pH值的影响
图6为pH值对Al-OH-HAP除氟吸附容量的影响。pH=3~5范围的酸性条件下,吸附容量随着pH值的上升而逐渐增大,当pH=5.0时,吸附容量达到最大值为20.51 mg/g。主要因为在强酸条件下,Al-OH-HAP表面带正电荷,此时溶液中多数F-以HF的形式存在,为电中性,不利于吸附。随着溶液中pH值进一步增大,碱性增强,Al-OH-HAP表面带正电荷逐渐减少,负电荷量逐渐增多,与溶液中的F-产生静电排斥力,导致吸附容量下降。
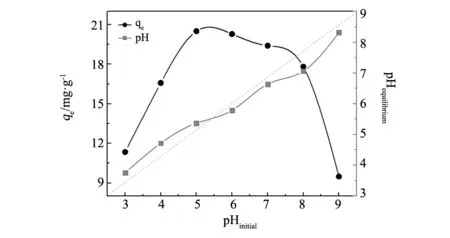
图6 pH值对Al-OH-HAP吸附容量影响 Fig.6 Effects of pH value on the adsorption capacity of Al-OH-HAP
3.4 吸附热力学
采用Langmuir和Freundlich等温模型,对Al-OH-HAP吸附水溶液中的F-吸附等温平衡进行数据拟合。Langmuir模型[21]和Freundlich模型[22]形式如下:
(3)
qe=KFCe1/n
(4)
其中:qe是平衡吸附容量(mg·g-1),qmax是最大吸附容量(mg·g-1),b是吸附平衡常数(L·mg-1),KF是反映吸附量的吸附常数(L·g-1),n是反映吸附强度的吸附常数。
图7为不同温度下吸附平衡浓度与吸附容量之间的关系,随着吸附平衡浓度的增大,Al-OH-HAP对F-的吸附容量逐渐增大。且温度越高吸附容量越大,说明Al-OH-HAP对F-的吸附是一个吸热反应,温度高有利于吸附。
采用Langmuir和Freundlich模型对实验数据进行拟合,参数结果见表1。从Langmuir模型拟合得到吸附温度从25 ℃增加到45 ℃,对应的最大吸附容量(qmax)从31.80增加到36.15 mg/g。对比两模型拟合方程的决定因子R2值,Langmuir模型更加适合于该吸附体系,说明Al-OH-HAP对F-的吸附更趋近于单层吸附。吸附过程中化学吸附占主导地位。
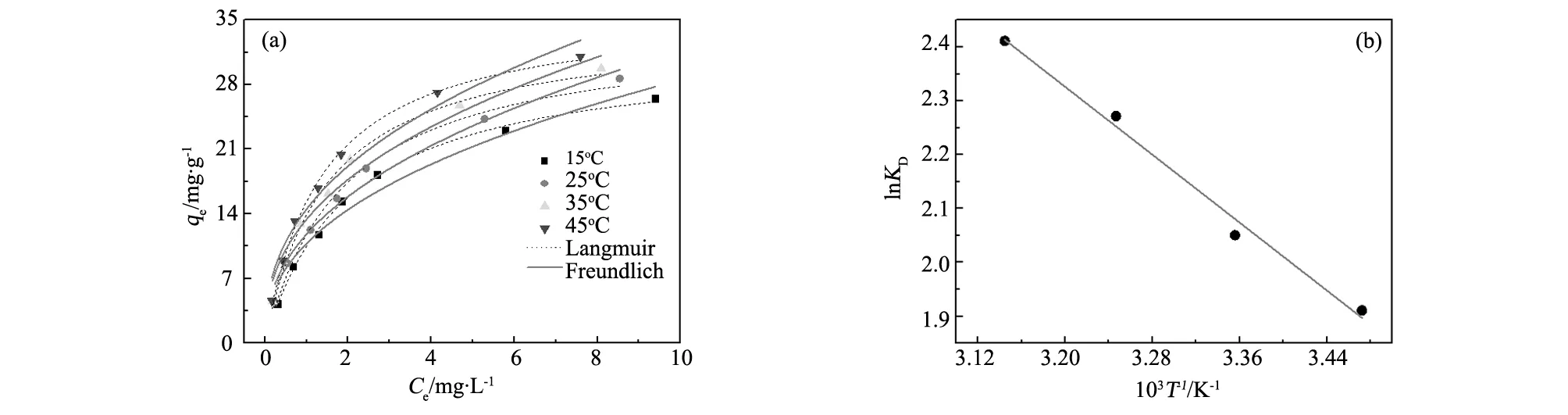
图7 (a) 吸附等温平衡曲线,(b) lnKD与T-1的关系 Fig.7 (a) Equilibrium isotherms for fluoride with Al-OH-HAP, (b) relationship between lnKD and T-1
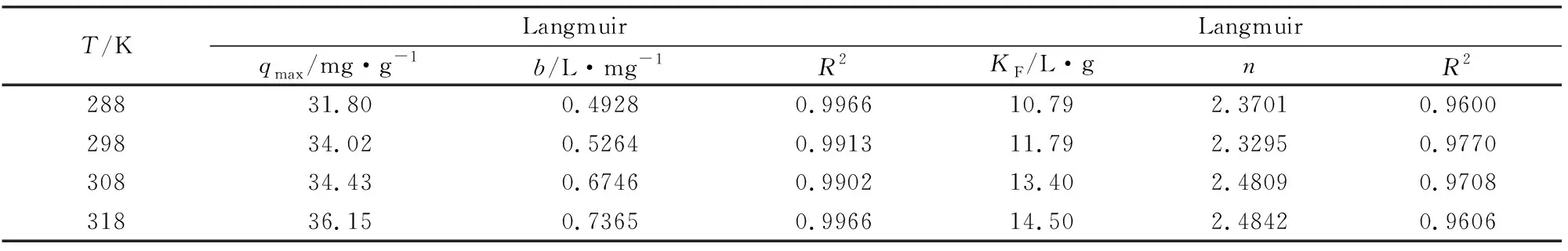
表1 Langmiur和Freundlich模型的拟合参数Table 1 Fitted parameters of Langmuir and Freundlich models
利用吉布斯自由能(△G0)、焓变(△H0)和熵变(△S0)等热力学参数表达吸附过程中能量变化及温度等因素对吸附作用的影响,表达式如下[23-24]:
△G0=-RTlnKD
(5)
(6)
(7)
式中:R为气体常数取值为8.314 J·mol-1·K-1,取氟离子浓度为10 mg·L-1,以lnKD对T-1作图,如图7(b)。由图7(b)可计算得斜率为12.10,截距61.27,通过公式可分别计算出ΔGo、ΔHo和ΔSo的值,见表2所示。在不同温度下该吸附反应的ΔGo均小于0,ΔHo为正值,说明Al-OH-HAP对F-的吸附是一个自发的过程,且属于吸热过程。随着温度的升高,ΔGo逐渐减小,说明温度升高有利于吸附反应进行。ΔSo为正值,表明该吸附反应混乱度增加,是一个熵增过程。
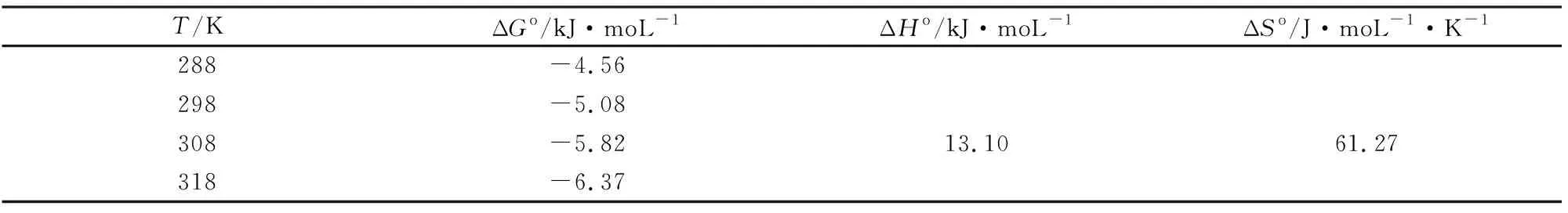
表2 不同温度下热力学参数值(CF-=10 mg·L-1)Table 2 Thermodynamic parameters at different temperatures during fluoride adsorption on Al-OH-HAP
3.5 吸附动力学
吸附动力学主要是用吸附速率来说明吸附动态平衡过程。本研究采用拟一级动力学、拟二级动力学和颗粒内扩散研究吸附动力学机制[23,25-26],各方程如下所示:
ln(qe-qt)=lnqe-k1t
(8)
(9)
qt=kpt1/2+c
(10)
qt和qe(mg·g-1)分别为t时刻和平衡时对应的吸附容量,k1(min-1)和k2(g·mg-1min-1)为吸附速率常数,kp为扩散因子。

图8 动力学模型数据拟合(a)拟一级,(b)拟二级,(c)颗粒内扩散 Fig.8 Fitting curves of adsorption kinetics(a)Pseudo first-order, (b)Pseudo second-order, (c)Intra-particle diffusion
图8为分别采用以上三个动力学模型拟合实验数据,相关参数总结于表3中。从图8和表3中可知,相比较而言,准二级动力学模型中R2均大于0.999,说明准二级动力学模型非常更适合该体系。说明Al-OH-HAP对F-的吸附以化学吸附为主,即F-与Ca2+或Al3+发生了交换吸附作用。图8C可看出,该吸附过程分为三个阶段:第一阶段为颗粒扩散过程引起的快速反应阶段;第二阶段为慢速阶段,可能对应的是化学吸附过程;第三阶段为吸附平衡过程。
利用Arrhenius方程可计算出该吸附过程反应活化能(Ea),如下式:
(11)
式中k为吸附速率常数,T为反应温度,Ea为反应活化能,以lnk对T-1作图,根据直线斜率即可求得反应活化能(Ea)。图9为lnk与T-1之间关系图,利用该图计算得到拟一级和拟二级动力学模型反应活化能Ea分别为2.55 kJ·mol-1和33.08 kJ·mol-1,也验证了颗粒扩散过程是快速反应阶段,而慢速阶段对应化学控制过程。

表3 Al-OH-HAP对F-的吸附动力学模型拟合参数(CF-=10 mg·L-1)Table 3 Kinetic parameters for adsorption of fluoride on Al-OH-HAP
3.6 共存离子的影响
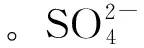
图9 lnk与T-1的关系 Fig.9 The relationship of lnk and T-1
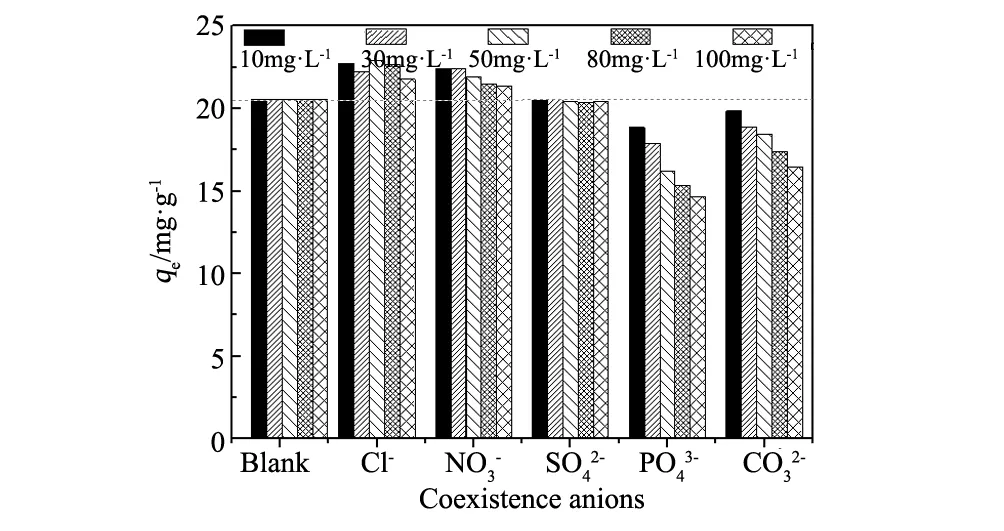
图10 不同阴离子对氟离子吸附的影响 Fig.10 Effect of anion on removal efficiency of fluorine ions
4 结 论
(1)利用简单的共沉淀法制备了Al-OH-HAP,考察了n(Al3+/OH-)和n(Al-OH)等因素对除氟效率的影响。最佳的制备工艺条件为n(Al3+/OH-)=1和n(Al-OH)= 10 mmol,除氟效率显著提高。
(2)与HAP相比,改性后的Al-OH-HAP结晶度大大提高,主要因为Al3+进入HAP晶格后取代了部分Ca2+,而Al3+比Ca2+多一个正电荷,具备更高的晶格,有助于晶体的生长。
(3)Al-OH-HAP的平均孔径为26.46 nm,大部分孔为介孔,改性后Al-OH-HAP的比表面积从106.75 m2/g增加到220.45 m2/g。
(4)Langmuir模型和拟二级动力学模型适合于该吸附体系,说明Al-OH-HAP对F-的吸附更趋近于单层吸附,吸附过程中化学吸附占主导地位。吸附热力学数据ΔGo<0、ΔHo>0和ΔSo>0说明该吸附过程属于自发、吸热的熵增过程。拟一级和拟二级动力学模型反应活化能Ea分别为2.55 kJ·mol-1和33.08 kJ·mol-1,该吸附过程是由物理吸附和化学吸附共同作用的结果。
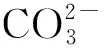
(6)酸改性的HAP的吸附容量约为5~6 mg/g,本方法改性得到的Al-OH-HAP的吸附容量为11.78 mg/g,说明该方法制备的Al-OH-HAP除氟吸附剂具有较高的除氟容量,是一种可值得研究和开发的除氟材料。
