脑深部刺激电极重建临床应用的可靠性研究
2019-02-10郑小斌余良宏万欣龙王惠清林章雅康德智
郑小斌 余良宏 万欣龙 王惠清 俞 挺 何 秋 林章雅 康德智△
1)福建医科大学附属第一医院神经外科 福建省神经医学中心,福建 福州 350005 2)固原市原州区人民医院神经脊柱外科,宁夏 固原 756000
当前社会人口老龄化加重,帕金森病(Parkinson’s disease,PD)作为最常见的神经退行性疾病,在中国乃至全球的发病率均逐年上升,也给社会和家庭带来沉重负担[1-3]。病情早期,通过药物的修饰治疗与左旋多巴的替代治疗,多数能较好控制和改善PD的运动症状[4-5]。但随着病程进展,多数患者的药物疗效下降,出现药效波动以及药物相关性异动症等运动障碍[6]。脑深部刺激术(deep brain stimulation,DBS)对帕金森病临床症状改善的显著意义已被认可,是中晚期帕金森病重要的治疗手段[7-8]。在疾病诊疗技术规范化进一步提高的基础上,DBS应用于中晚期帕金森病外科治疗的患者数量逐年快速增加[9]。颅内电极植入位置的准确性,直接影响着DBS术后的疗效以及程控治疗难度[10-11]。随着植入电极的研发,新型方向性多触点电极也将投入临床[12],按照传统的逐点筛选方式,将耗费大量的人力以及患者的配合度将受影响,因此如何准确评估每个电极触点的空间位置,显得尤为关键。本研究介绍基于术后CT与术前MRI融合的颅内电极三维重建方式,辅助评估颅内电极位置,并对其重建的准确性进行研究。
1 资料与方法
1.1临床资料回顾性纳入2017-01—12于福建医科大学附属第一医院神经外科接受双侧丘脑底核(subthalamic nucleus,STN)DBS治疗的PD患者21例,手术病例筛选符合《中国帕金森病脑深部电刺激疗法专家共识》的DBS治疗适应证。纳入研究的患者一般资料包括性别、年龄、病程、Hoehn-Yahr分期、左旋多巴等效剂量、统一帕金森病评定量表(unified Parkinson’s disease rating scale,UPDRS)中的运动评分(UPDRS Ⅲ)、Schwab & England 日常活动评分(SEADL),以及开机程控参数。
1.2手术方法术日患者局麻下安装Leksell-G立体定向头架基座,基座轴位平面尽量平行于眶耳线成11°的夹角线,颅脑薄层CT断层扫描切线平行于该夹角线[13]。将CT数据以DICOM格式导入BrainLab手术计划系统(iPlan Stereotacxy,德国BrainLab公司)。以患者的3.0T 磁共振(3.0T,西门子公司)的3D-T1序列为融合模板,将T2序列与薄层CT分别与3D-T1序列通过软件的自动融合模块进行融合,并于轴位、矢状位以及冠状位进行融合精度检查,以微调模块进行融合误差校准。由两位具有5 a以上DBS手术计划制定经验的医师共同选取STN电极植入靶点并校验Leksell-G头架立体定向参数。术中局部麻醉下通过Leksell头架弧形弓引导颅骨钻孔,置入微电极进行单细胞电生理记录(microelectrode recording,MER),根据电生理特征确定最终植入参数并置入脑深部刺激电极(PINS-301,品驰公司),随后进行粗刺激测试运动功能改善情况与不良反应阈值,随后以lead-Lock电极固定装置固定电极。全身麻醉下将颅内电极颅外段经皮下隧道与埋置于胸部皮下囊袋的双列脉冲发生器(品驰公司)相连,并通过脉冲发生器的固定孔与锁骨下骨膜缝合固定。术后颅脑薄层CT于术后3~4周扫描获取,依据《帕金森病脑深部电刺激疗法术后程控中国专家共识》原则[14]进行开机程控。
1.3影像学扫描参数采用T1加权扫描获取3D-T1序列,层厚1.0 mm,无间距,颅顶至下颌角。T2序列扫描范围为侧脑室顶部至桥延沟水平,层厚2.0 mm,无间距。3D-T1与T2序列扫描基线均平行于AC-PC连线。薄层CT扫描层厚0.625 mm,无间距,颅顶至下颌角。扫描基线尽量平行于夹角线[15-16]。
1.4颅内电极及核团三维重建在Brain Lab Stereotacxy手术计划系统中导入术后薄层CT数据,与术前3D-T1序列进行自动融合,必要时经微调模式进行平移或旋转校准融合误差。根据CT数据中脑组织与电极的CT值设定最大分割片段数量来剪除颅脑软组织与金属伪影,根据电极范围设定感兴趣区域(ROI)来限定自动分割的范围,随后通过自动分割模块提取电极数据。STN及红核采用灰度匹配方式在磁共振T2序列进行半自动边界勾勒,并基于系统内的Schaltenbrand & Wahren图谱辅助判定丘脑底核与黑质等周围结构的边界微调修正边界。最后基于系统3D容积体绘算法自动进行电极及核团立体重建(图1)。
1.5最佳电极触点筛选与三维参数获取影像三维重建后,由上述手术计划制定医师基于颅内电极各触点与STN的位置关系,选取最佳电极触点。将AC、PC中点定为颅脑原点(MP),在系统中分别于轴位与矢状位、冠状位测量电极最佳触点几何中心与MP的距离,将距MP的左右旁开距离定为X,前后距离定为Y,腹背距离定为Z。依据上述方法测量开机初次程控所选的电极触点几何中心的三维参数。
1.6研究分组根据三维重建影像中双侧电极的最佳触点几何中心与STN边界的位置关系将病例分为2组,将双侧最佳触点几何中心均位于STN边界内归为组1,否则归为组2。
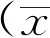
2 结果
21例患者中17例双侧电极最佳触点几何中心均位于STN边界内(组1),其余4例(组2)中,3例单侧最佳触点几何中心位于STN边界内,另1例均不位于STN边界内。
2组病例的性别构成比、年龄、病程以及Hoehn-Yahr分期、UPDRS Ⅲ总分值、SE-ADL分值、LEDD差异均无统计学意义(表1)。
表1 2组一般情况与基线指标±s)
在基于重建电极筛选的最佳触点与开机程控所选触点的吻合情况方面(表2),总体的吻合率为83.33%(35/42),其中左侧最佳触点的吻合率为80.95%(17/21),右侧为85.71%(18/21),两侧吻合率之间差异无统计学意义(P>0.999)。虽然组1的吻合率高于组2,但2组吻合率差异无统计学意义(P=0.113)。

表 2 最佳触点吻合情况
在最佳触点的空间坐标方面,基于颅内电极重建后筛选的触点坐标:中线旁开距离(X)左侧为(11.62±0.91)mm,右侧为(12.01±0.75)mm,与开机程控所选触点坐标值差值分别为(-0.05±0.32)mm、(0.03±0.27)mm;距大脑原点前后距离(Y)左侧为(3.53±0.81)mm,右侧为(3.61±0.76)mm,二者均大于开机程控所选触点坐标值,与开机程控所选触点坐标值差值分别为(0.06±0.47)mm、(0.05±0.36)mm;距大脑原点矢状距离左侧为(4.88±0.76)mm,右侧为(4.84±0.66)mm,二者均大于开机程控所选触点坐标值,与开机程控所选触点坐标值差值分别为(0.07±0.81)mm、(0.08±0.62)mm,但上述空间三轴(X/Y/Z)上差异均无统计学意义(表3)。
表3 最佳触点空间坐标±s)
注:坐标X为大脑中线旁开距离;Y为距大脑原点前后距离;Z为距大脑原点矢状距离
3 讨论
随着脑深部刺激电极植入的手术方法不断改进,DBS治疗中晚期帕金森病的疗效与稳定性也进一步被认可,接受DBS治疗的PD患者越来越多[17-19]。脑深部刺激电极植入的准确性是影响PD患者DBS疗效的关键因素[10-11,20],精确的刺激电极植入伴随着更稳定的临床症状的改善[21-22]。而准确适宜的术后程控,也是进一步发挥DBS可调控性与疗效优化的一个重要因素,尤其在电极植入位置欠理想的情况下,准确的程控在取得疗效优化与降低电刺激不良反应之间的平衡起到关键作用[14,23],而随着密集触点方向性刺激电极的研发以及临床应用的前景不断被认可,如何整体呈现密集触点的朝向与STN边界的位置关系,将给程控治疗带来更大的挑战[11,24-25]。因此,对于临床医师来说,准确分析颅内电极的空间位置,对于预判术后的疗效及程控方案的选择有重要的指导意义[22,26]。
图1 基于BrainLab手术工作站DBS电极重建与三维断层影像 A:DBS电极(绿)与STN(橙)、红核(红)立体重建;B:轴位断层影像;C:矢状位断层影像;D:冠状面断层影像Figure 1 DBS electrode reconstruction based on BrainLab surgical workstation and three-dimensional tomographic image.A:DBS electrode (green) and STN (orange),red nucleus (red) stereo reconstruction;B:Axial tomographic image;C:Sagittal tomographic image;D:Coronal tomography
术后的磁共振平扫是最早被应用于判断颅内电极位置的方法,但植入体内的脉冲发生器及与颅内电极连通后,目前仅能执行低场强的磁共振扫描,其对于脑深部核团的轮廓及其与周围结构的位置关系,显像欠清晰,并且金属电极植入后对于周围组织的磁共振成像的漂移影响,目前仍存在争议,因此,术后磁共振扫描对于准确评估电极位置具有明显局限性。近年来基于术后薄层CT与术前磁共振融合技术,将CT成像的电极金属影像成像在术前的高场强三维磁共振影像中,能够提高判断颅内电极位置的准确性,临床应用的推广较快,已成为评估颅内电极植入准确性的主要方法[27-28]。但该技术呈现的是二维的断层影像,对于分析颅内电极,特别是电极尖端各触点与STN等目标核团的三维空间关系,欠缺直观。而本研究基于神经外科常用的神经导航工作站进行颅内电极与目标核团的三维重建,以此分析二者的三维空间位置关系,并进一步判断刺激电极各触点与目标核团的位置关系(图1),对于选择最佳刺激触点更加立体直观,有利于辅助提高临床程控治疗的准确性与效率。
本研究中通过分析基于重建电极筛选的最佳触点与标准开机流程所选触点的吻合情况(表2),探讨该项技术临床应用的准确性及可靠性。两种方式所选的最佳触点的吻合度达83.33%,且统计学分析上侧别不对其吻合度有影响。两种筛选方式的最佳触点吻合度,电极植入精确度更高的组1病例高于组2病例(88.24% vs 62.50%),可能与电极植入精度不佳后,标准程控流程选择最佳触点过程,需要在最优刺激效果与最小刺激不良反应之间取得平衡,而基于刺激电极三维重建技术倾向选择与STN几何中心的最小距离最小的刺激触点,二者的出发点不同有关,但二者差异无统计学意义。
本研究进一步比较了两种方式所筛选的最佳触点的大脑三维坐标之间的差异,基于重建电极筛选的最佳触点坐标更靠后侧以及深度更深,可能与基于标准程控逐点筛查更倾向选择触点靠STN背侧的部位,以更容易观察到震颤症状的改善[29-30],而基于三维重建更倾向筛选据STN几何中心更近的刺激触点,但这些差异无统计学意义(表3),并且二者的坐标值与其他研究报道的理想靶点坐标均相近[31-32],提示本研究技术应用于临床筛选最佳程控触点的准确性与可靠性。
本研究初步评估脑深部刺激电极三维重建技术在筛选最佳DBS刺激触点临床应用的可行性,纳入的病例样本量较小是研究的不足之处,需后期更多的病例样本进一步分析其临床应用的可靠性,并基于该项技术研究不同植入特征的电极对临床疗效的影响,有利于研究不同电极植入特征与不同亚型帕金森病的DBS疗效的相关性,可能有利于细化帕金森病DBS个体化治疗方案。
脑深部电极重建技术能够立体直观呈现颅内电极与DBS目标核团的空间位置关系,其与传统逐点筛查的程控方式所选的理想刺激触点,存在较高的吻合度,可能有助于提高术后程控最佳DBS触点筛选的准确性与效率,以进一步优化临床疗效。
