轻度阿尔茨海默病不同慢跑时间抗氧化能力的变化
2019-02-10张晓明王运良王姝婧万亚巍
张晓明 王运良 杨 艳 王姝婧 万亚巍 夏 雨
1)解放军第990医院神经内科,河南 驻马店 463008 2)解放军第960中心医院神经内科,山东 淄博 255300
阿尔茨海默病(AD)即老年痴呆,是一种慢性退行性神经疾病,以记忆减退和认知功能障碍为临床特征[1-3],大部分患者常并发神经精神症状[4-6]。随着老龄人口逐年增多,其发病率也逐年增加,为4.00%~6.60%[7],发病严重威胁患者的日常生活[8],并降低其生活质量,也增加了家庭及社会的负担[9-10]。AD的发生、发展与患者体内氧化应激反应密切相关[11-14],长时间、大强度运动可导致机体氧化-抗氧化系统失衡,氧化应激加剧[15];运动干预可显著增强超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)的活性[16]。不同慢跑时间是否对轻度AD者抗氧化适应能力、记忆及认知功能和日常生活质量有影响,尚有待观察。本次研究对轻度AD不同慢跑时间者进行血清SOD、丙二醛(MDA)检测及简明智力状态检查量表(MMSE)、阿尔茨海默病评定量表认知分量表(ADAS-cog)、日常生活活动能力评分(ADL)评定。
1 对象和方法
1.1一般资料本组63例AD患者,男34例,女29例;年龄61~76(68.59±5.17)岁。入选标准:(1)符合符合美国神经病学、语言障碍和卒中-老年性痴呆和相关疾病学会(NINCDS-ADRDA)临床诊断标准[17-18],且确诊为轻度AD者;(2)受教育6 a以上,病程2 a以上,不伴精神病性症状和抑郁症状;(3)未进行任何治疗和康复;(4)排除严重心、肝、肾功能障碍以及其他脑变性疾病、脑血管性痴呆、既往存在精神疾病史者。
1.2方法123例轻度AD患者,按随机数字表法分为4组,4组性别、年龄、病程、教育程度等比较无显著性差异(P>0.05)。慢跑Ⅰ组31例,慢跑速度2.5~3 km/h,1次/d,30 min/次,4次/周。慢跑Ⅱ组32例,50 min/次,其他同慢跑Ⅰ组。慢跑Ⅲ组30例,70 min/次,其他同慢跑Ⅰ组,时间为6个月。对照组30例不进行任何锻炼和治疗。4组均于慢跑前或观察前、慢跑或观察6个月后清晨空腹抽静脉血4 mL检测血清SOD、MDA含量。采用黄嘌呤氧化酶法测定SOD、硫代巴比妥酸化学比色法测定MDA,各种操作严格按试剂盒中说明书进行。4组分别在慢跑前或观察前、慢跑或观察6个月后采用MMSE、ADAS-cog、ADL进行评分。
2 结果
2.1血清SOD、MDA水平4组慢跑前或观察前血清SOD、MDA含量比较无明显差异(F=0.067,P=0.977;F=0.180,P=0.910),6个月后比较差异有统计学意义(F=22.672,P=0.000;F=23.501,P=0.000)。慢跑Ⅰ、Ⅱ组均较慢跑前升高或降低(t=3.278,P=0.002;t=8.394,P=0.000;t=2.889,P=0.005;t=8.470,P=0.000),但慢跑Ⅱ组升高或降低更显著(t=3.311,P=0.002;t=2.703,P=0.009)。慢跑Ⅲ组及对照组慢跑前或观察前后无明显变化(t=0.575,P=0.568;t=0.070,P=0.945;t=0.783,P=0.437;t=0.338,P=0.737)。见表1。
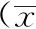
表1 4组慢跑或观察前后血清中SOD、MDA含量比较±s)
2.2MMSE、ADAS-cog、ADL评分4组慢跑或观察前MMSE、ADAS-cog、ADL评分比较无明显差异(F=0.099,P=0.961;F=0.027,P=0.994;F=0.124,P=0.993),6个月后比较差异有统计学意义(F=9.776,P=0.000;F=13.479,P=0.000;F=9.760,P=0.000)。慢跑Ⅱ组慢跑前后比较升高或降低更显著(t=3.922,P=0.000;t=3.850,P=0.000;t=3.495,P=0.001)。慢跑Ⅰ、Ⅲ及对照组慢跑前后或观察前后比较无明显差异(t=1.285,P=0.204;t=1.111,P=0.271;t=0.698,P=0.488;t=1.585,P=0.118;t=1.952,P=0.056;t=1.597,P=0.116;t=0.926,P=0.358;t=1.424,P=0.160;t=1.318,P=0.193)。见表2。
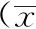
表2 4组慢跑或观察前后MMSE、ADAS-cog、ADL比较±s,分)
3 讨论
氧化应激是指在遇到外界各种不良的刺激时,机体内的一些高活性生物分子(如活性氧自由基、氮自由基)短时间内大量产出,氧化超出了清除的速度,最终导致疾病发生[19]。AD发病的生理于病理目前尚未完全清楚,目前临床多认为与淀粉样蛋白β(Aβ)的沉积、tau蛋白的聚集、神经递质传导受损、线粒体损伤、氧化应激和遗传因素有关[20-24]。在AD的发生、发展过程中,Aβ与氧化应激有密切的关系[25],Aβ的沉积诱导氧化应激的产生,氧化应激反应也可促进Aβ的合成,两者相互促进,导致神经细胞损害和功能失调的恶性[26]。SOD是生物体内最为重要的一种氧自由基清除酶,血清中SOD的活性高低,是评估患者机体清除自由基的能力[27-31],血清中SOD活性降低,机体清除自由基的能力降低,大量的自由基生成,自由基进一步对脑血管和神经组织损害生成大量脂质过氧化产物,如MDA等,清除MDA等自由基又消耗大量的SOD,形成恶性循环,导致神经功能损害加重。MDA是脂质过氧化的产物,可评价机体内氧化应激反应程度的强弱[32-34],间接反映体内自由基水平及组织细胞损伤的程度[35]。MDA含量升高,引发细胞损害,受损的脑细胞内氧自由基及脂质过氧化物不断堆积,释放大量溶解,导致脑组织破坏[36-39]。
AD的发生、发展与Aβ沉积和Tau蛋白磷酸化密切相关,同时氧化应激能够促进Aβ的聚集,AB可通过诱导神经元凋亡等多种途径产生神经损伤作用[40]。Aβ通过多条途径诱导活性氧的产生,加剧氧化应激,进一步引起tau蛋白的高度磷酸化,tau蛋白的异常磷酸化能够引起神经元微管解体,导致神经元突起断裂[41]。
在AD的发生、发展过程中,血清中SOD的含量降低,MDA升高,大量的自由基生成,诱发神经功能的损害及认知功能受损,轻度AD患者血清中SOD的含量越降低及MDA越升高,体内氧自由基和脂质过氧化反应程度越高,神经功能的损害及认知功能受损越严重。SOD可防止氧化应激损伤内皮细胞,从而保护脑神经[42]。运动锻炼加速了体内自由基的清除,改善了体内氧化与抗氧化的失衡[43-47],即运动锻炼使机体抗氧化增强,SOD活性增加,也就意味着血清中SOD含量增加,清除MDA能力增强,MDA含量减少。机体抗氧化增强,MDA生成减少,血清中含量MDA水平降低。本研究显示,对于轻度AD患者,适当的慢跑(慢跑速度2.5~3 km/h,50 min/次,1次/d,4次/周)有利于清除自由基,促使血清SOD的含量升高,MDA降低,改善记忆及认知功能、抗氧化能力,提高其日常生活质量。
