非小细胞肺癌脑转移与血清肿瘤标志物变化的相关性分析
2019-02-10冯青青
周 正 冯青青
郑州大学第二附属医院呼吸与危重症医学科,河南 郑州 450003
肺癌是我国乃至世界范围内目前发病率和病死率最高的恶性肿瘤[1]。据文献报道,2015年我国新发733 000例肺癌,约610 000人因肺癌死亡,其发病率和病死率均位于癌症之首[2]。肺癌分为小细胞肺癌(small cell lung cancer)和非小细胞肺癌(non-small cell lung cancer)两大类,非小细胞肺癌是肺癌中最常见的病理类型,占肺癌发病率的85%[3-6],其中20%~40%的NSCLC患者出现肺癌脑转移[7]。随着近年来因NSCLC治疗水平的提高,NSCLC患者生存时间延长,NSCLC患者出现脑转移的发病率呈上升趋势,若不及时发现和治疗会出现头痛、恶心、呕吐等颅内高压症状,甚至引起脑疝,导致死亡,平均生存时间约2个月[8-9]。NSCLC脑转移早期有90%以上的患者没有明显的中枢神经系统症状,当前首选的诊断方法是临床影像学检查,其中增强磁共振成像(MRI)的敏感性可达84%[5],但结果为阴性时亦不能排除脑转移的可能。研究发现,肿瘤标志物AFP、CEA、NSE、CA125、SCCA-Ag、CYFRA21-1血清学水平高低反映肺癌处于不同临床阶段[10]。本研究拟对上述血清中肿瘤标志物水平的进行分析,探讨其在NSCLC脑转移早期诊断中的意义。
1 资料和方法
1.1研究对象回顾性分析郑州大学第二附属医院2015-01—2017-12就诊的135例NSCLC患者,其中57例肺癌脑转移(观察组),78例未发生脑转移(对照组),同期105例健康体健者(健康组)。135例NSCLC患者中男80例,女55例,年龄52~80(63.2±3.4)岁,体重指数(BMI)18.3~27.6(22.7±1.3)kg/m2;病理类型:鳞癌56例,肺组织病理见图1A,腺癌 79例,肺组织病理见图1B。健康组男63例,女42例;年龄49~83(62.8±2.7)岁,BMI 18.3~28.7(23.2±1.5)kg/m2。3组年龄、性别、BMI比较差异无统计学意义(P>0.05)。NSCLC诊断标准:经组织病理学、细胞学和影像学明确诊断,脑转移患者则经MRI、PET-CT等明确诊断。排除其他部位原发恶性肿瘤脑转移、妊娠期和哺乳期妇女。
1.2方法血清肿瘤标志物检测:采用无热源和内毒素非抗凝试管采集外周静脉血2 mL,离心5 min,取上层血清。应用瑞士Roche公司cobase601全自动电化学发光免疫分析仪及其配套试剂检测肿瘤标志物AFP、CEA、NSE、CA125、SCC-Ag和CYFRA21-1含量。肿瘤组织的病理类型和分化程度由3位高级职称病理医师共同阅读组织切片后确定。
1.3统计学方法采用SPSS 15.5统计软件进行统计学处理,每组间检测采用F检验,组间比较采用χ2检验,变量间相关性分析采用Spearman检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1各组肿瘤标志物含量比较在肿瘤标志物AFP、CEA、NSE、CA125、SCC-Ag和CYFRA21-1含量上,健康组人群最低,对照组次之,观察组最高,与其他2组比较差异有统计学意义(P<0.05)。见表1。
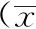
表1 3组血清肿瘤标志物含量比较±s)
2.22组临床特征比较观察组CEA、SCC-Ag、CYFRA21-1和肺癌脑转移升高有关(P<0.05),NSCLC病理学分化程度低也和肺癌脑转移有相关性(P<0.05),而和吸烟史、AFP、NSE、CA125、病理类型无明显相关性(P>0.05)。见表2。
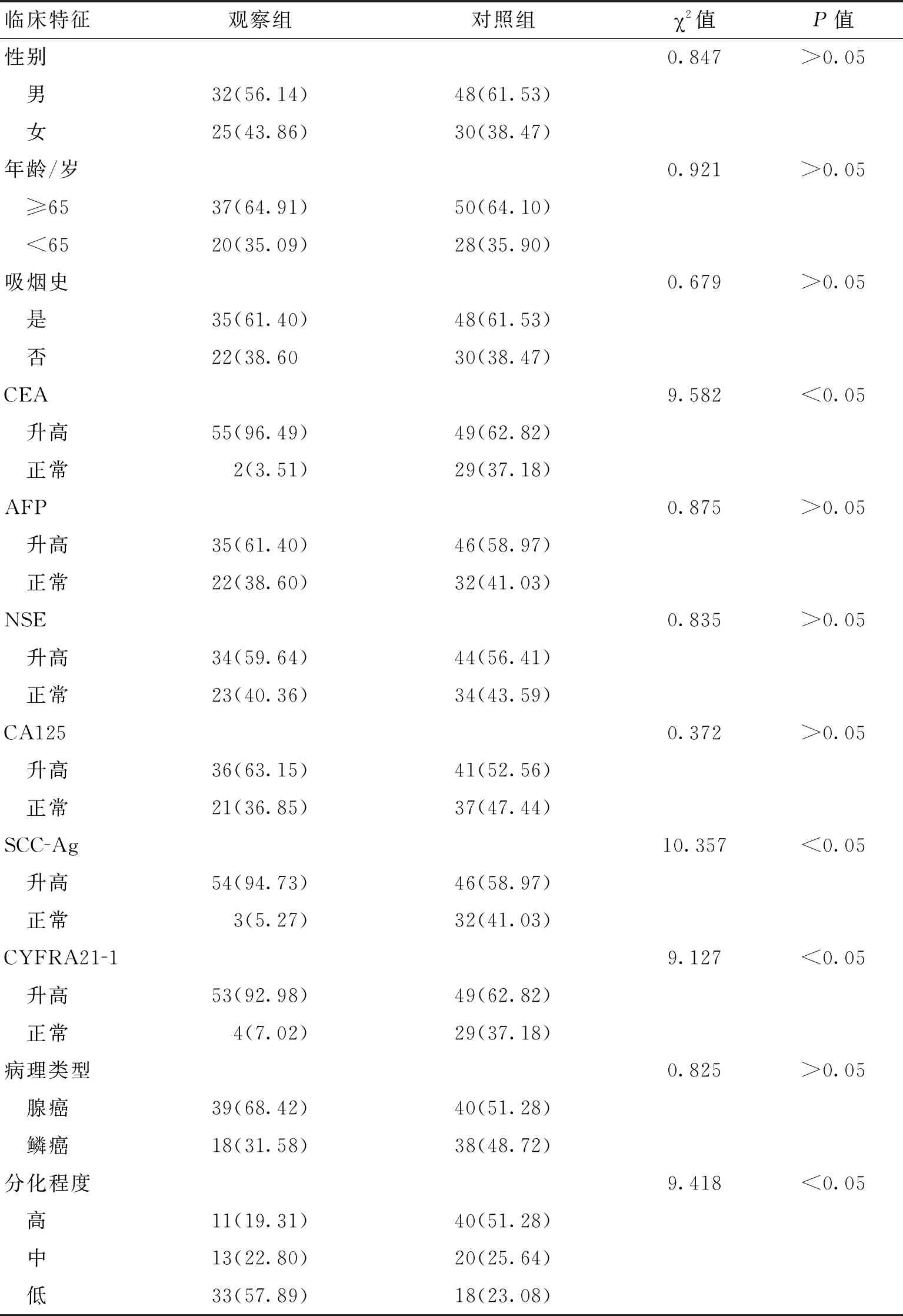
表2 2组临床特征比较 (%)
2.3肺癌脑转移多因素回归分析肺癌脑转移的独立危险因素有血清CEA、SCC-Ag、CYFRA21-1含量升高和组织病理学分化程度(P<0.05)。见表3。
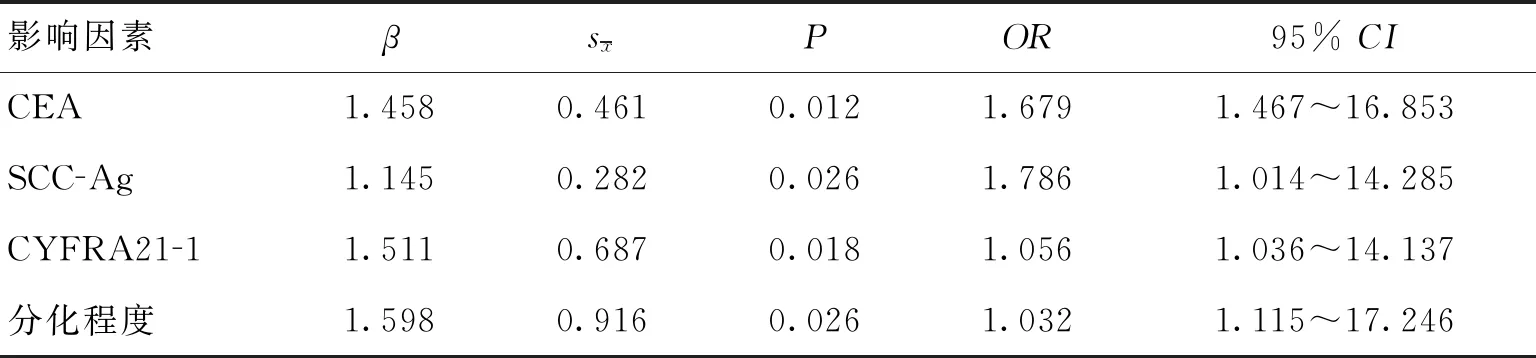
表3 肺癌脑转移多因素回归分析

图1 A:肺腺癌;B:肺鳞癌Figure 1 A:Lung adenocarcinoma;B:Lung squamous carcinoma
3 讨论
肺癌最常见的转移方式是血行转移,而脑部是晚期非小细胞肺癌常见转移部位。研究报道[11-18],由于CT和MRI等影像学检查的局限性,促进了血清肿瘤标志物联合检测在诊断肺癌脑转移诊断方面的重要性。肺癌相关的肿瘤标志物是肺癌在发生和发展过程中产生的活性化学物质,不同组织类型的肺癌可表达相同肿瘤标志物[19-25],也可表达不同肿瘤标志物,所以联合检测肿瘤标志物能提高肺癌诊断的准确程度[26-28]。
CEA是一种可溶性的血清糖蛋白,早期研究认为消化道肿瘤是CEA主要升高原因,但近年来研究发现肺癌脑转移、乳腺癌等患者血清中的CEA含量也明显增高[29-32]。研究[12,33-35]指出,在肺腺癌患者70% CEA显示为阳性,但CEA在肺鳞癌中也有高表达[13]。在NSCLC患者中,能够通过血清CEA含量判断是否发生转移以及部位的情况。有研究[14,36]通过PCR法检测肺癌切除淋巴结组织标本的CEA mRNA表达发现,CEA mRNA阳性者生存时间明显缩短,表明CEA在预测肺癌转移上有一定价值。
本研究显示,肺癌脑转移患者血清CEA明显高于对照组(P<0.05),提示CEA是肺癌脑转移的独立危险因素。其原因可能是CEA与IgA的分子量相似,可通过血脑屏障,肿瘤细胞黏附在脑血管系统中,促使脑组织渗透、捕获、存活和增殖[15]。临床上肺癌出现脑转移属于晚期肺癌,相对于未发生脑转移的肺癌而言会有更多的肿瘤负荷[37-38]。因此,血清CEA含量会明显增高。SCC-Ag广泛分布于宫颈鳞癌中,近些年来有文献报道亦广泛存在于肺、食管等器官的肿瘤组织中,特别是在鳞状细胞癌上有高表达[16]。报道[17]称SCC-Ag可作为鳞状上皮细胞癌标志物。
CYFRA21-1存在于恶性肿瘤上皮细胞蛋白的中间丝,是一种相对分子量为(40~68)×103的蛋白,由于细胞溶解释放至血液循环。肺鳞癌是来源于上皮细胞的恶性肿瘤,有较快的生长速度,从而导致大量癌细胞增殖,肺鳞癌细胞破坏后释放CYFRA21-1进入血液[18-19]。本研究表明,观察组血清CYFRA21-1含量高于对照组(P<0.05),其在非小细胞肺癌脑转移特别是鳞癌的诊断和病情监测有临床应用意义。
基础医学证实,分化程度一直是肺癌脑转移的独立因素,分化程度越低,恶性程度越高,肿瘤会生长迅速,就越容易转移[20,39-42]。血清肿瘤标志物CEA、SSC-Ag和CYFRA21-1含量升高是肺癌脑转移的独立危险因素,临床上要结合患者临床特征、相关影像学检查、肿瘤分化程度等以提高NSCLC脑转移诊断水平。
