橙皮苷栓剂的研制及质量评价
2019-01-28金辉林迦勒王陈翔周子晔
金辉,林迦勒,王陈翔,周子晔
(温州医科大学附属第一医院 药学部,浙江 温州 325015)
痔疮是一种由于肛门部位静脉丛发生病理性改变而导致的慢性疾病。痔疮的主要致病原因是直肠下段黏膜和肛管皮肤下的静脉丛淤血、扩张和屈曲,主要临床表现是静脉团破裂导致的便血,严重时伴有血栓或炎症导致的肿胀和疼痛。现代医学治疗痔疮的主要目的是解除痔疮的临床症状,而非通过手术消除痔体[1]。
橙皮苷是一种天然黄酮类衍生物,具有双氢黄酮氧苷结构,可以从芸香科植物酸橙或甜橙的干燥果皮提取获得,同时也广泛存在于豆科、唇形花科、蝶形花科等多种植物中[2]。橙皮苷具有维生素P样作用,能增强毛细血管韧性,维持血管正常渗透压,缩短出血时间[3-4],同时还具有抗炎作用,这与临床治疗痔疮的思路一致。目前国内外用于治疗痔疮的橙皮苷剂型只有片剂,未见橙皮苷栓剂的临床应用报道,如能将其制成栓剂直接作用于给药部位治疗痔疮,临床应用前景将会十分广阔。本课题通过制备橙皮苷栓剂,并对其进行质量评价,为橙皮苷新剂型的开发提供药剂学实验数据。
1 材料和方法
1.1 试剂 橙皮苷原料药(批号20160215,浙江龙游振强生物科技有限公司);橙皮苷标准品(纯度96.1%,批号110721-201617,国家食品药品检定研究院);聚乙二醇400(批号150815,江苏彤盛化学试剂有限公司);聚乙二醇6000(批号20140711,上海 国药集团化学试剂有限公司);甘油、液体石蜡(南昌白云药业有限公司);二甲基亚砜(北京索莱宝科技有限公司);甲醇(色谱纯,美国SPECTAUM有限公司);其余试剂均为分析纯。
1.2 仪器 Waters 600E-2487高效液相色谱仪(美国Waters有限公司);RBY-4型自动融变时限仪(天津天光仪器有限公司);SJM-10型栓剂模型(长沙常宏制药机械设备厂);AB135-S/FACT电子分析天平(瑞士Mettler-Toledo仪器有限公司);90-1B恒温磁力搅拌器(上海司乐仪器有限公司)。
1.3 橙皮苷栓剂的制备
1.3.1 处方选择及配比:处方选聚乙二醇400、聚乙二醇6000、甘油为基质,以三者的配比进行正交分析考察,根据前期预实验和橙皮苷的理化特点,最终确定1:5:1为最优配比。同时考察基质与药物橙皮苷的比例,当它们配比为4:1时,能兼顾载药量与 栓剂外观。栓剂配方最终如下:栓剂总质量为2 g,其中含0.4 g橙皮苷,0.23 g聚乙二醇400,1.14 g聚乙二醇6000,0.23 g甘油。
1.3.2 制备工艺:采用热熔法制备栓剂[5],按10粒栓剂制备量分别称取聚乙二醇400 2.3 g、聚乙二醇6000 11.5 g、甘油2.3 g至50 mL烧杯,放至搅拌器上80 ℃融化搅拌,混合均匀;称取橙皮苷微粉4 g至上述烧杯中,持续加热搅拌30 min,使药物与基质充分混合均匀;用注射器抽取混匀的含药基质3 mL,快速注入含少量脱模剂(石蜡)的栓模 中,待其冷却凝固,削去溢出部分,脱模即得。
1.4 栓剂的质量评价
1.4.1 栓剂外观检查:按照要求,栓剂外观应完整光滑,颜色均匀一致,无软化、变形或干裂,药物和基质完全混合。
1.4.2 重量差异检查:根据《中华人民共和国药典》[6]规定:取10粒栓剂,精密称定总质量,得平均粒重。然后精密称定各粒质量,该质量与平均粒重相比,超出质量差异限度的粒数不应多于1粒,质量的超出不应超过限度1倍。
1.4.3 融变时限:取3粒栓剂,按《中华人民共和国药典》[6]融变时限检查装置,基质为水溶性的栓剂应在60 min内完全溶解。如有1粒不合格应再复测3粒,直至达到规定要求。
1.4.4 药物含量的测定
1.4.4.1 色谱条件:X-Bridge C18色谱柱(4.6× 150 mm,5 μm),流动相A(1.3%醋酸水溶液,pH= 2.76):B(甲醇)=66:34;检测波长275 nm;柱温 40 ℃;流速1.0 mL·min-1;进样量为20 μL。
1.4.4.2 标准曲线的制备:精密称取橙皮苷标准品10 mg,放于10 mL容量瓶中,加入二甲基亚砜定容,得1 mg·mL-1标准品储备液。精密称取10 mg秋水仙碱,置100 mL容量瓶中,用纯化水定容,得100 μg·mL-1内标溶液。移取1 mg·mL-1的标准品储备液适量,用0.1 mol·L-1的NaOH溶液依次配成浓度为10、50、100、250、500 μg·mL-1的工作液。在各浓度工作液100 μL中加入10 μL内标溶液,分别20 μL进样高效液相(high performance liquid chromatography,HPLC)测定,以橙皮苷浓度C为横坐标,橙皮苷峰面积与内标峰面积比值R为纵坐标做线性回归。
1.4.4.3 准确度试验:按“1.4.4.2”项下工作液配制方法平行配制低、中、高3种浓度(40、250、400 μg·mL-1)的橙皮苷标准品溶液各3份,依上述色谱条件HPLC进样,分别测定各浓度溶液和内标的峰面积,用标准曲线法计算橙皮苷浓度,该浓度与理论浓度的比值即为准确度。
1.4.4.4 精密度试验:按“1.4.4.2”项下工作液配制方法平行配制低、中、高3种浓度(40、250、400 μg·mL-1)的橙皮苷标准品溶液各6份,分别于室温条件下放置0、3、6 h后测定,4 ℃条件下保存 0、3、7 d后测定,依上述色谱条件HPLC进样,计算橙皮苷的浓度,得精密度的相对标准偏差(relative standard deviation,RSD)。
1.4.4.5 回收率试验:取成品栓剂一枚碾碎后溶于500 mL 0.1 mol·L-1NaOH溶液,充分振摇使其溶解,溶液经0.46 μm微孔滤膜滤过,取滤液1 mL至10 mL容量瓶稀释定容,移取100 μL按“1.4.4.2”项下方法操作,进样HPLC测得样品浓度C1。将橙皮苷标准品加入到样品溶液中,分别配成含橙皮苷标准品浓度为40、250、400 μg·mL-1的低、中、高加样溶液,各浓度平行配制3份,按“1.4.4.2”项下方法处理后HPLC进样测定,得样品浓度C2,(C2-C1)的实际测定值与加入橙皮苷标准品理论浓度的比值即为橙皮苷栓的加样回收率。
1.4.4.6 含量均匀度分析:取三批橙皮苷栓剂样 品,按“1.4.4.5”项下方法处理后得样品溶液, 20 μL进样HPLC测定橙皮苷浓度,每批次样品平行操作5次,并对其含量均匀度进行分析。
1.5 统计学处理方法 采用统计软件SPSS19.0进行统计分析。所有数据以±s表示。
2 结果
2.1 外观色泽 橙皮苷栓表面光滑完整,呈子弹型,栓体棕色,25 ℃室温条件下成型良好,硬度适宜,无软化、变形、开裂等现象。
2.2 重量差异 取10粒成品栓剂称定,平均粒重为(2.01±0.05)g,RSD为2.74%,符合重量差异低于7.5%栓剂质量标准要求。
2.3 融变时限 本次制得橙皮苷栓剂的融变时间为(17.98±1.17)min,符合关于水溶性基质栓剂的融变时限限度少于60 min的规定。
2.4 含量测定结果
2.4.1 方法专属性:在本色谱条件下橙皮苷出峰时间为7.0 min,内标出峰时间为13.3 min,两个物质完全分离,且无杂质峰干扰,方法专属性强(见图1)。
2.4.2 标准曲线建立:以橙皮苷浓度C为横坐标,橙皮苷峰面积与内标峰面积比值R为纵坐标,所得标准曲线为:R=0.145C+0.390,r2=0.9999。表明在10~500 μg·mL-1浓度范围内,橙皮苷标准曲线线性关系良好。
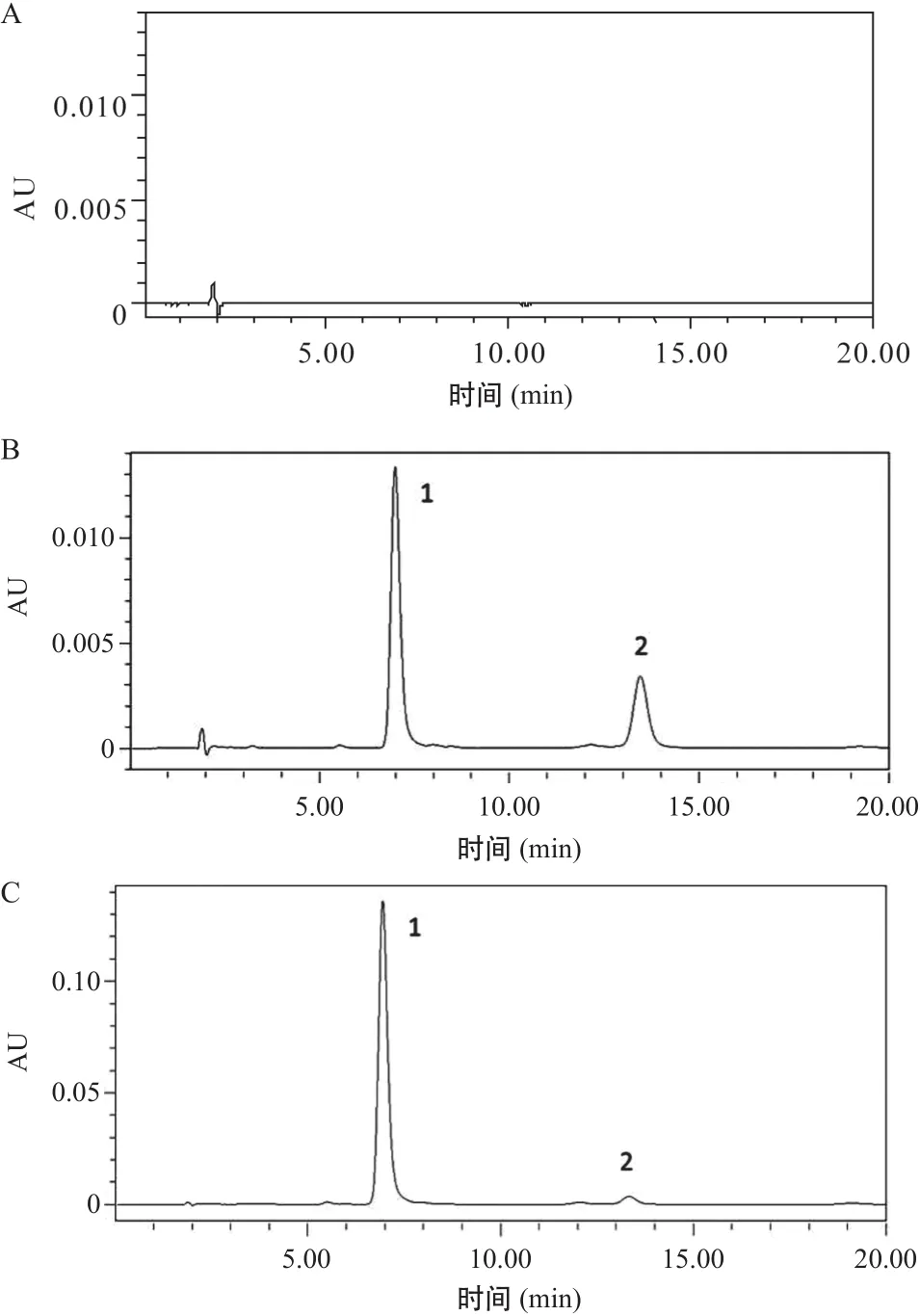
图1 橙皮苷栓检测的HPLC色谱图
2.4.3 准确度、精密度、加样回收率:橙皮苷标准 品溶液低、中、高3种浓度(40、250、400 μg·mL-1) 的准确度范围为99.16%~100.74%,室温放置3 h与4 ℃保存7 d精密度RSD均小于5%,见表1。橙皮苷低、中、高3种浓度(120、330、480 μg·mL-1)的加样回收率均在95%以上,见表2。表明该实验建立的方法学符合橙皮苷浓度的检测要求。
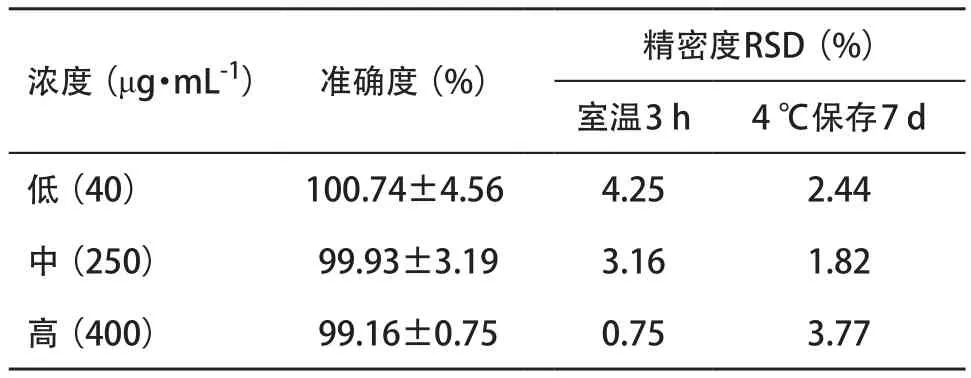
表1 橙皮苷标准品的准确度、精密度

表2 橙皮苷的加样回收率
2.4.4 含量均匀度:本实验制备的橙皮苷栓剂经HPLC测定,如表3所示,三批次样品实际含量RSD均低于5%,在标示量400 mg的92.2%~103.4%范围内,符合含量均匀度要求。
3 讨论
橙皮苷片剂难溶于水,口服后易受胃酸作用发生水解和酶解,生物利用度低[7],日服用剂量较大。将橙皮苷制成栓剂,塞入腔道后由于体温作用迅速软化并融化于分泌液中,能够在局部维持较高浓度,起到治疗作用[8]。与口服给药相比,直肠给药起效迅速,且吸收后浓度维持时间无差别,因此将橙皮苷制成栓剂更符合痔疮的临床治疗目的[9]。
本实验采用聚乙二醇作为水溶性栓剂基质,可以使橙皮苷在体内快速释放并发挥疗效。正交实验结果显示,聚乙二醇400:聚乙二醇6000:甘油= 1:5:1是基质的最优配比,并且确定橙皮苷与基质的比例为1:4,以热熔法结合定量注模成型制备橙皮苷栓,所得栓剂外观良好,其重量差异、含量均匀度以及融变时限检测结果均符合《中华人民共和国药典》的质量要求。将橙皮苷制成直肠栓剂,给药简单、方便、安全,适合作为该药的新剂型开发,尤其适合痔疮高发病率且不能手术的老年患者[10]。

表3 橙皮苷实际测定含量
本课题组建立了橙皮苷栓的制备方法以及质量评价体系,完成了栓剂的体外药剂学实验内容。同时橙皮苷的动物用栓剂也已开始研发,以期通过动物实验对橙皮苷栓的体内药效学进行进一步评价。
