一个纯合子Tyr503Cys突变导致的遗传性凝血因子Ⅺ缺陷症家系分析
2019-01-28周星星李小龙金艳慧杨丽红潘景业苏看看王明山
周星星,李小龙,金艳慧,杨丽红,潘景业,苏看看,王明山
(温州医科大学附属第一医院 医学检验中心,浙江 温州 325015)
凝血因子XI(FXI)是丝氨酸蛋白酶原,由肝细胞和巨核细胞合成。其可被凝血酶激活,当凝血被外源性(组织因子)途径触发时即可启动内源性凝血途径,活化的FXI I(FXI Ia)和活化的FXI(FXIa)也可以通过切割FX I的Arg369-Ile370键来激活FX I。遗传性FX I缺陷症(OMIM 264900)为常染色体隐性遗传病,是一种罕见的出血性疾病,通常很少导致自发性出血。但根据FXI水平降低的不同,会具有不同的出血表现型,出血倾向与FXI血浆水平之间的关系尚不清楚[1]。根据FXI活性(FXI:C)和FXI抗原(FX I:Ag)水平的不同,该病可分为两型,I型为交叉反应物(cross-reacting material,CRM)阴性(FXI:C和FXI:Ag同步减少),I I型为CRM阳性(FXI:C减少,FXI:Ag正常)[2]。本研究对1例纯合F11基因突变导致的遗传性FXI缺陷症家系进行实验室表型与基因检测,并采用生物信息学相关软件对其基因突变的位点进行分析,初步探讨其分子致病机制。
1 对象和方法
1.1 对象 先证者,女,64岁,由于下肢运动障碍收住温州医科大学附属第一医院,而后诊断为“下肢静脉功能不全”,无其他临床症状,个人及家族成员 均没有出血倾向,肝、肾功能正常。常规凝血试验显 示活化部分凝血酶时间(activated partial thrombin time,APTT)延长为59.3 s(29.0~41.0 s)。 进一步检查发现FIX:C降至13%(82%~118%),FX I:Ag 正常,为76%(75%~125%)。其他测试指标如凝血酶原时间(pro-thrombin time,PT)、FVIII:C、FIX:C和FXII:C均在正常参考范围,初步诊断为FXI缺陷症。通常三代以内的联姻被定义为近亲婚姻。通过家系调查发现,先证者父母之间存在血缘关系,其母亲的祖母和父亲的祖父是兄妹关系,家系遗传图谱见图1。选择100名年龄22~56岁,无肝、肾功能异常,且无其他基础性疾病的健康体检者,其中男53名,女47名。本研究通过本院伦理委员会审查,征求本人同意,对上述人员采集血样。

图1 遗传性FXI缺陷症先证者家系图
1.2 方法
1.2.1 样本采集及处理:采集受检者外周静脉血 2.7 mL,以0.109 mol/L枸橼酸钠1:9抗凝,3 000 r/min 离心10 min,上层乏血小板血浆用于凝血指标检测,并于2 h内完成,下层血细胞用于提取基因组DNA,并进行PCR扩增及测序。
1.2.2 血浆凝血指标检测:PT、APTT、FVIII:C、FIX:C、FXI:C和FXII:C等凝血指标采用一期凝固法在法国Stago STA-R全自动血凝仪上测定(配套试剂由法国Stago公司提供);FX I:Ag采用ELISA法测定。所有操作步骤均严格按照试剂说明书进行。
1.2.3 PCR扩增及电泳:采用酚-氯仿法抽提受检者的外周血基因组DNA,参照文献[3]设计合成PCR引物(由上海桑尼生物科技有限公司合成)。所有PCR扩增均在25 μL反应体系中进行,包括12.5 μL PCR扩增反应物(2×)(北京天根生化科技有限公司),8 μL ddH2O,1 μL上游引物,1 μL下游引物 (10 mmol/L),2 μL基因组DNA模板(100 ng)。将DNA样品95 ℃预变性5 min,95 ℃变性30 s,退火30 s,72 ℃延伸30 s,共进行30个循环,最后在Applied Biosystem热循环仪2720(美国ABI公司)上以(72±8)℃延伸10 min。将5 mL PCR扩增产物置于含Tris硼酸盐缓冲液(pH 8.3)的1.5%琼脂糖凝胶上,用GoldView I I核酸着色剂(上海蓝季科技发展有限公司)染色,通过电泳检测扩增效果。纯化后,PCR产物送上海桑尼生物工程有限公司直接测序。
1.2.4 DNA测序分析:将测序结果与GenBank数据库中F11基因序列(NG_008051.1)比对,发现突变位点后,反向测序予以证实。先扩增先证者F11基因各外显子、侧翼序列以及5’端、3’端非翻译区,发现突变位点后再扩增其他家系成员相应外显子片段。同时筛选来自相同区域共计100名(200个等位基因)健康个体来排除基因多态性。
1.2.5 氨基酸突变位点保守性与危害性分析:采用ClustalX-2.1-win软件将突变氨基酸与其他同源物种的氨基酸序列进行比对,分析突变氨基酸在物种进化过程中的保守性。用3种在线生物信息学软件来预测突变是否影响蛋白质功能:Phenotyping-2 (http://genetics.bwh.harvard.edu/pph2/index.shtml)、PROVEAN(http://provean.jcvi.org/seq_submit.php)以及MutationTaster(http:// www.mutationtaster.org)。FXI的蛋白质参考ID:P03951,蛋白质参考转录本ID:ENST00000403665。1.2.6 突变蛋白空间结构模型分析:以蛋白质数据库(PDB,http://www.rcsb.org/pdb/home/home.do,PDB ID:1xx9)中的三维结构为基础,通过spdbv 软件和蛋白质相互作用计算器程序(http://pic.mbu.iisc.ernet.in)生成蛋白质模型。分析F11基因突变前后由氨基酸变化引起的蛋白质空间结构的改变。
2 结果
2.1 凝血指标检测结果 先证者APTT为59.3 s,明显延长,FXI:C降低至13%;其母亲、女儿和儿子的APTT均有不同程度延长,FXI:C降至37%~42%。该家系5人FXI:Ag、PT均正常,见表1。FVIII:C、FIX:C和FXI I:C也均在参考范围。
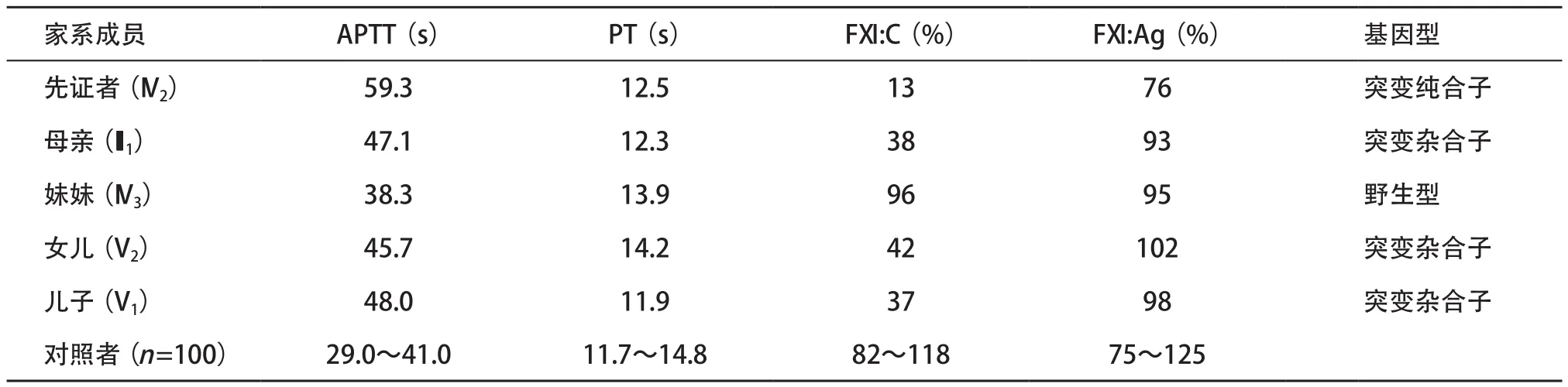
表1 遗传性FXI缺陷症家系成员表型及基因型检测结果
2.2 基因突变检测结果 DNA测序分析显示,先证者F11基因第13号外显子中存在c.1562A>G纯合错义突变,导致Tyr503Cys突变;其母亲、儿子和女儿均存在Tyr503Cys突变杂合子;妹妹是野生型。对100名健康对照者F11基因第13号外显子进行测序,均未发现c.1562A>G,排除基因多态性,见表1和图2。
2.3 氨基酸突变位点保守性与危害性结果 通过同源序列比对,Tyr503在同源物种间高度保守。PolyPhen-2评分结果为1.000分,PROVEAN评分结果为-3.352分,均预示此突变很可能是有害突变;Mutation Taster评分结果为0.998分,预示此突变可引起相关疾病。
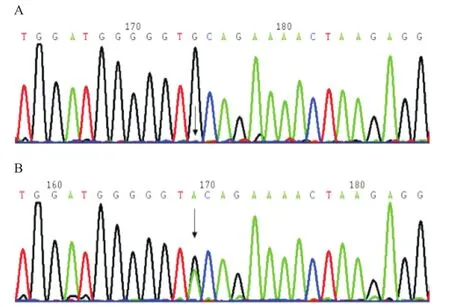
图2 Tyr503Cys突变测序图
2.4 突变蛋白空间结构模型分析结果 模型分析表明,野生型Tyr503与Ile370、Lys554形成2个氢 键;当突变为Cys503后其苯环消失,同时与Lys554之间新增了1个氢键,导致蛋白质结构改变,见图3。

图3 Tyr503Cys突变模型
3 讨论
本家系研究表明,先证者携带Tyr503Cys纯合错义突变,其FXI:C降低至13%,但FXI:Ag水平正常。其母亲、儿子和女儿携带Tyr503Cys杂合子,FXI:C均降低至40%左右,FXI:Ag水平正常。其妹妹为野生型Tyr503,FXI:C和FXI:Ag均正常。通过添加正常血浆混合物可以纠正FXI:C降低,由此可以确定血液中不含有针对FXI的循环抗凝剂。另外,我们没有发现其他凝血指标异常。因此,可以初步认为该突变是导致FXI:C降低的原因。根据家系图,发现儿子和女儿携带的Tyr503Cys杂合突变等位基因均来自于先证者。先证者的父母存在血缘关系,母亲是杂合子,尽管先证者父亲已故,但可以高度假设先证者的纯合等位基因分别遗传自其父亲和母亲。其遗传规律符合遗传性FXI缺陷症常见的常染色体隐性遗传特征。由此可知该突变导致了遗传性FXI缺陷症,同时为交叉反应物质阳性(CRM阳性,I I型)。
保守性分析结果显示,Tyr503在同源物种间高度保守,表明它是FXI中维持蛋白质正常功能的重要组成部分。Tyr503位于F11基因的催化结构域(催化三联体:H413-A462-S557),因此Tyr503Cys突变可能会导致FXI功能严重缺陷。有报道[4-5]指出,Tyr503残基发生移码突变(Tyr503ValfsX32)会造成FXI多肽催化结构域的破坏。3个生物信息学软件分析结果均表明Tyr503Cys是一种有害的突变,可能影响FXI蛋白质的结构和功能,从而导致疾病的发生。
FXI蛋白由625个氨基酸组成,包含36个半胱氨酸,其中除了p.Cys11,p.Cys321外,其余半胱氨酸之间形成的二硫键均与蛋白质结构直接相关,这足以说明半胱氨酸残基对FXI蛋白的重要性。MITCHELL 等[6]曾报道新产生的半胱氨酸可破坏蛋白质结构,导致其功能受损。在本研究中,催化结构域中原来的Tyr503被Cys替代,这可能会导致二硫键错配,从而影响蛋白质的功能。同时,根据表型推测,突变不会影响蛋白质的合成和分泌。此外,模型分析显示突变导致氨基酸之间的氢键改变,使得Cys503和Lys554之间产生额外1个氢键。同时突变为Cys503 后其苯环消失,导致蛋白质结构改变,引起FXI蛋白功能失调。
到目前为止,人类基因数据库共收录了225种F11基因突变类型。I I型突变类型较少,其中4例有特殊的致病机制,Ser248Asn是一种多态性,导致血小 板亲和力降低[7];Pro520Leu一定程度上破坏了催化活性[8];Gly555Glu大幅降低了FIX激活的速度[9]; Val371Ile影响FXI和FIX的激活[10]。而本研究中,Tyr503Cys突变替换产生了半胱氨酸残基,导致形成额外的氢键和二硫键,影响FXI蛋白的结构和功能。该突变丰富了数据库,并有助于未来对F11基因突变的研究,特别是I I型。
综上所述,本研究报道了1例中国有血缘关系的家系中发现F11基因纯合错义突变(Tyr503Cys),并对其分子发病机制进行了初步探讨,显示该突变可能是导致FXI:C下降的原因。但其确切的分子致病机制有待进一步研究。
