儿茶酚雌激素介导慢性间歇低氧诱导OSAHS雌性大鼠遗尿模型的建立
2019-01-28徐莉苏苗赏蔡晓红李昌崇
徐莉,苏苗赏,蔡晓红,李昌崇
(温州医科大学附属第二医院育英儿童医院 儿童呼吸科,浙江 温州 325027)
夜间遗尿症(nocturnal enuresis,NE)是指5岁以上儿童夜间不自主排尿[1]。一般认为5~6岁患儿出现尿床>2次/月,6岁以上患儿出现尿床>1次/月可诊断为NE[2-3]。目前NE的病因尚不明确,研究报道显示NE与阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)相关。NE的患病率为4%~10%,OSAHS患儿伴发遗尿的概率高达10%~40%[4-5],提示慢性间歇低氧(chronic intermittent hypoxia,CIH)可能是患儿出现遗尿的重要原因之一。CIH诱发OSAHS可产生氧化应激反应,促使雌激素羟化代谢,即促进儿茶酚雌激素(catechol estrogen,CE)大量生成[6],并通过抑制儿茶酚氧位甲基转移酶(catecholamine-O-methyl transferase,COMT)的活性,使CE不能代谢为水溶性化合物,导致膀胱不稳定,从而出现遗尿。OSAHS引起交感神经兴奋,导致儿茶酚胺类化合物如肾上腺素(adrenaline,Adr)、去甲肾上腺素(norepinephrine,NA)和多巴胺(dopamine,DA)大量堆积,最终导致NE。目前国内外有关遗尿的动物模型少见报道,SD大鼠是夜行动物,昼伏夜出,具有与人类相似的睡眠结构,是研究睡眠的理想动物模型[7]。本研究通过CIH诱导建立OSAHS遗尿的雌鼠模型,初步探讨CE在CIH诱导OSAHS遗尿中的作用。
1 材料和方法
1.1 材料 6周龄SPF级SD大鼠16只,雌性,体质量(150±14)g,由浙江省实验动物中心提供,饲养于温州医科大学实验动物中心,常规饲料和自来水无限制按时供应,动物许可证号:SCXK(浙)2014-
0001。主要仪器及试剂:复合式大鼠试验模拟舱,RM6240多道生理信号采集处理系统(成都仪器厂),NA、CE、COMT、Adr和DA酶联免疫吸附试验(ELISA)试剂盒(上海酶联公司),苏木素-伊红染液、改良Weigert弹力纤维染色液(美国Solarbio公司),乌拉坦(美国Sigma公司)。
1.2 方法
1.2.1 动物分组及CIH实验:将16只SD雌鼠随机分成CIH组及对照组,各8只,2组大鼠体质量比较差异无统计学意义(P>0.05)。将CIH组置于常压间歇低氧舱,氧舱条件设置方法如下:以0.3 kPa压力通氮气30 s,停30 s,25 L/min流量通氧气12 s,停18 s为1个循环。舱内低氧时氧浓度为9.0%±1.5%,复氧时氧浓度为21.0%±0.5%,舱内CO2浓度<0.01%。基于大鼠夜间活动白天睡眠的生活特性,每天进氧舱时间安排在9:00~17:00,每天8 h,模拟人体睡眠过程中CIH,其余时间移至动物房,常规饲料和自来水喂养,每周7 d,连续放置4周构造CIH组。通气阶段由连接的测氧仪分别测间歇低氧舱内的氧浓度高值、低值和CO2浓度。对照组则置于同等条件下的空气模拟对照舱,通压缩空气,氧浓度保持在21.0%±0.5%,同一单片机程序控制。
1.2.2 膀胱造瘘术及排尿阈检测:缺氧4周后,腹腔注射乌拉坦(0.9 g/kg,1 mL/100 g)麻醉成功后,将大鼠仰卧位固定在鼠板上。腹部正中切口暴露膀胱,于膀胱顶切开一小口,插入连续硬膜外麻醉导管,丝线荷包缝合固定且不发生漏尿。接三通管一端与RM6240多道生理信号采集处理系统第一通道相连,另一端与注射器相连,注入0.9%氯化钠溶液,当尿道口刚出现尿液时,使用配套数据采集系统检测并记录排尿阈。
1.2.3 取材、病理学检查:缺氧4周后,2组大鼠在检测完成后即刻取出膀胱,称重后用4%多聚甲醛固定。膀胱组织石蜡切片(片厚5 μm),按试剂盒说明分别行HE和Weigert染色,光镜下观察病理组织学改变。
1.2.4 儿茶酚胺类化合物水平及COMT活性测定:从 心脏取血3~4 mL放在试管内,4 ℃,3 000 r/min 离心10 min,分离血清,用ELISA法检测血清中CE、NA、Adr和DA含量及COMT活性。具体操作步骤参照试剂盒说明书。
1.3 统计学处理方法 采用SPSS 20.0软件进行统计学分析。计量资料用±s表示,2组间比较用两独 立样本t检验,造模前后比较采用配对t检验。P< 0.05为差异有统计学意义。
2 结果
2.1 2组大鼠一般情况 在造模期间,对照组大鼠活动、饮食均正常,皮毛有光泽;CIH组大鼠活动明显减少,出现嗜睡、反应迟钝、多尿、毛发干枯等症状。
2.2 2组大鼠的排尿量 由于氧舱内维持在低氧浓度,CIH组均处于睡眠状态,出氧舱时发现CIH组有排尿,而对照组无排尿。造模期间2组大鼠24 h进食量及进水量比较,差异无统计学意义(P>0.05);造模前2组大鼠24 h尿量比较,差异无统计学意义(P>0.05);造模后与造模前24 h尿量比较,对照组大鼠的排尿量差异无统计学意义(P>0.05),CIH组大鼠排尿量增多,且较对照组增多,差异有统计学意义(P<0.05)。将2组雌鼠进出氧舱期间的排尿量进行统计学分析,发现CIH组大鼠氧舱内排尿量与对照组比较,差异有统计学意义(P<0.05),而2组出氧舱后的排尿量差异无统计学意义(P>0.05),见表1。
2.3 儿茶酚胺类化合物含量及COMT活性 研究发现CIH组雌鼠血清中CE、NA、Adr和DA含量较对照组明显增高,而其代谢酶COMT活性明显降低,差异有统计学意义(P<0.05),见表1。
表1 2组雌鼠的生物学指标、血清儿茶酚胺类化合物水平及代 谢酶活性比较(n=8,±s)

表1 2组雌鼠的生物学指标、血清儿茶酚胺类化合物水平及代 谢酶活性比较(n=8,±s)
与对照组比:aP<0.05,bP<0.01;与CIH组造模前24 h尿量比:cP<0.05
指标 对照组 CIH组体质量(g) 150.21± 5.30 150.50± 3.20 24 h进食量(g) 5.13± 1.25 4.80± 0.47 24 h进水量(g) 38.92± 6.13 40.60± 4.35造模前24 h尿量(g) 12.80± 1.12 13.00± 1.06造模后24 h尿量(g) 10.52± 2.03 28.40± 8.08ac尿量(g) 氧舱内 0 13.20± 3.08a 氧舱外 9.24± 1.78 12.80± 4.31膀胱质量(mg) 78.63± 9.45 82.50± 7.56血清CE(pg/mL) 342.74± 20.73 391.10± 22.39b血清Adr(ng/mL) 10.06± 1.08 11.30± 0.50b血清NA(ng/mL) 3.65± 0.35 4.20± 0.28a血清DA(pg/mL) 783.21±169.82 1 199.60±144.22b COMT(U/mg prot) 194.10± 19.05 171.20± 10.33b
2.4 排尿阈 排尿阈是指开始排尿(即尿道口刚出现尿液)时,膀胱内的压力值。缺氧4周后,CIH组大鼠排尿阈为(33.80±15.05)mmHg(1 mmHg= 0.133 kPa),对照组大鼠为(125.47±79.31)mmHg,差异有统计学意义(P<0.05),见图1。
2.5 膀胱组织HE及Weigert染色 缺氧4周后,HE及Weigert染色后光镜观察2组的病理变化如图2所示。对照组大鼠HE染色切片可见膀胱逼尿肌肌束排列整齐、有序,间隙中充满结缔组织,连接紧密;而CIH组大鼠的膀胱逼尿肌肌束排列紊乱、疏松,部分肌束发生断裂。对照组大鼠Weigert染色切片可见膀胱逼尿肌肌束排列整齐,间隙中含有胶原纤维(红色深染部分);而CIH组大鼠的膀胱逼尿肌肌束排列紊乱,间隙中的胶原纤维含量减少,间隙明显增宽。

图1 缺氧4周后2组雌鼠的排尿阈曲线图
3 讨论
NE的病因比较复杂,据文献报道[1-3],NE与遗传因素、膀胱容量小、排尿中枢发育迟缓、睡眠觉醒障碍及OSAHS等有关。由于其发病机制尚不明确,临床上常用药醋酸去氨加压素(弥凝)对OSAHS诱发遗尿的疗效并不理想,且长期使用还有低血钠等不良反应。为了寻求疗效好而不良反应小的药物,使更多的遗尿患者获益,本研究通过模拟OSAHS的CIH病理生理过程,建立CIH诱发的遗尿雌鼠模型,以为进一步阐明CIH诱发遗尿的发病机制提供可靠的动物模型。
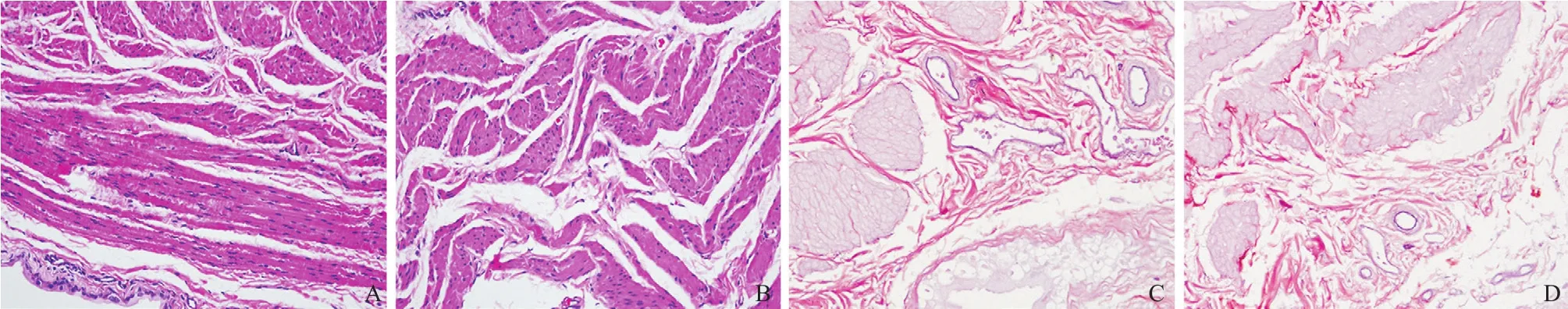
图2 缺氧4周后膀胱组织病理染色图(A、B:HE染色,×200;C、D:Weigert染色,×200)
本研究在前期的流行病学调查中发现,学龄期女性儿童OSAHS与遗尿显著相关,且随着缺氧程度的加重更容易发生遗尿,并且患病率是男性儿童的5倍[4],因此本项目选用幼年SD雌鼠作为实验模型动物。有研究发现[8],雌激素羟化代谢存在性别差异。雌鼠中以2-羟化为主,而雄鼠以2、16-羟化为主。雌激素羟化代谢是在细胞色素P450催化下完 成,产生代谢产物CE。OSAHS可引起交感神经过度兴奋,诱发肾上腺轴等神经内分泌器官大量释放NA、Adr和DA等儿茶酚胺类化合物,最终导致遗尿。CIH诱发氧化应激反应可增强其催化作用,并以C2位羟化为主,促进CE的大量生成,导致DNA损伤和突变,引起多器官损害,使OSAHS患者膀胱不稳定,产生遗尿。在人体中,CE还存在保护代谢,即通过COMT的甲基化,使CE代谢为可溶于水的2-甲氧基雌激素和4-甲氧基雌激素,排出体外。然而,OSAHS产生的氧化应激可抑制COMT的活性,导致CE在体内的大量堆积。本研究结果显示CIH大鼠血清中CE含量较对照组明显增高,而COMT的活性明显降低,提示CIH诱导产生氧化应激反应,使CE大量堆积,从而导致膀胱的不稳定性和遗尿的产生[6]。研究还发现CIH大鼠血清中儿茶酚胺类化合物含量明显增多,提示CIH可通过过度兴奋交感神经,诱发遗尿。
既往的临床研究发现,OSAHS患儿打鼾症状减轻后,其遗尿症状也获得改善。PARK等[9]研究发现,在行腺样体和(或)扁桃体切除术前,有17例(占9.3%)OSAHS患儿伴有遗尿,术后仅4例(占1.5%)OSAHS患儿仍有遗尿。THOTTAM等[10]也发现有51.4% OSAHS患儿的遗尿症状在行腺样体和(或)扁桃体切除术后缓解。可能是由于OSAHS患儿上呼吸道梗阻症状消除后,通气功能和睡眠结构获得改善,从而缓解遗尿症状。这为OSAHS诱发的遗尿提供一种新的防治策略。
CIH是目前公认的OSAHS主要的病理生理特征,并且可导致多系统功能损害。CAI等[11]通过CIH诱导建立OSAHS动物模型,发现其海马功能区受损导致认知功能障碍。GOZAL等[12]通过CIH诱导建立大鼠模型时,发现幼鼠因脑缺氧导致觉醒功能障碍。临床上通过睡眠监测发现,OSAHS患儿睡眠觉醒功能障碍主要表现为反复微觉醒[13]。WOLFISH等[14]通过研究发现,OSAHS患儿伴有遗尿与健康同龄儿童相比,微觉醒次数明显增多。刘英华等[15]研究报道,经间歇性缺氧(4周)诱导后,SD幼鼠可出现遗尿,且通过脑电图监测发现遗尿与觉醒功能不良有关。由于频繁间歇缺氧导致膀胱感受器兴奋增强,诱发遗尿[16]。本研究基于前期的临床研究发 现,采用CIH诱导雌鼠以建立OSAHS遗尿模型,并且结合OSAHS产生的氧化应激反应,导致CE的大量生成,以进一步阐明CIH诱发遗尿的尿动力学及神经内分泌机制。
膀胱不稳定是导致遗尿的另一重要原因。膀胱排尿是一种复杂的正反馈反射过程,排尿过程是逼尿肌和内括约肌协同作用的结果,并且还受意识控制。睡眠时排尿减少是由于内括约肌的作用及尿感神经信号减弱。OSAHS产生的氧化应激可促进CE的大量生成,使尿感神经传入信号增强,引起膀胱逼尿肌和括约肌不稳定性收缩,从而诱发遗尿。本研究发现与对照组相比,CIH组雌鼠血清中儿茶酚胺类化合物含量明显增高,排尿阈明显降低,提示CIH组更易产生排尿现象,推测可能与膀胱不稳定有关。
本研究发现,2组雌鼠24 h进食量及进水量、膀胱大小及质量、造模前24 h尿量及出氧舱后的排尿量均无明显差异,但CIH组雌鼠较对照组在进氧 舱时排尿量明显增多,并且血清中CE也明显增高,说明CIH可诱发雌激素羟化代谢途径,从而促使OSAHS雌鼠遗尿模型的成功建立。虽然2组雌鼠膀胱质量无明显差异,但光镜下发现,CIH组的膀胱逼尿肌已经发生病理形态学改变,提示存在膀胱组织的重塑。研究表明,在光镜下观察大鼠膀胱逼尿肌产生的最常见的病理改变是肌束排列紊乱、间隙增宽及肌束之间的胶原纤维含量减少[17]。目前关于OSAHS遗尿大鼠膀胱逼尿肌发生的一系列形态学改变的原因尚不明确,可能与支配膀胱的神经中枢和(或)周围神经发生病变有关。本研究发现CIH组膀胱逼尿肌肌束排列紊乱,间隙增宽,肌束之间的胶原纤维含量减少。以上膀胱组织结构的病理变化将导致膀胱逼尿肌收缩功能受损,产生遗尿。
美国儿科学会、睡眠障碍联合会及国际儿童控尿学会等指南[18-20]均认为,OSAHS与遗尿关系密切。本研究结果表明,幼年SD雌鼠经CIH诱导后,可因膀胱不稳定及膀胱逼尿肌收缩功能受损产生遗尿,并且提示可能与觉醒功能障碍有关。这与OSAHS患儿出现遗尿时的临床症状相似,因此本研究建立的CIH遗尿雌鼠模型可作为用于探讨其发病机制的较理想的动物模型。
