类受体蛋白激酶NtFERL对烟草质体色素含量的影响
2019-01-25徐国云刘萍萍陈千思郑庆霞金立锋曹培健周会娜
徐国云,翟 妞,刘萍萍,张 慧,陈千思,郑庆霞,金立锋,陈 霞,曹培健,周会娜
中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号 450001
烟草质体色素是烟草重要致香成分的前体物,不仅影响烟叶的外观质量,而且对香味品质的形成也具有重要作用[1]。烟草色素含量的提高可作为栽培技术改进和引种遗传改良的方向之一[2]。烟草质体色素主要包括叶绿素和类胡萝卜素,其总量随烟草品种、类型、发育阶段、加工调制等的不同而变化[3-4]。在生长成熟阶段,随烟草的不断成熟,所有质体色素含量均逐渐下降,但下降速率与叶片、叶位等存在一定的联系[5]。在实际生产中,可以通过施加肥料、喷施激素、调整种植密度等农艺措施来改善烟叶质体色素含量。韩锦峰等[6]提出在烟草生长期间1∶1配施芝麻饼肥和化肥可增加叶绿素含量。烟草叶面喷施多胺能够明显提高类胡萝卜素含量,并对烟叶中其他致香物质含量也有显著影响[7]。赵铭钦等[8]研究发现烟苗移栽时灌溉豆浆发酵物可大幅度提高类胡萝卜素和叶绿素含量。同时,还提出15 500株/hm2的种植密度可提高烤后烟叶中质体色素及其降解产物的含量[9]。另外,利用基因工程手段也能够实现对质体色素含量的调控。将拟南芥PSY基因在种子中特异表达后,能大幅提高种子中类胡萝卜素的含量,其中β-胡萝卜素的含量提高了40倍[10]。在油菜和番茄种子中过量表达与噬夏孢欧文氏菌PSY同源的基因CrtB,也能显著提高转基因种子中类胡萝卜素的含量[11-12]。ε-Ohase编码一个位于ε-LCY下游的CYP97-P450单加氧酶,该基因突变后能引起植物紫黄质和玉米黄质含量的增加[13]。ε-LCY的突变可造成植物体内β-胡萝卜素、紫黄质、玉米黄质等含量的增加[14-15]。
FERONIA(FER)是近年来植物细胞信号领域中的明星蛋白,属于CrRLK1-L受体蛋白激酶亚家族。FER在植物界中高度保守,是植物生长信号的一个重要“接收器”。研究人员最先发现FER在植物受精过程中发挥着重要作用,随后越来越多的研究表明,FER不仅调控植物的营养生长、根毛伸长及种子发育,还调控植物对干旱、温度、金属离子毒害等非生物胁迫以及真菌、细菌、病毒等生物胁迫的应答[16-26]。虽然FER参与了许多生物学过程,但FER及FER-like相关基因调控质体色素的含量鲜有报道。为此,利用生物信息学和VIGS基因沉默技术,分析了烟草类受体蛋白激酶NtFERL基因的序列特征以及沉默NtFERL后烟株的表型与质体色素含量,旨在为深入研究NtFERL的生物学功能奠定基础。
1 材料与方法
1.1 材料、试剂和仪器
1.1.1 材料
供试材料:本氏烟草(Nicotiana benthamiana L.)和栽培烟草 K326(Nicotiana tabacum L.)均种植在人工气候室,温度为26~28℃,相对湿度60%,光周期为16 h光照/8 h黑暗。K326生长至4叶期时,采集叶片迅速放入液氮中,充分研磨后装入盛有TRIzol试剂的1.5 mL离心管中,-80℃保存,用于RNA的提取。在VIGS实验中,对正常条件下生长5~6片叶(约3~4周)的本氏烟草进行叶片注射。在沉默八氢番茄红素脱氢酶基因(PDS)烟株出现漂白表型(2~3周)后进行取材,样品经液氮速冻后于-80℃保存。用于VIGS实验的TRV1空白载体、TRV2空白载体、阳性对照TRV2-PDS载体均由本实验室保存。DH5α大肠杆菌感受态和GV3101农杆菌感受态细胞均购于北京天根生化科技有限公司。
1.1.2 试剂
高保真DNA聚合酶PrimeSTAR GXL DNA Polymerase、DNA凝胶回收试剂盒、质粒DNA小量纯化试剂盒、限制性内切酶均购于大连宝生物工程有限公司;In-Fusion HD Cloning Plus试剂盒购于美国Clontech公司;cDNA合成试剂盒Transcriptor First Strand cDNA Synthesis Kit购自瑞士Roche公司;引物合成和DNA片段测序由上海生工生物工程有限公司完成。
乙腈、异丙醇(色谱纯)购于美国Fisher公司;丙酮(分析纯,≥99.0%)购于天津北方化学试剂有限公司;乙酰丁香酮(Acetosyringone,AS)购于上海生工生物工程有限公司;氯化镁、2-(N-吗啉代)甲磺酸(Methyl ester sulfonate,MES)均购于美国Sigma公司;TRIzol试剂购于美国Invitrogen公司;标准样品(新黄质、紫黄质、叶黄素、叶绿素a、叶绿素b、β-类胡萝卜素)购于美国Chromadex公司。
1.1.3 仪器
Agilent 1100高效液相色谱仪(配备紫外检测器和控温单元,美国Agilent公司);BRASON8510超声波发生器(美国Branson公司);LGJ-12台式冷冻干燥机(北京松源华兴科技发展有限公司);Milli-Q超纯水处理仪(美国Millipore公司);PCR仪、移液器、离心机(德国Eppendorf公司);ME204T/02电子天平(感量0.01 mg,瑞士梅特勒-托利多公司);凝胶电泳仪器及成像系统(美国ProteinSimple公司);Nanodrop 2000分光光度计(美国Thermo Fisher公司)。
1.2 方法
1.2.1 NtFERL基因片段扩增及VIGS载体构建
根据中国烟草基因组数据库中的NtFERL基因序列,利用Primer 5.0软件设计扩增NtFERL基因3'端的特异性引物,并在引物的5'端添加载体接头序列。NtFERL-F:5'-TCGACGACAAGACCCTG CAGTCTGATTTCGGGTTGTCTAA-3',NtFERL-R:5'-TGAGGAGAAGAGCCCTGCAGAGGTTCCAAA GCACATCTCC-3'(下划线为载体接头序列)。PCR反应体系:5×PrimerSTAR GXL Buffer 10 μL,dNTP Mixture(2.5 mmol/L)4 μL,上下游引物(10 μmol/L)各 4 μL,PrimerSTAR GXL DNA Polymerase 2 μL,cDNA 模板(100 ng/μL)1 μL,补充 ddH2O 至 50 μL。PCR反应程序:95℃预变性5 min;94℃ 10 s,55℃ 15 s,72℃ 30 s,35个循环;72℃延伸10 min。PCR产物经琼脂糖凝胶电泳分离后,切取目的条带进行DNA片段回收。
利用限制性内切酶Pst I将TRV2空白载体切成线性片段,然后加入In-Fusion酶和回收的NtFERL基因片段,混合均匀后,55℃反应15 min。反应体系:TRV2空白载体2 μL,基因片段6 μL,5×In-Fusion酶 2 μL。将连接产物转化 DH5α大肠杆菌感受态细胞,37℃培养12~16 h。阳性单克隆送北京六合华大基因科技有限公司测序。将构建成功的载体命名为TRV2-NtFERL。
1.2.2 VIGS载体的烟草转化
利用热激转化法将TRV2-NtFERL、TRV2空白载体、TRV1空白载体及阳性对照TRV2-PDS质粒转化到GV3101农杆菌感受态细胞中。将1 μg质粒加入到农杆菌感受态细胞,轻轻混匀后冰浴30 min,在液氮中放置5 min,然后37℃水浴10 min。加入1 mL LB液体培养基,在28℃摇床上孵育3~4 h(180 r/min)。取 200 μL 菌液均匀涂布在含有卡那霉素和利福平的LB固体培养基上,于28℃培养箱中倒置培养。得到的阳性单克隆保存于-80℃冰箱。
将保存的阳性单克隆在添加卡那霉素(50 mg/L)和利福平(25 mg/L)的LB液体培养基中培养2 d(28 ℃)后,6 000 r/min离心15 min,弃上清并用10 mL缓冲液(10 mmol/L MES,10 mmol/L MgCl2,250 μmol/L AS)重悬菌体,使用 Nanodrop 2000 测量菌液OD600值,使菌液最终OD600≈1.0。将菌液在室温条件下放置3~6 h后,将TRV1菌液分别与TRV2-NtFERL、TRV2、TRV2-PDS菌液等比例混合,用1 mL医用注射器对本氏烟草叶片背部进行注射,每批注射20株,避光生长2 d后,恢复正常生长条件。
当注射TRV2-PDS的烟株出现漂白表型后,采集注射TRV2-NtFERL烟株的新生叶片,用液氮研磨成粉后进行RNA提取及cDNA合成。使用TRIzol试剂进行总RNA的提取,提取步骤参照TRIzol试剂说明书。将保存在-80℃的样品室温解冻后,加入200 μL氯仿,振荡混匀离心后,取上层水相,转入另一离心管中。加500 μL异丙醇,沉淀、离心得到RNA,再经75%酒精洗涤,室温微干后,用适当的RNase free水充分溶解。cDNA合成的具体步骤参照Transcriptor First Strand cDNA Synthesis Kit说明书进行。
1.2.3 实时定量PCR
NtFERL的实时定量PCR引物为qNtFERL-F:5'-CTCACAGACAAATCTGATG-3',qNtFERL-R:5'-CCTTTCAGATATGGATCA-3'。烟草26S rRNA为内参基因,引物26S-F:5'-GAAGAAGGTCCCAA GGGTTC-3',26S-R:5'-TCTCCCTTTAACACCAA CGG-3'。实时定量 PCR 的反应体系:10 μL 2×SYBR I Master,上下游引物各0.5 μL,50 ng cDNA,ddH2O 补至20 μL。反应程序:94℃预变性 30 s;94 ℃变性 5 s,60 ℃退火10 s,72 ℃延伸10 s,45个循环。根据循环阈值(CT值),用 2-ΔΔCT方法[27]计算相对表达量。每个反应进行3次技术重复和3次生物学重复。
1.2.4 表型分析
当阳性对照TRV2-PDS烟株出现漂白表型时,对TRV2-NtFERL烟株进行表型分析,统计TRV2-NtFERL烟株新生叶片的泛黄率。
泛黄率=(新生叶片泛黄棵数/VIGS注射烟草总棵数)×100%
1.2.5 质体色素含量测定
参照标准 YC/T 382—2010[28]测定烟叶中质体色素的含量。称取0.2 g冻干后的烟叶并置于50 mL三角瓶内,加入25 mL萃取剂(90%丙酮)后在冰浴条件下超声萃取20 min;取适量萃取液经过滤器(0.45 μm)过滤,滤液保存于棕色色谱瓶内,用于高效液相色谱(High performance liquid chromatography,HPLC)分析。
分析条件:Waters Nova-Pak-C18色谱柱(3.9×150 mm,4 μm);柱温30 ℃;流速0.5 mL/min;进样量10 μm;流动相A:异丙醇;流动相B:80%(体积分数)乙腈水溶液;平衡时间6 min。梯度洗脱条件见表1。检测波长:叶绿素b检测波长为428 nm,其他质体色素检测波长为448 nm。采用保留时间结合标准样品的吸收光谱进行定性,外标法定量。
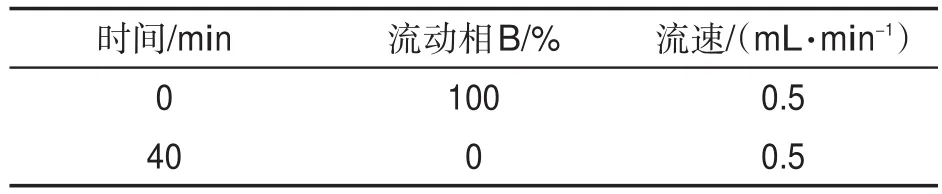
表1 流动相的淋洗梯度Tab.1 Gradient distribution of mobile phase
2 结果与讨论
2.1 NtFERL的生物信息学分析
NtFERL基因位于烟草第7号染色体,无内含子,编码序列长2 670 bp,编码889个氨基酸,预测蛋白分子量为96.67 kD,等电点为6.32。将NtFERL的核苷酸、氨基酸序列在NCBI数据库进行Blast分析,发现该基因与拟南芥FERONIA基因(AtFER)高度同源[23]。NtFERL与AtFER在核苷酸和氨基酸水平上的序列一致性分别为68.8%和71.1%,说明二者在功能方面可能具有较高的保守性。经氨基酸序列比对发现(图1),NtFERL与AtFER在N端Malectin domain区域(位于胞外,与感知外界信号功能有关)的同源性较低[29],推测二者在感知外界信号的方式上可能存在差异;而在C端Protein kinase domain区域(位于胞内,与信号传导有关)的同源性较高[30],说明在感知外界信号后,二者可能以相似的分子机制将信号向下游传递。
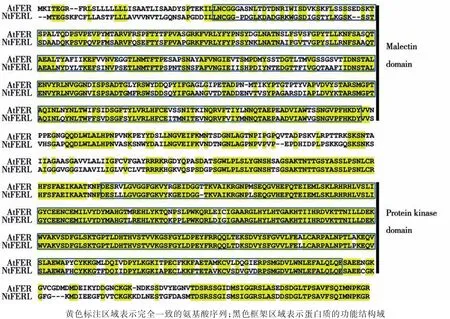
图1 NtFERL与AtFER的氨基酸序列比对Fig.1 Amino acid sequence alignment of NtFERL with AtFER
2.2 烟草NtFERL基因的VIGS载体构建
设计NtFERL基因3'端的特异引物进行PCR扩增。经琼脂糖凝胶电泳检测发现,扩增产物在300~400 bp之间(图2),与目的片段(389 bp)大小相符。将PCR产物连接到TRV2空载体后,测序正确的克隆用于烟草VIGS实验。
2.3 NtFERL沉默效果及表型分析
实时定量PCR结果(图3)表明,与对照(TRV2空载体)相比,在TRV2-NtFERL烟株中,NtFERL的表达量显著下降,仅为对照的24.5%。表型方面,与对照相比,TRV2-NtFERL烟株的叶色变浅、泛黄(图4),推测NtFERL基因可能参与调控烟草质体色素的合成图3、4。
2.4 NtFERL沉默烟株叶片的质体色素含量分析
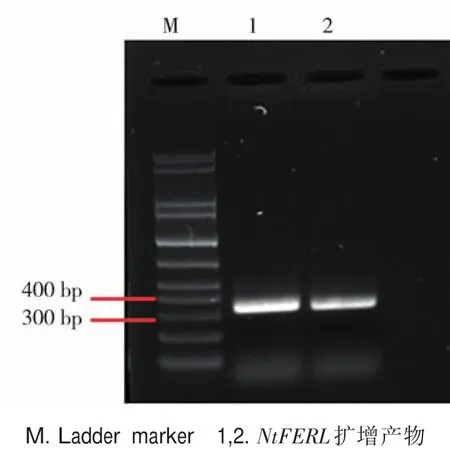
图2 NtFERL基因片段的电泳结果Fig.2 Electrophoretogram of NtFERL fragment
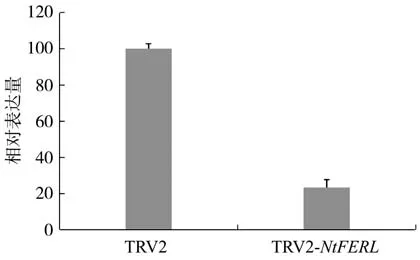
图3 NtFERL沉默后的表达量分析Fig.3 Expression analysis of NtFERL after silencing
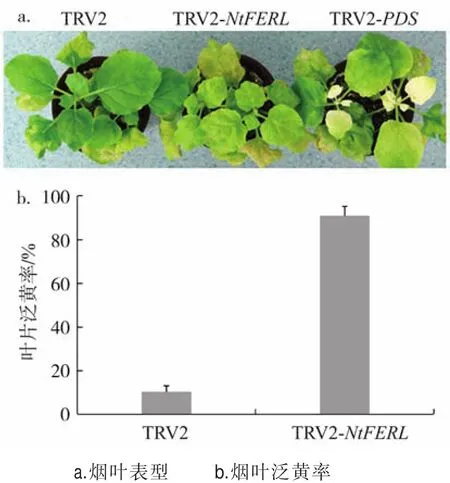
图4 NtFERL沉默后的表型分析Fig.4 Phenotypic analysis of tobacco plants of NtFERL silencing
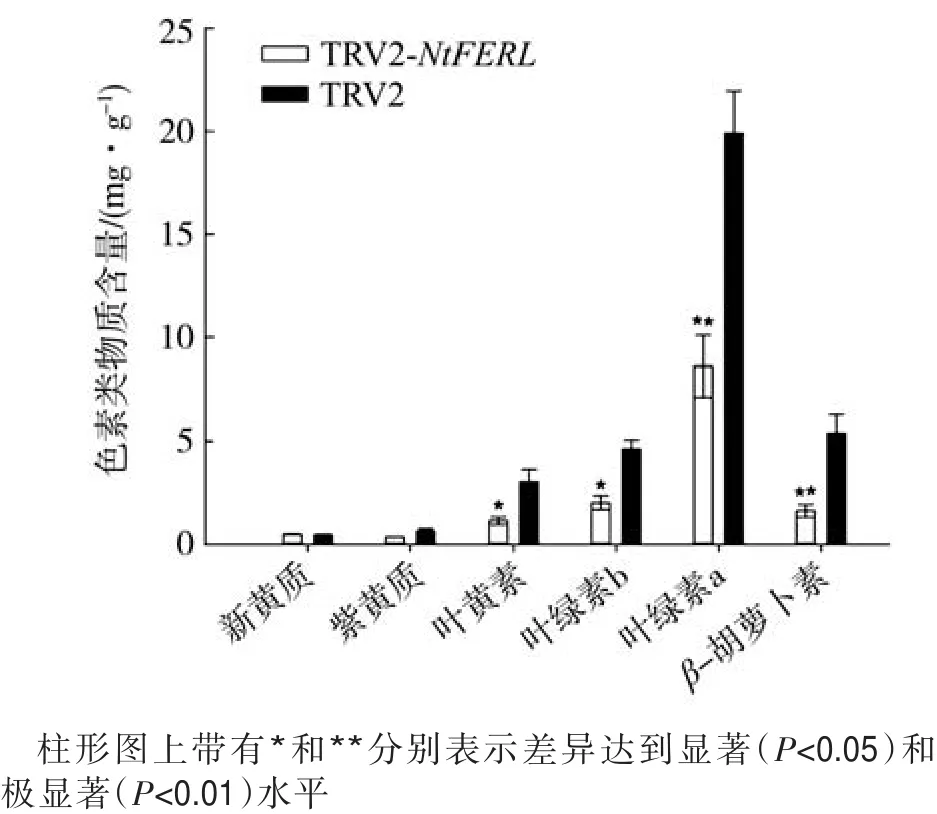
图5 NtFERL沉默烟株的质体色素含量Fig.5 Plastid pigment contents in tobacco plants of NtFERL silencing
由图5可知,与对照(TRV2空载体)烟株相比,在TRV2-NtFERL烟株中,叶绿素a、叶绿素b、叶黄素、β-胡萝卜素的含量显著降低。这表明沉默NtFERL后,叶色泛黄是由质体色素含量降低所引起。与TRV2-NtFERL的表型相似,在拟南芥CRTISO基因突变体中,其叶片中的叶黄素、β-胡萝卜素、紫黄质、叶绿素a和叶绿素b含量均明显下降[31]。现有研究表明,FERL主要通过磷酸化的方式来调控信号传导,并未参与质体色素的合成[16,21-24]。本研究中,首次发现NtFERL基因参与了质体色素的调控,在后续工作中将重点研究NtFERL调控质体色素的分子机制。
3 结论
将AtFER在中国烟草基因组数据库中进行同源比对,获得了NtFERL基因的序列信息。NtFERL与AtFER在核苷酸和氨基酸水平上的一致性分别为68.8%和71.1%。下调NtFERL的表达量后,烟草色素含量(叶绿素a、叶绿素b、β-胡萝卜素和叶黄素)显著降低。
