乳酸菌源共轭亚麻酸的分离制备
2019-01-23朱光贞陈永泉陈海琴
朱光贞,杨 波,杨 芹,唐 鑫,张 灏,陈永泉,陈海琴,陈 卫
(江南大学 食品学院,江苏 无锡 214122)
共轭脂肪酸是指含有共轭双键的多不饱和脂肪酸的位置和几何异构体的总称[1]。共轭亚麻酸(CLNA)是一组在不同位置(碳8,10,12;碳9,11,13;碳10,12,14;碳11,13,15)、不同构型(ttt,ctt,ctc,ccc,tct,ttc等)的十八碳三烯酸的位置和几何异构体[2-3],具有抗癌、抗炎症、抗氧化、抗心血管疾病、减肥[4]等生理功能,并且相较于其他共轭脂肪酸,CLNA的生理作用更明显[5],同时共轭三烯脂肪酸有利于聚合和粘贴,在工业上可以作为有机涂料聚合物[6]。天然CLNA主要来源于植物种子,极少量来源于动物[7-8]。目前,天然CLNA的分离纯化方法主要有尿素包合法[9]、超临界CO2流体萃取法[10]等,将饱和脂肪酸与不饱和脂肪酸进行分离,产物多为结构差异很小的混合物[1,3-4,11],并且收率低,成本高;工业制备CLNA的方法主要包括化学合成法[12]、脱水法[13]、碱异构法[8]等,产物多为混合物[4],制备过程中有机试剂可能有残余,而且能耗大、效率低、污染环境。许多微生物(如瘤胃细菌、丙酸杆菌、乳酸菌等)可产CLNA,其异构体单一,多为碳9,11,15位置的十八碳三烯脂肪酸[14]。其中,瘤胃细菌(如溶纤维丁酸弧菌)是严格厌氧细菌,丙酸杆菌是致病菌,均不能满足工业大规模生产的需要;相比较下,乳酸菌是兼性厌氧细菌,且近几年来作为益生菌得到了大众的普遍认可,是故本实验选择乳酸菌作为CLNA的代谢菌种。
Suzuki等[8]指出,CLNA的功能与其异构体的种类有关,而乳酸菌所产的CLNA与植物来源、化学合成的CLNA结构有所不同,因此乳酸菌发酵液中不同CLNA异构体之间的分离显得尤为重要,又由于CLNA异构体的结构差异很小[3,10],分离制备的方法成为了制约CLNA异构体研究的一大难题。
有文献指出高效液相色谱法(HPLC)可以用来分离制备乳酸菌发酵液酯化形式的脂肪酸异构体[15]和游离形式的羟基脂肪酸[16],但是游离态乳酸菌源CLNA单一异构体的分离制备还未有报道。本文主要通过薄层色谱和高效液相色谱两种方法,对乳酸菌发酵液中游离形式CLNA分离制备的方法进行了研究,并成功得到了结构单一的CLNA异构体,为后续单一异构体的功能研究奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 菌株
植物乳杆菌ZS2058,是本实验室2004年从四川泡菜中筛选到的一株对共轭脂肪酸具有高转化率的乳酸菌,可以将α-亚麻酸(LNA)转化为3种CLNA,并且转化率高达83.66%[17]。
1.1.2 培养基
MRS液体培养基:1.0%蛋白胨、2.0%葡萄糖、0.5%酵母提取物、1%牛肉膏、0.5%乙酸钠、0.2%柠檬酸二铵、0.1%吐温80、0.26%K2HPO4·3H2O、0.01%MgSO4·7H2O、0.005%MnSO4·H2O,pH为6.5。
MRS固体培养基为添加1.5%琼脂的液体培养基。
1.1.3 主要试剂及仪器
α-亚麻酸(NuChek,纯度≥99.9%),三甲基硅烷化重氮甲烷(上海百灵威有限公司),甲醇(HPLC级,上海百灵威有限公司),甲酸(HPLC级,上海阿拉丁试剂有限公司),乙腈(HPLC级,德国默克公司),其他试剂均为分析纯(国药集团化学试剂有限公司);此外,薄层层析硅胶制备板购买于乳山市太阳干燥有限公司。
色谱柱Ultimate®(5XB-C30,4.6 mm×250 mm,上海月旭公司),色谱柱Hypersil(3GOLD-C18,100 mm×2.1 mm,美国赛默飞有限公司)、旋转蒸发仪(德国Heidolph Digital),QGC-36T氮吹仪(上海泉岛公司),GC-MS-QP2010 Ultra 气相色谱-质谱联用仪(日本岛津公司),UV-2450紫外分光光度计(日本岛津公司),HPLC-UV-MS-Q Exactive 高相液相色谱-质谱联用仪(美国赛默飞有限公司),Milli-Q超纯水仪(美国Millipore公司)。
1.2 实验方法
1.2.1 菌株活化及培养
1.2.1.1 菌株活化
从植物乳杆菌ZS2058保菌管中挑取菌液划线于MRS固体培养基上,37℃恒温培养箱中培养48 h,挑取单菌落于MRS液体培养基中,于37℃恒温培养箱中继续静置培养24 h,连续活化3代。
1.2.1.2 菌株培养
将活化好的菌液按1%接种量接种至含0.3 mg/mLα-亚麻酸的MRS液体培养基中,37℃恒温培养箱中培养72 h。
1.2.2 脂肪酸提取
将培养后的菌液按菌液与异丙醇、正己烷体积比为3∶2∶3放入梨形分液漏斗中,振荡10 min,静置15 min后取上层正己烷层。上清液于旋转蒸发仪中旋转蒸干,用无水甲醇复溶,至脂肪酸终质量浓度约为2 mg/mL。
1.2.3 气相色谱-质谱联用(GC-MS)检测
取10 μL样品,添加十七烷酸(C17∶0)作为内标至终质量浓度为0.8 mg/mL,氮气吹干,1 mL正己烷复溶,10 000 r/min离心2 min,取上清液,采用Yang等[18]的方法进行GC-MS检测。
1.2.4 薄层色谱法分离CLNA及纯度检测
根据游离脂肪酸的极性大小,选择的展开剂为氯仿-甲醇-乙酸。层析缸中提前放入1.0 cm左右高的展开剂,在另一个层析缸中提前铺满一层碘颗粒,使其在层析缸中充分平衡。
分别在距离薄层层析硅胶板上下边缘1.5 cm处用铅笔划线,用毛细管轻轻在下线点样。点样结束后,放入水平放置的展开剂层析缸中(注意展开剂不要浸泡样品),待展开剂展开到上线后,取出硅胶板,晾干后放入碘颗粒层析缸中碘熏染20 min显色。
待染色结束,取出硅胶板拍照,并把各部分用刀片刮下,氯仿萃取3次,采用Yang等[18]的方法将其甲酯化后,进行GC-MS检测。
1.2.5 全波长扫描样品中的脂肪酸
9,11,15-CLNA的最佳紫外吸收波长未有报道,故利用紫外分光光度计对植物乳杆菌ZS2058发酵液进行全波长扫描。
1.2.6 高效液相色谱柱的筛选
将HPLC-UV-MS系统串联好后,根据需要,选择合适的色谱柱、流动相及流速在进样量50 μL、柱温为常温条件下进行实验,根据色谱图中的峰图及质谱图中的离子质荷比大小对样品成分进行定性分析。
1.2.7 流动相的优化
采用HPLC-UV分离制备游离CLNA,在高效液相系统中安装好色谱柱,设置流动相及流速,紫外波长设置为全波长扫描中吸收值最大的波长,在进样量50 μL、柱温为常温条件下对样品中的CLNA进行分离条件优化。
1.2.8 制备产物的纯度检测
将制备得到的CLNA单一异构体于旋转蒸发仪中旋转蒸干,用无水甲醇复溶,取10 μL样品甲酯化[18]后,采用1.2.3中的方法进行GC-MS检测。
2 结果与讨论
2.1 薄层色谱法分离植物乳杆菌ZS2058发酵液中的CLNA
在薄层色谱分析条件为展开剂氯仿-甲醇-乙酸(体积比40∶10∶0.01),上样量0.15 mg时,薄层色谱法可将样品分为3部分(见图1A),分别取下3部分脂质样品,从远离点样点处依次为第一、二、三部分脂质样品,经萃取、甲酯化后进行GC-MS纯度检测,结果如图1B、C、D所示。



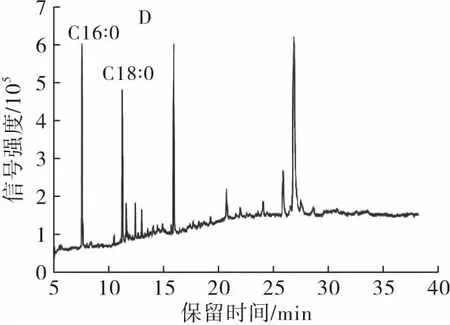
注:A.植物乳杆菌ZS2058发酵液中CLNA分离的薄层色谱图;B.第一部分脂质样品的气相色谱图;C.第二部分脂质样品的气相色谱图;D.第三部分脂质样品的气相色谱图。
图1植物乳杆菌ZS2058发酵液中CLNA分离的薄层色谱图及3部分脂质样品的纯度检测
由图1可知,在薄层色谱法分离CLNA的最佳分离条件下得到3部分脂质样品,没有得到CLNA的单一异构体,其中掺杂着含量很高的C16∶0和C18∶0,与未进行分离的原发酵液成分相似。文献报道薄层色谱法经常应用于游离态脂肪酸和酯化形式脂肪酸的分离,但对于每种游离脂肪酸的分离几乎没有涉及,实验结果表明薄层色谱法无法对乳酸菌源CLNA单一异构体进行分离,且样品损失率很高,故在现有条件下薄层色谱法无法满足本实验的需求。
2.2 植物乳杆菌ZS2058发酵液的全波长扫描
有文献[17]报道,HPLC-UV分离制备植物乳杆菌来源羟基脂肪酸时,紫外波长为205 nm和233 nm,HPLC-UV分离制备植物来源的酯化形式的9,11,13-CLNA时,紫外吸收波长是235 nm[8],但是9,11,15-CLNA的紫外吸收波长未有报道,为了确定最佳的紫外吸收波长,对植物乳杆菌ZS2058发酵液进行了全波长扫描,结果如图2所示。
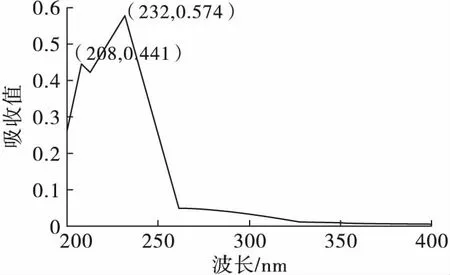
图2 植物乳杆菌ZS2058发酵液的全波长扫描图
由图2可知,植物乳杆菌ZS2058发酵液紫外吸收最大的波长为208 nm和232 nm,结合文献报道,故高效液相色谱条件中紫外检测器波长设置为205、233 nm。
2.3 高效液相色谱柱的筛选
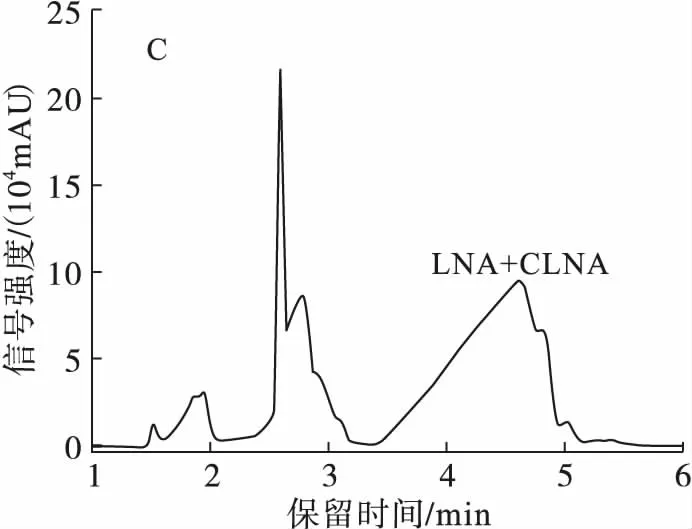
根据文献报道,C18高效液相色谱柱在脂肪酸制备中应用广泛,而C30高效液相色谱柱更适合分离同分异构体。由于植物乳杆菌ZS2058发酵产生的3种CLNA异构体结构相似,差异甚小,故将C18高效液相色谱柱Hypersil(3GOLD-C18,100 mm×2.1 mm)和C30高效液相色谱柱Ultimate®(5XB-C30,4.6 mm×250 mm)进行比较,通过质谱图中离子的质荷比大小,对物质进行定性分析。参考Kichino等[16]分离羟基脂肪酸的条件,设置流动相为乙腈-H2O(体积比80∶20),流速0.25 mL/min(C18柱),1 mL/min(C30柱),并进行条件优化,结果如图3所示。
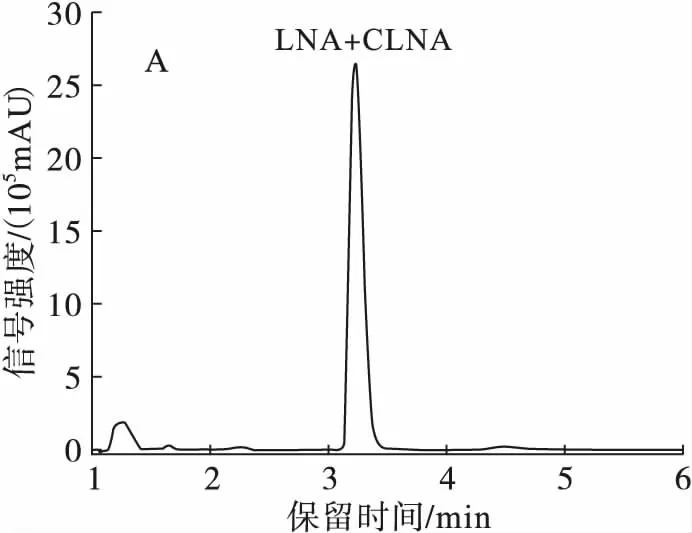
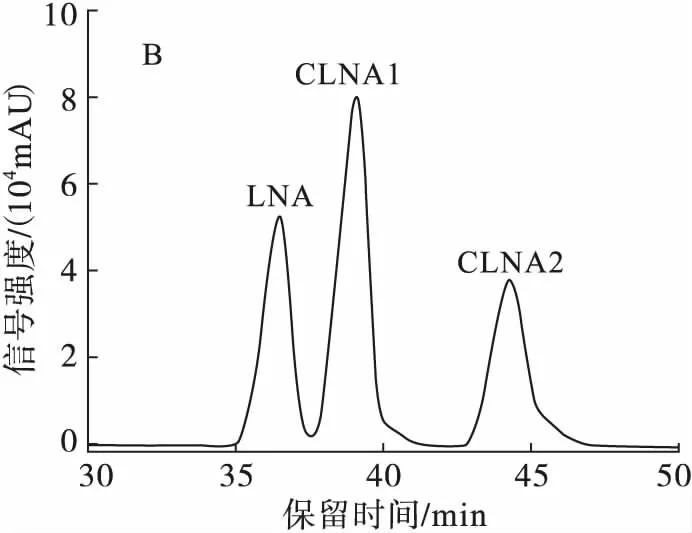

注:A.C18色谱柱条件优化前,流动相为乙腈-H2O(体积比80∶20);B.C18色谱柱条件优化后,流动相为乙腈-H2O(体积比50∶50);C.C30色谱柱条件优化前,流动相为乙腈-H2O(体积比80∶20);D.C30色谱柱条件优化后,流动相为乙腈-H2O(体积比50∶50)。
图3高效液相色谱柱的筛选
由于LNA只在205 nm波长下有吸收,而CLNA在205 nm和233 nm波长下均有吸收,故比较分离条件时仅比较了205 nm波长下的结果。
由图3可知,随着流动相中有机相的比例减少,液相色谱洗脱能力减弱,保留时间变长,但CLNA异构体逐渐分离开来。当流动相为乙腈-H2O(体积比50∶50)时,C18高效液相色谱柱分离到CLNA1、CLNA2两种CLNA异构体,并且基本达到基线分离;C30高效液相色谱柱比C18高效液相色谱柱的保留时间长,但可以分离到CLNA1、CLNA2、CLNA3 3种CLNA异构体,故选择C30高效液相色谱柱进行后续实验。
2.4 流动相的优化
经过前期分离条件的优化和对比,C30高效液相色谱柱可以分离得到3种CLNA异构体,但目前样品中CLNA异构体的分离色谱峰峰形欠佳,拖尾严重,分离度小,保留时间不稳定,仍需进一步优化。高效液相色谱分离方法中经常添加0.1%甲酸或醋酸铵来调节流动相的酸碱度,进而提高峰形质量。由于甲酸易挥发,不会与CLNA发生反应,分离过程中对样品的影响较小,故选择甲酸调节酸碱度,以改善峰形。
由于本实验流动相消耗量较大,考虑到乙腈成本高,并且毒性比相似极性的甲醇大,所以尝试甲醇作为流动相,流速1 mL/min,分离条件经过进一步优化,结果如图4所示。
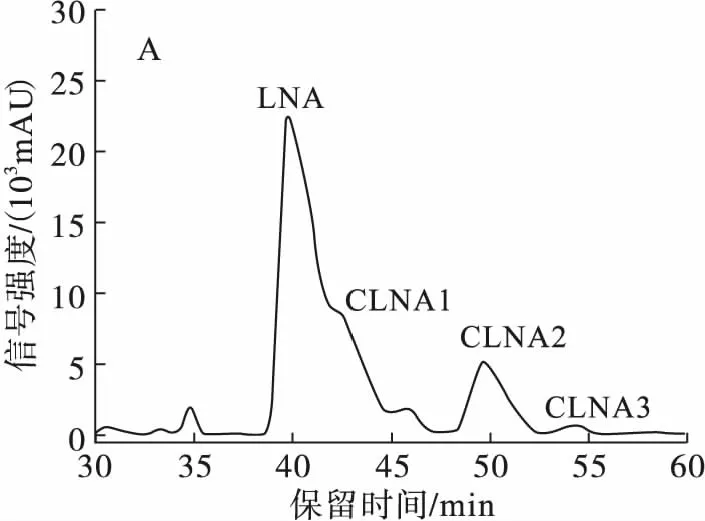
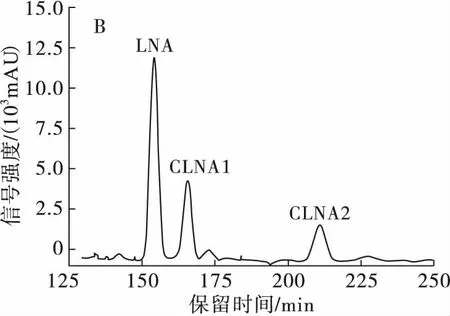

注:A.流动相为乙腈-H2O(体积比50∶50);B.流动相为乙腈-H2O-甲酸(体积比50∶50∶0.01);C.流动相为甲醇-H2O-甲酸(体积比70∶30∶0.01)。
图4流动相的优化
由图4可知,流动相添加甲酸后,峰形得到了很好的改善,峰形变尖锐,异构体之间的分离度更好。虽然保留时间变长,但是改善了保留时间不稳定的问题;当流动相为甲醇-H2O-甲酸(体积比70∶30∶0.01)时,虽然CLNA的分离度与乙腈-H2O-甲酸(体积比50∶50∶0.01)条件相似,但流动相中有机相的比例升高,保留时间缩短,有利于后续除去流动相及提高分离制备效率。由于样品中CLNA3的含量低,且甲醇在205 nm波长下有部分吸收,导致C30高效液相色谱柱在205 nm波长条件下基线波动剧烈,所以在205 nm条件下没有检测到CLNA3。
当流动相为甲醇-H2O-甲酸(70∶30∶0.01)时,CLNA的保留时间长,为了缩短保留时间,提高制备效率,尝试了梯度洗脱。结果表明,梯度洗脱时,基线漂移非常严重,且LNA与CLNA1的分离度不佳,改善梯度洗脱的条件也未能达到预想的目的,故梯度洗脱不适合C30高效液相色谱柱分离乳酸菌源CLNA异构体。
2.5 CLNA最优分离条件的重复性验证及CLNA异构体的纯度检测
将分离CLNA的最优条件即C30高效液相色谱柱,流动相为甲醇-H2O-甲酸(体积比70∶30∶0.01),流速为1 mL/min 进行3次重复实验,以精密度为指标检验方法的重复性,并将分离得到的各个CLNA异构体进行纯度检测,结果如表1和图5所示。
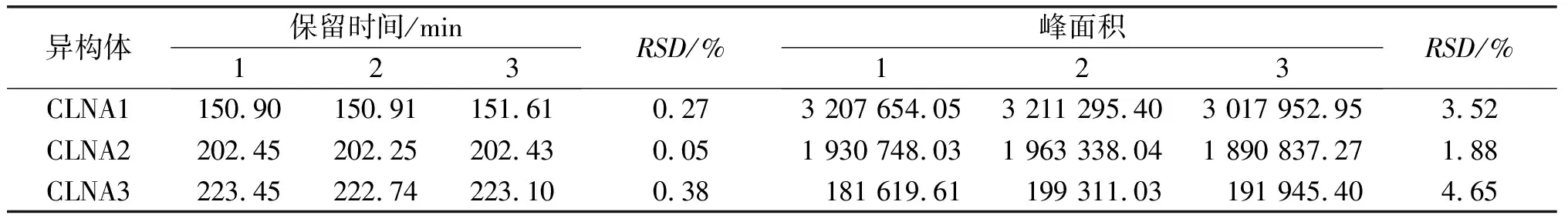
表1 CLNA最优分离条件的精密度
由表1可知,CLNA 3种异构体在最优分离条件下保留时间的RSD范围为0.05%~0.38%,峰面积的RSD范围为1.88%~4.65%,故该方法对3种CLNA异构体的测定有良好的精密度;由图5A、B可知,C30高效液相色谱柱,流动相为甲醇-H2O-甲酸(体积比70∶30∶0.01),流速为1 mL/min条件,LNA和CLNA1、CLNA1和CLNA2以及CLNA2和CLNA3的分离度高,重复性好。所以该条件是HPLC-UV分离乳酸菌源游离态CLNA的最优条件。为了提高分离制备的效率,在保证色谱柱一定的分离度下可以适当增加样品浓度以增加上样量,同时可升高样品和色谱柱的温度至37℃,使样品的溶解性更好,以达到高效分离制备的目的。
分离制备产物经过甲酯化后进行GC-MS纯度检测,结果得到CLNA1的纯度为97.48%,其中掺杂少量CLNA2;CLNA2的纯度为100%;CLNA3的纯度为65.30%,掺杂部分CLA,可能是由于在液相色谱图中CLNA3及CLA的含量太少,检测信号强度低,导致没有分离开来。总之,部分制备产物的纯度达到了单一异构体纯度要求。
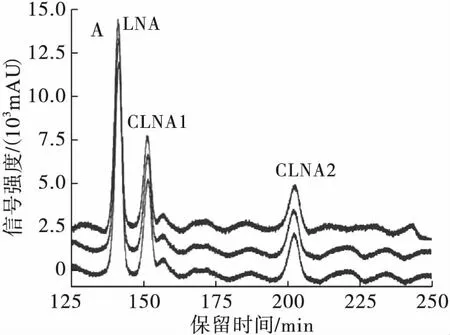
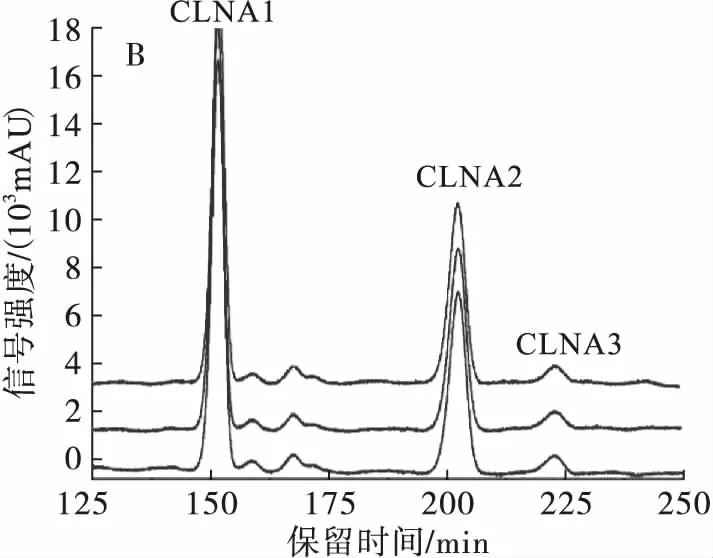
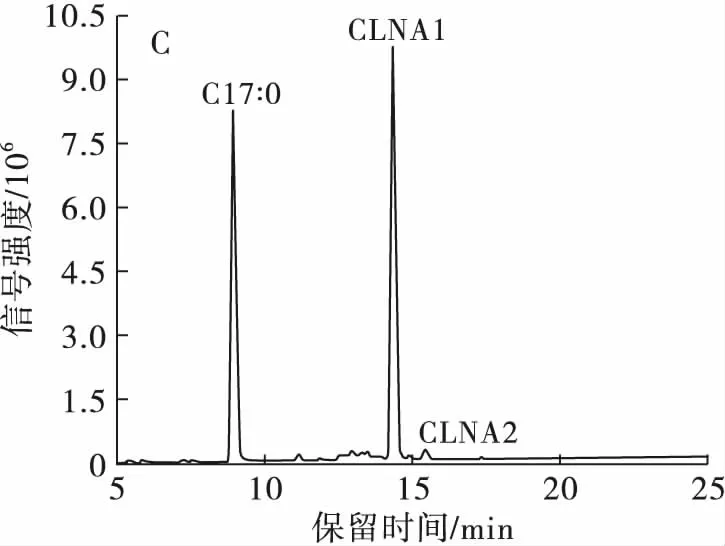
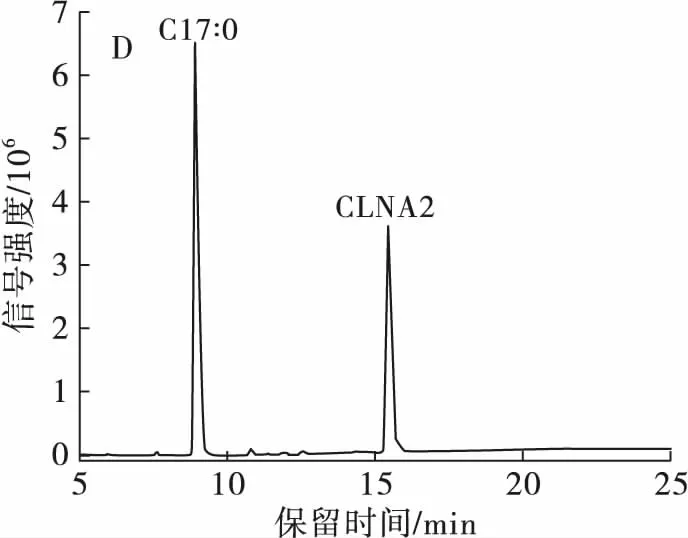
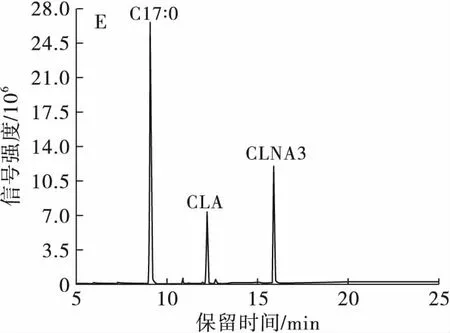
注:A.最优分离条件在205 nm波长下的液相色谱图;B.最优分离条件在233 nm波长下的液相色谱图;C.CLNA1的气相色谱图;D.CLNA2的气相色谱图;E.CLNA3的气相色谱图。
图5CLNA最优分离条件的重复性验证及3种CLNA异构体的纯度检测
3 结 论
本文通过薄层色谱和液相色谱的方法,对分离条件进行优化,确立了分离制备乳酸菌发酵液中CLNA的最优条件:色谱柱Ultimate®(5XB-C30,4.6 mm×250 mm);流动相为甲醇-水-甲酸(体积比70∶30∶0.01);流速为1 mL/min;检测紫外波长为205 nm和233 nm。该条件可以分离到3种CLNA异构体,并且分离度好,精密度高。制备得到的CLNA1纯度为97.48%,CLNA2的纯度为100%,CLNA3的纯度为65.30%。本实验也证明了薄层色谱法中展开剂为氯仿-甲醇-乙酸不能应用于分离乳酸菌发酵液中游离态CLNA异构体;C30高效液相色谱柱更适合分离乳酸菌发酵液中结构差异很小的游离态CLNA异构体;为了提高分离制备的效率,在保证色谱柱一定的分离度下可以适当增加样品浓度以增加上样量,同时升高样品和色谱柱的温度至37℃使样品的溶解性更好,来达到高效分离制备的目的。虽然本文首次建立了分离制备乳酸菌源游离态CLNA的方法,但是液相色谱图中CLNA3和CLA的检测信号强度太低,导致两者没有分离开来,纯度有待提高,后期可以进行第二次制备来获得更高纯度的CLNA3,为单一异构体的功能研究奠定基础。
