急性髓系白血病中DLX4基因异构体的差异性表达及其临床相关性分析
2021-09-06冷加燕张婷娟马吉春周静东
冷加燕,张婷娟,林 江,谷 雨,于 迪,马吉春,钱 军,周静东
急性髓系白血病(acute myeloid leukemia, AML)是一种高度异质性血液系统恶性克隆性疾病,也是较为常见的成人白血病类型[1]。AML发病涉及细胞遗传学与分子生物学的巨大异质性导致患者预后差异较大[2]。根据中国成人AML治疗指南,依据初诊时不同染色体及基因突变可将AML患者分为预后良好、中等、不良组[3]。此外,表观遗传学涉及的基因表达异常在AML中亦扮演重要角色,并且与患者预后密切相关[4]。许多研究揭示AML中BAALC、MN1、ERG等基因过表达与患者预后不良相关[5]。寻找更多影响AML预后的分子标志,对AML预后精准评估并指导患者个体化及精准治疗具有重要临床意义。
DLX4基因位于17q21.33,是一种转录因子,在调控人体组织器官、造血系统形成中起重要作用[6-7]。DLX4基因目前公认有2个异构体,其中转录本较长的称为BP1(NM_138281),转录本较短的称为DLX7(NM_001934)。已有文献[8]报道异构体BP1在实体肿瘤呈过表达,并且与患者预后不良相关。异构体DLX7在AML中表达尚未见相关报道。本实验应用RT-qPCR法检测AML患者中DLX4异构体的表达及甲基化情况,分析其临床意义。
1 材料与方法
1.1 材料收集2005年10月~2017年12月江苏大学附属人民医院血液科诊治的153例AML患者,其中男性90例,女性63例,年龄18~93岁(中位56岁)。另收集37例骨髓捐献者,其中男性21例,女性16例,年龄32~65岁(中位50岁)。所有AML患者诊断分型按WHO(2016)标准[9]。治疗方案参考文献报道[10]。此外,白血病细胞株K562、SHI-1、U937、THP-1、NB4、HL60、HEL及MV4-11为苏州大学附属第一医院血液科陈苏宁教授馈赠。SHI-1细胞株培养在10%含铁胎牛血清的IMDM培养基中,其余细胞株培养在10%胎牛血清的RPMI-1640培养基中。细胞培养生长坏境均为37 ℃ 5%CO2培养箱。本实验通过江苏大学附属人民医院伦理委员会批准,同时获患者知情同意。
1.2 方法
1.2.1骨髓单个核细胞分离、RNA提取和DNA提取 收取对照组及所有患者骨髓10 mL,使用人淋巴细胞分离液(索莱宝公司,中国)分离出骨髓单个核细胞BMMNCs。应用TRIzol法提取总RNA,提取方法参考Trizol试剂盒说明书。同时通过Puregene Blood Core Kit B(Qiagen公司,德国)提取DNA,方法亦参考试剂盒说明书。
1.2.2逆转录及RT-qPCR检测DLX4的表达 取总RNA 400 ng,采用PrimeScript RT试剂盒(Takara公司,日本)进行逆转录。反应条件:37 ℃ 20 min,85 ℃ 5 s。合成的cDNA保存于-20 ℃备用。异构体BP1引物序列:上游5′-TACCCGCTTGGCTTGTCC-3′,下游5′-AACGCTGGTTTAGGTGCTG-3′,目的产物长度为316 bp;异构体DLX7引物序列:上游5′-TTATGAAACTGTCCGTCCTACC-3′,下游5′-TGT GCTGGAAACGCTGGT-3′,目的产物长度为201 bp;选取ABL1作为内参基因,ABL1引物序列:上游5′-TCCTCCAGCTGTTATCTGGAAGA-3′,下游5′-TCC AACGAGCGGCTTCAC-3′,引物由上海华大基因公司合成。通过AceQ qPCR SYBR Green Master Mix进行RT-qPCR定量检测异构体BP1及DLX7的表达。RT-qPCR反应在ABI 7300扩增仪上进行,反应条件:预变性95 ℃ 5 min(1个循环),变性95 ℃ 10 s、退火63 ℃ 30 s(BP1)以及60 ℃ 30 s(DLX7)、延伸72 ℃ 30 s、收集荧光80 ℃ 30 s(40个循环)。异构体BP1及DLX7相对表达量计算方法参考文献报道[11]。
1.2.3亚硫酸盐处理及MSP法检测异构体BP1启动子甲基化 取gDNA 1 μg,采用EpiTech Bisulfite Kit(Qiagen公司,德国)试剂盒参照说明书进行硫化修饰,修饰后的标本置于-80 ℃保存备用。异构体BP1启动子甲基化MSP引物序列:甲基化上游5′-TAGATCGGTTTGGAGTATGC-3′,甲基化下游5′-AACGTCCCGAATTAACTACC-3′;未甲基化上游5′-AGGTAGATTGGTTTGGAGTATGT-3′,未甲基化下游5′-TTAAACATCCCAAATTAACTACC-3′,甲基化及未甲基化目的产物长度均为131 bp。通过EpiTaq HS(for bisulfite-treated DNA)(Takara公司,日本)进行MSP定性检测BP1启动子甲基化态势。MSP反应条件:预变性98 ℃ 10 s(1个循环),变性98 ℃ 10 s、退火59 ℃ 30 s以及60 ℃ 30 s(DLX7)、延伸72 ℃ 30 s、酶灭活72 ℃ 7 min(40个循环)。MSP产物通过2%琼脂糖凝胶电泳验证。
1.2.4BSP法检测异构体BP1启动子甲基化 异构体BP1启动子甲基化BSP引物序列:上游5′-GG GAGATTGTAAATGTAGATTTTTTG-3′,下游5′-AT ACCCCCCATAACTTTCCC-3′,目的产物长度均为415 bp,含有27个CpG位点。通过EpiTaq HS(for bisulfite-treated DNA)(Takara公司,日本)进行BSP定性扩增BP1启动子。BSP反应条件:预变性98 ℃ 10 s(1个循环),变性98 ℃ 10 s、退火59 ℃ 30 s、延伸72 ℃ 30 s、酶灭活72 ℃ 7 min(40个循环)。BSP产物通过2%琼脂糖凝胶电泳验证并切胶回收,并使用AxyPrep DNA Gel Recovery Kit(Axygen公司,美国)纯化。纯化后产物通过pMD 19-T Vector Kit(Takara公司,日本)连接,后导入DH5α感受态细胞(Vazyme公司,中国)克隆。最后选择至少10个单克隆送华大基因公司行Sanger法测序。
1.3 统计学分析采用SPSS 22.0及GraphPad Prism 5.0软件进行统计学分析。两组连续性变量间的差异分析使用Mann-WhitneyU检验,分类变量之间的差异分析采用χ2检验或Fisher确切概率法。DLX4表达在AML中的诊断价值采用ROC曲线及ROC曲线下面积(AUC)进行评价。采用Kaplan-Meier法进行生存分析。P<0.05为差异有统计学意义。
2 结果
2.1 AML患者及细胞株中DLX4基因异构体的表达RT-qPCR检测37例对照组中异构体BP1表达的平均水平为0.028(中位值0,范围0~1.000),153例AML患者中异构体BP1表达的平均水平为0.324(中位值0,范围0~8.905),与对照组相比,异构体BP1在AML中表达上调,差异有显著性(P<0.001,图1A)。此外,7例AML细胞株和1例慢性粒细胞白血病(chronic myelogenous leukemia, CML)急粒变细胞株中BP1表达水平比对照组平均水平(0.028)均有不同程度增高(图1B)。
37例对照组中异构体DLX7表达的平均水平为1.234(中位0.265,范围0.012~7.804),153例AML患者中异构体DLX7表达的平均水平为0.275(中位0.008,范围0~6.150),异构体DLX7在AML中表达比对照组下调(P<0.001,图1C)。此外,7例AML细胞株和1例CML急粒变细胞株中DLX7表达水平比对照组平均水平(1.234)均有不同程度降低(图1D)。

图1 AML患者及细胞株中DLX4各异构体的表达水平:A.异构体BP1在AML患者中的表达;B.异构体BP1在AML细胞株中的表达;C.异构体DLX7在AML患者中的表达;D.异构体DLX7在AML细胞株中的表达
2.2 DLX4基因异构体启动子CpG岛在AML患者及细胞株中的甲基化态势为进一步探索DLX4异构体差异性表达的影响因素,对DLX4基因结构进行分析,发现DLX4两个异构体BP1和DLX7前启动子区域均存在较大的CpG岛(图2A)。本组前期实验结果发现AML及CML患者中异构体DLX7启动子CpG岛存在高甲基化现象,并且可能影响异构体DLX7表达导致其表达下调[12-13]。本实验首先通过MSP法对AML细胞株进行检测,发现7例AML细胞株和1例CML急粒变细胞株均呈完全未甲基化态势(图2B)。随机选择2例AML细胞株通过BSP法亦证实其低甲基化状态(图2B)。另实验还通过MSP法对AML进行检测,结果亦发现AML均呈完全未甲基化态势,7例AML患者代表性结果详见图2C。随机选择8例AML通过BSP法亦证实其低甲基化状态(图2C)。

图2 DLX4基因结构模式图及BP1启动子区域CpG岛在AML中的甲基化态势:A.DLX4基因结构模式图;B.AML细胞株中BP1启动子区域CpG岛甲基化态势,其中1~8分别为K562、SHI-1、U937、THP-1、NB4、HL60、HEL、NB4,9为未甲基化质控,10为甲基化质控,11为双阴性质控,BSP散点图为HL60及THP-1细胞株;C.AML患者中BP1启动子区域CpG岛甲基化态势,其中1~7为随机挑选的7例AML,8为未甲基化质控,9为甲基化质控,10为双阴性质控;BSP散点图为随机挑选的8例AML患者
2.3 DLX4基因异构体表达的鉴别诊断意义采用ROC曲线评估DLX4异构体表达是否可作为AML诊断的潜在分子标志,结果发现异构体BP1表达可用于鉴别实验组和对照组的参考标志(AUC=0.699,95%CI:0.619~0.779,P<0.001,图3A)。异构体DLX7表达更能用于鉴别实验组和对照组的参考标志(AUC=0.834,95%CI:0.776~0.893,P<0.001,图3B)。此外,为进一步明确BP1及DLX7表达联合在AML中的潜在诊断价值,实验进一步通过Logistic回归分析拟合新变量,同时通过ROC曲线分析发现,异构体BP1及DLX7表达联合用于鉴别实验组和对照组的效能更为有价值(AUC=0.883,95%CI:0.821~0.945,P<0.001,图3C)。
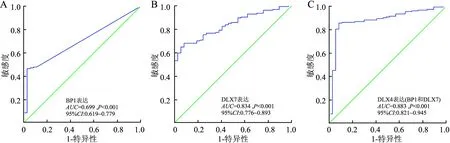
图3 AML患者中DLX4各异构体表达的ROC分析:A.AML患者中异构体BP1表达的ROC分析;B.AML患者中异构体DLX7表达的ROC分析;C.AML患者中异构体BP1和DLX7联合表达的ROC分析
2.4 DLX4基因异构体表达与AML临床及实验室参数的相关性选取使ROC曲线的敏感度、特异性最优的异构体BP1表达水平(0.007)(敏感度为46.4%,特异性为97.3%)及DLX7表达水平(0.012)(敏感度为52.9%,特异性为100%)为临界值。针对异构体BP1,高表达组和低表达组在患者性别、年龄、血小板计数、血红蛋白含量、骨髓原始细胞比例及核型危险度分组中差异均无显著性(P>0.05),但异构体BP1高表达组患者的白细胞计数显著高于异构体BP1低表达组(P=0.001)。此外,两组患者在FAB分型分布上差异有显著性(P=0.021)。在基因突变中,异构体BP1高表达组患者FLT3-ITD突变率显著高于异构体BP1低表达组患者(P=0.039,表1)。
针对异构体DLX7,高表达组和低表达组在患者性别、年龄、白细胞计数、血小板计数、血红蛋白含量、骨髓原始细胞比例、FAB分类、核型危险分组、基因突变中差异均无显著性(P>0.05,表1)。
2.5 DLX4基因异构体表达与AML患者预后的相关性实验分析了DLX4异构体表达与患者接受诱导化疗后完全缓解率的关系(随访130例)。异构体BP1过表达患者完全缓解率低于异构体BP1高表达组患者,仅在非M3组患者中差异有显著性(P=0.047);异构体DLX7高低表达组患者之间差异无显著性(P>0.05,表1)。
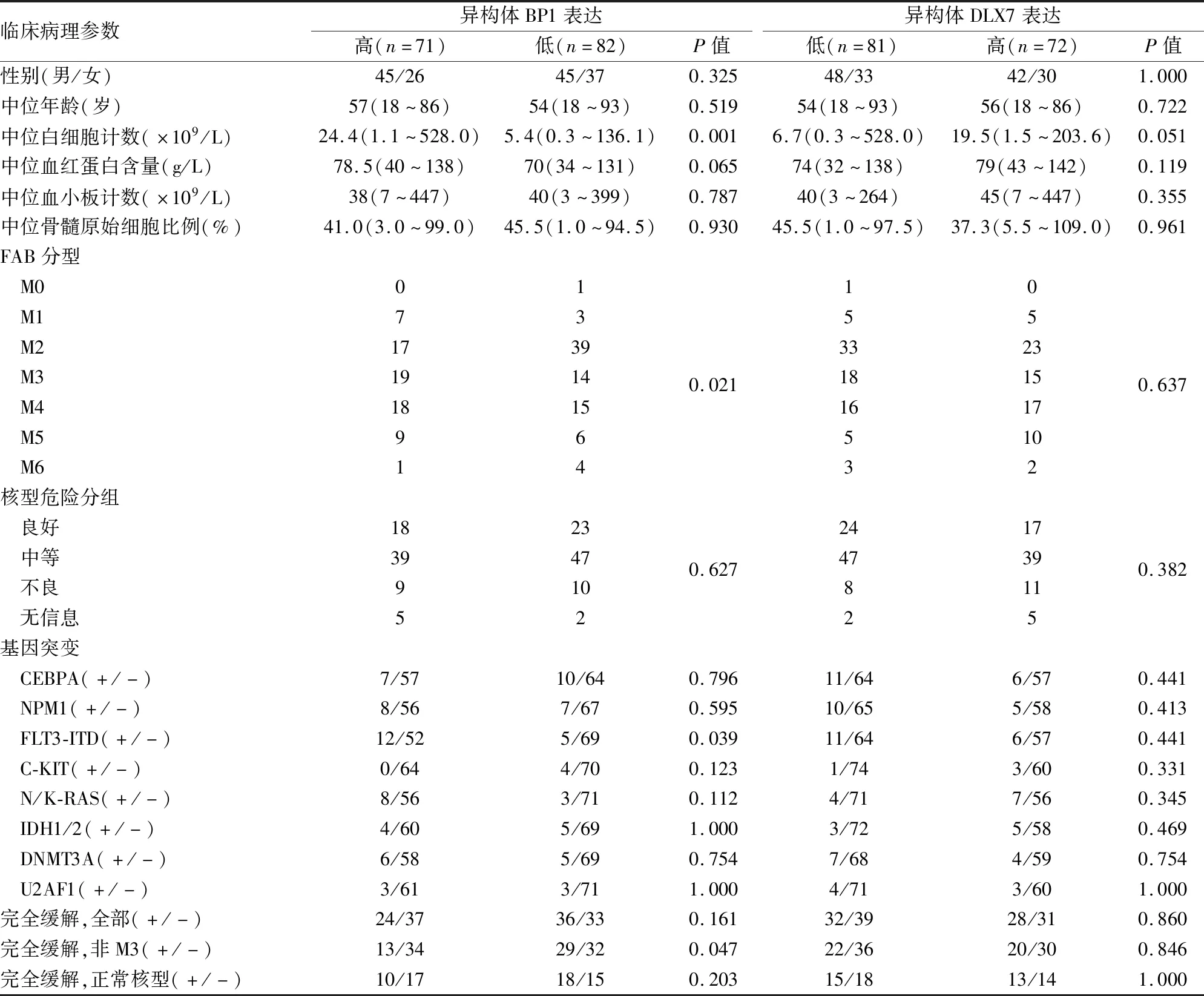
表1 AML患者中DLX4各异构体表达与临床病理特征的关系
Kaplan-Meier法进一步分析DLX4异构体表达对患者生存的影响(随访130例)。异构体BP1高表达患者总生存期低于异构体BP1低表达患者,在非M3患者及正常核型AML患者中差异有显著性(P=0.007、0.035,图4)。因异构体BP1高表达和FLT3-ITD突变有相关性,且FLT3-ITD过表达提示患者预后不良。实验剔除FLT3-ITD突变患者,通过生存分析进一步证实异构体BP1过表达对患者预后不良的影响(P=0.004、0.024,图4)。异构体DLX7通过生存分析发现:无论是全部AML、非M3 AML及正常核型AML中,两组之间差异均无显著性(P>0.05,图4)。

图4 AML患者中DLX4各异构体表达对患者预后的影响
3 讨论
越来越多的报道揭示DLX4基因在肿瘤发生、发展过程中起重要作用。如Zhang等[14]报道DLX4可以通过上调TWIST促进上皮-间充质转化从而促进乳腺癌细胞侵袭及转移。此外,亦有报道证实DLX4异构体BP1通过促进细胞增殖及侵袭参与ER-乳腺癌的发生、发展[15]。Haria等[16]研究结果显示,DLX4可以通过刺激NF-κB活性诱导CD44表达促进卵巢癌的转移。此外,敲减DLX4表达可促进绒毛膜癌细胞的凋亡[17]。Ling等[18]研究发现,DLX4可上调YB-1影响细胞增殖、周期及侵袭,参与鼻咽癌的形成。临床相关研究结果亦证实DLX4或异构体BP1在肿瘤中的表达与患者预后密切相关,并且可能作为预后判断的分子标志物[19-21]。综合以上结果揭示,DLX4在肿瘤发生、发展中起促癌作用。然而,亦有较多研究发现DLX4在肿瘤中存在高甲基化现象,并且与预后密切相关[22-23],这些结果提示DLX4可能扮演抑癌作用,其与之前报道DLX4发挥促癌作用结论矛盾。对DLX4的基因结构进行分析发现,DLX4基因存在2个异构体,CDS较长者称之为BP1,CDS较短者称之为DLX7,而多数报道并未严格区分两者。本实验分别设计2个异构体的特异性引物在AML患者及细胞株中的表达进行检测,结果发现异构体BP1在AML中呈过表达态势,与先前报道一致[24]。然而,异构体DLX7在AML中呈低表达态势,既往未见相关报道。针对DLX4的2个异构体功能,拟进一步实验证实。此外,本实验进一步分析了DLX4的2个异构体表达的临床意义,ROC曲线分析揭示异构体BP1及DLX7表达,尤其是两者联合变量,可能对AML辅助诊断有一定帮助;预后分析揭示BP1过表达与AML患者低缓解率及低生存期相关,与实体肿瘤报道类似。由于异构体DLX7表达与AML患者预后无相关性,因此异构体BP1在AML形成中可能扮演促癌作用,异构体DLX7可能扮演抑癌作用,并且异构体BP1过表达可能作为AML患者预后判断的生物学标志物。
甲基化作为最为常见的表观遗传学方式之一,在调控基因表达方面起重要作用。鉴于已有文献报道揭示DLX4存在高甲基化现象,同时DLX4的2个异构体表达态势相反。本实验进一步分析DLX4基因结构,发现异构体BP1及DLX7前启动子区域均有较大的CpG岛,既往报道DLX4甲基化研究区域主要是针对异构体DLX7启动子内CpG岛,并且影响基因表达。我们既往通过定量MSP及BSP的方法亦证实AML及CML患者中异构体DLX7启动子CpG岛存在高甲基化现象,并且与DLX7表达呈负相关[12-13]。此外,对异构体DLX7启动子高甲基化AML细胞株行去甲基化处理可恢复DLX7的表达[12-13]。由此揭示,异构体DLX7在AML中表达下调可能是因为DLX7启动子CpG岛高甲基化所致。本实验进一步针对AML中异构体BP1启动子CpG岛进行分析,结果发现异构体BP1启动子CpG岛呈完全未甲基化。由此可见,AML中异构体BP1表达上调不是因为BP1启动子甲基化改变所致。目前已有报道表明实体肿瘤中异构体BP1过表达可能因其基因拷贝数扩增所致[25]。此外,针对其他基因相关研究发现基因启动子转录因子结合位点多态性可能影响基因表达参与AML的发生[26]。然而,AML中异构体BP1过表达原因目前尚不完全明确,有待进一步分析。
综上所述,AML中DLX4的2个异构体BP1及DLX7表达态势不同。异构体BP1呈过表达,与其启动子甲基化无关,可作为AML患者预后不良的生物学标志物;DLX7呈低表达,可能受其启动子高甲基化影响,与AML患者预后无关。
