微嗜酸寡养单胞菌的分离培养及其对颜料红23的降解
2019-01-18孙璐璐赵晓祥
孙璐璐,赵晓祥,白 恒,程 晨
(东华大学 环境科学与工程学院, 上海 201620)
染料是纺织工业的基础原料,其在使用过程中约有10%会通过印染废水进入环境中,造成水环境污染[1]。染料污染水体,不仅会改变水体色度,影响水体的透光度和溶解度,威胁水体生物,而且染料中含有的环状芳香族化合物会造成生态风险,危害人体健康[2]。由于偶氮染料合成工艺较成熟、成本较低、产品光泽较好且色泽牢固,其在印染工业中被广泛使用且用量最大,占全部染料的50%以上[3]。偶氮染料及其降解产物通常含有芳香胺类化合物,具有致畸、致癌和致突变的作用[4],因此,偶氮染料的降解脱色受到了国内外学者的广泛关注。
目前,对偶氮染料的脱色处理方式集中在物化方法[5],例如离子交换法、光氧化法、反渗透膜过滤法、电凝法、深层注射法、吸附法、絮凝法、臭氧氧化法、焚烧法和有机溶剂提取法等,但这些方法存在成本高、能耗大,可能造成二次污染的问题[6]。生物法为生物降解和生物吸附的共同作用方法。生物降解主要通过微生物分泌的胞外氧化酶进行偶氮染料的脱色处理[7];而生物吸附主要通过菌丝体的自身结构与染料等大分子物质相结合进行脱色[8]。目前,已报道的高效脱色菌株包括Gracilibacillussp.GTY[9]、Halomonassp.GTW[10]、Aeromonassp.DH-6[11]等。生物法高效稳定,具有环境友好型的经济效益,被广泛地应用于实际工程。
本文筛选出对偶氮染料具有高效脱色作用的微嗜酸寡养单胞菌,该菌株已有关于解毒效能方面的研究[12],但针对偶氮染料降解的研究鲜有报道。采用海藻酸钙固定化改善脱色效果,交联剂使用氯化钙或氯化钡可提高反应稳定性。 Moutaouakkil等[13]采用不同固定化载体脱色甲基红染料,其中海藻酸钙小球脱色效果最佳。因此,本研究利用筛选出的脱色菌,研究其对偶氮染料的生物降解作用,并采用氯化铁作为新型交联剂,制备磁性固定化小球,提高抵抗环境因素的能力,以期丰富微生物固定化研究报道。
1 试 验
1.1 试验材料
1.1.1 菌株
菌株筛选自上海市松江区污水处理厂二沉池中的活性污泥。
1.1.2 试剂
颜料红23购买于某化工厂,呈暗蓝光红色,耐光牢度仅为3级。颜料红23的粒径小,呈透明型,黏度较高,耐溶剂性能较差,在包装印墨中出现结晶现象。其可用于织物印花,NC-型及水性印墨,亦可用于涂料着色,但耐罩漆性能稍差。外观呈红色粉末,分子式为C24H17N5O7,相对分子质量为487,密度为1.47 g/cm3,熔点为330~340 ℃,折射率为1.693。海藻酸钠(SA)、氯化钠(NaCl)、氯化钙(CaCl2)、氯化铁(FeCl3)、鱼粉蛋白胨、酵母粉、琼脂、七水合硫酸镁(MgSO4·7H2O)、磷酸二氢钾(KH2PO4)、磷酸氢二钠(Na2HPO4)、氢氧化钠(NaOH)、盐酸(HCl)等试剂均为国产分析纯。
1.1.3 培养基
固体培养基:10 g鱼粉蛋白胨、5 g酵母粉、10 g NaCl、15 g琼脂和1 L蒸馏水,pH=6.8~7.2。
富集培养基:10 g鱼粉蛋白胨、5 g酵母粉、10 g NaCl和1 L蒸馏水,pH=6.8~7.2。
脱色培养基:0.1 g CaCl2、0.5 g MgSO4·7H2O、1 g NaCl、1 g KH2PO4、1 g Na2HPO4、10 g酵母粉、100 mg颜料红23和1 L蒸馏水,pH=6.8~ 7.2。
1.1.4 主要仪器
BSA124S型电子分析天平、UV-1800PC型紫外可见分光光度计、BXM-30R2型立式压力蒸汽灭菌器、R56-300型光照培养箱、VS-840-1型洁净工作台、HANNAm8424型pH/ORP测定仪、CT14RD型台式高速冷冻离心机、SK250H型超声波清洗器、SPH-2102C型立式双层摇床、Sirion 200型高分辨场发射扫描电子显微镜和比表面积和孔径分析仪。
1.2 菌株鉴定
采用环境微生物试验方法对菌体进行革兰氏染色,之后进行扫描电子显微镜分析。委托上海基康生物技术有限公司对菌株基因组DNA进行提取及16S rDNA测序,并与美国国立生物技术信息中心(NCBI)的数据库进行同源性比较,构建系统发育树。
1.3 菌悬液制备
在无菌条件下,将菌株接种到装有100 mL富集培养基的250 mL灭菌锥形瓶中,在35 ℃和120 r/ min环境下恒温培养48 h。取出10 mL富集培养的菌液置于灭菌离心管中,以6 000 r/min的转速离心10 min,用无菌生理盐水洗涤并离心2次,配成一定体积百分浓度的菌悬液。
1.4 菌体生长曲线及染料降解曲线测定
在无菌条件下,将100 mL脱色培养基分装入250 mL灭菌锥形瓶中。在颜料红23的脱色培养基中接种10%的菌悬液,放入35 ℃和120 r/min环境下恒温培养一定时间。每2 h取样,测量菌体细胞密度(OD600)及上清液在579 nm处吸光度。以无菌的脱色培养基做空白对照,计算脱色率。重复3次取平均值,得到菌株生长曲线及染料降解曲线。
1.5 固定化菌球的制备
取一定量SA置于50 mL无菌水中,在加热条件下完全溶解后配成胶状溶液,冷却至30 ℃。在无菌条件下,将适量菌悬液与胶状溶液混合均匀,采用1 mL注射器将其快速地滴入不断搅拌的交联剂中,将形成的均匀规则的小球置于4 ℃冰箱内静置24 h。 将固化交联后的小球用蒸馏水清洗2次,即得固定化菌球。
1.6 固定化菌球对染料脱色因素的研究
选取交联剂种类、交联剂浓度、接种量和投加量作为影响因素,制备固定化小球,将其添加至100 mL颜料红23的脱色培养基中,在35 ℃和120 r/min环境下恒温培养一定时间后测定脱色率。研究单一因素的最佳条件,判断各因素对颜料脱色效果的影响。每个因子均设置不同的影响梯度,研究其中某一因素的影响时,仅对该因素设置不同梯度,其他因素保持不变,后续因素试验以前面试验得到的各因素最适条件为前提进行。重复3次取平均值。
1.7 脱色率计算
取10 mL脱色后溶液,以10 000 r/min的转速离心6 min,按式(1)计算其脱色率。
(1)
式中:w为脱色率(%);A0为无菌脱色培养基在579 nm 的吸光度;At为脱色后上清液在579 nm的吸光度。
2 结果与讨论
2.1 菌株的革兰氏染色及电镜扫描
该菌株经多次平板划线分离培养后,放入35 ℃恒温环境中培养48 h,在固体培养基上生长的菌落如图1(a)所示,其形态为圆形、边缘整齐、呈黄色、不透明、隆起且有黏性。对菌株进行革兰氏染色,电镜扫描结果如图1(b)所示,经革兰氏染色后呈红色为革兰氏阴性菌。电镜扫描呈现出该菌株的微观结构如图2所示,菌体呈两截短杆状,无鞭毛。


(a) 固体培养基上的菌落(b) 革兰氏染色图1 活化后的菌株Fig.1 Picture of the strain and gram staining

图2 菌株的扫描电镜Fig.2 SEM micrograph of the strain
2.2 菌株的16S rDNA序列分析
经16S rDNA基因测序鉴定,该菌株构建的系统发育树如图3所示,通过相似度99%可判断该菌株为微嗜酸寡养单胞菌(Stenotrophomonasacidaminiphilasp.)。

图3 菌株的16S rDNA基因序列系统发育树Fig.3 Phylogenetic tree derived from 16S rDNA gene sequence of the strain
2.3 菌株生长曲线及染料脱色曲线
菌株生长及其对颜料红23脱色曲线如图4所示。由图4可知,微嗜酸寡养单胞菌的适应期较短,在2 h后进入对数期,2~18 h内生长繁殖快,代谢活力强,随后进入平稳期,该趋势与苏萌等[14]研究的偶氮染料脱色菌Lysinibacillussp.生长趋势相类似。18 h后菌株对颜料红23的脱色效率达90%以上,表现出高效脱色能力。对脱色代谢产物在200~900 nm范围内进行紫外可见分光光度计扫描发现,该菌株对颜料红23的脱色方式以生物降解为主。

图4 微嗜酸寡养单胞菌的生长曲线及对颜料红23的脱色曲线Fig.4 Growth rate of the strain and decolorization rate on pigment red 23
2.4 固定化小球的制备及脱色性能研究
2.4.1 固定化小球的制备
海藻酸钠(SA)为应用较为广泛的微生物固定化载体。采用SA作为固定化包埋材料,在不同质量分数下制备固定化小球,其性状如图5所示。由图5可知:当SA质量分数为1.5%和2.0%时,成球的形状规则、硬度和弹性均呈现较好的性状;SA质量分数低于1.0%时,成球性能较差,弹性和硬度较低;当SA质量分数过高时,小球有严重的拖尾现象,交联程度过高,导致弹性和载体通透性降低从而影响降解效率。考虑成本因素,采用质量分数为1.5%的SA溶液作为固定化载体制备小球。

图5 不同SA质量分数制备的固定化小球性状比较Fig.5 Properties of immobilized pellets prepared with different mass fraction of SA
2.4.2 交联剂种类对脱色性能的影响
将质量分数为1.5%的SA溶液作为固定化载体,添加体积分数为2%的菌悬液,将其滴加至质量分数为5%的CaCl2、BaCl2、FeCl3、NiCl2、CoCl2、FeCl2、ZnCl2等溶液中制备固定化小球,试验结果显示SA与多种金属离子均可进行交联。在制备固定化小球时,不同交联剂对菌株细胞的亲和力不同,最终会影响小球性状。试验中观察到FeCl3作为交联剂时小球比表面积最大,FeCl2、NiCl2和CoCl2作为交联剂时成球性较差。交联剂的种类对菌株脱色率的影响如表1所示。由表1可知,采用交联剂CaCl2、BaCl2、FeCl3和FeCl2制备的固定化小球对颜料红23均表现出较好的脱色效果,其中以FeCl3最为显著,提高了菌株与包埋材料的亲和力,增强了对颜料红23的脱色能力,这与秦胜东等[15]关于菌株对不同无机材料的附着能力研究结果相一致。因此,后续试验选用FeCl3作为制备固定化菌球的交联剂。

表1 交联剂种类对菌株脱色率的影响Table 1 Effect of cross-linking agents on decolorizationrate of pigment red 23
2.4.3 交联剂质量分数对脱色性能的影响
将质量分数为1.5%的SA溶液作为固定化载体,添加体积分数为2%的菌悬液,滴加至质量分数为3%、 4%、 5%、 6%和7%的FeCl3溶液中。交联剂浓度对菌株脱色率的影响如表2所示。由表2可知,不同质量分数的FeCl3溶液制备的固定化菌球对颜料红23均具有一定的脱色效果,且随着FeCl3质量分数的增大,脱色效果逐渐加强,当FeCl3质量分数为5%时脱色效果最佳。当交联剂质量分数过高时,由于固定化载体中Na+含量限定了可交联的Fe3+数量,交联作用达到饱和,菌株对颜料红23的脱色基本保持不变。因此,后续试验选取交联剂FeCl3的质量分数为5%。

表2 FeCl3质量分数对菌株脱色率的影响Table 2 Effect of FeCl3 mass fraction on thedecolorization rate of pigment red 23

表3 菌株接种量对菌株脱色率的影响Table 3 Effect of the strain’s inoculation concentration ondecolorization rate of pigment red 23
2.4.4 菌株接种量对脱色性能的影响
将质量分数为1.5%的SA溶液作为固定化载体,质量分数为5%的FeCl3溶液作为交联剂,接种体积分数为0、 1%、 2%、 4%、 6%和8%的菌悬液,制备固定化菌球。菌株接种量对菌株脱色率的影响如表3所示。由表3可知:菌悬液体积分数为4%时,脱色率达到81%,此时脱色率主要取决于固定化小球表面吸附的菌株量;菌悬液体积分数由4%增至8%时,由于包埋菌体过多,生存空间狭小,营养源和溶解氧有限,产生竞争,抑制菌体生长,脱色率逐渐降低,该趋势与包木太等[16]研究包埋种子菌浓度对微球性能的影响时得出的结论相似。因此,制备固定化菌球的最优菌悬液体积分数为4%。
2.4.5 固定化小球投加量对脱色性能的影响
将质量分数为1.5%的SA溶液作为固定化载体,质量分数为5%的FeCl3溶液作为交联剂,接种体积分数为4%的菌悬液制成固定化小球,在100 mL颜料红23脱色培养基中设置固定化小球投加量梯度为1、 3、 4、 5、 6、 7和9 g。固定化小球的投加量对脱色率的影响如表4所示。由表4可知,投加量为5 g时,菌株对颜料红23的脱色率达到89%。投加量过低时,由于菌体含量较低,导致脱色作用有限;投加量过高时,菌体由于生长空间和营养源有限,生长受到抑制而活性降低甚至死亡,对颜料红23的脱色率降低。当被包埋的菌株保持良好的活跃状态时,脱色率随菌体含量增加而增大。因此,固定化小球的最佳投加量为5 g。
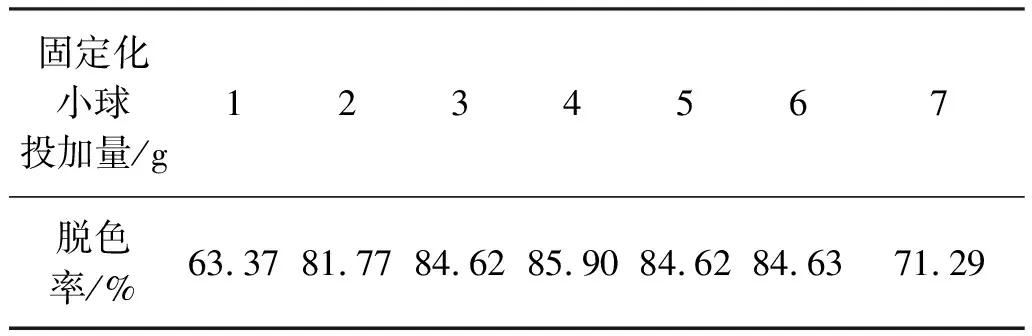
表4 固定化小球的投加量对菌株脱色率的影响Table 4 Effect of immobilized pellet quality on decolorizationrate of pigment red 23
2.5 固定化菌球的性状表征
2.5.1 扫描电子显微镜分析
将质量分数为1.5%的SA溶液作为固定化载体,质量分数为5%的FeCl3溶液作为交联剂,接种体积分数为4%的菌悬液制成固定化菌球,将其用于颜料红23的脱色。降解前后固定化菌球的扫描电子显微镜图和小球的直观图如图6所示。由图6可知,固定后的微生物小球呈黄色,形状规则,大小均一,颗粒直径约为5 mm。图6(a)为无菌的固定化小球,从高倍镜下小球形貌看出,固定后小球褶皱均匀规整;图6(b)和(c)为低、高倍镜下的固定化菌球,从形貌可以看出,接种菌液后的小球表面凹凸不平,覆盖有胞状物质,且分布不均匀,可能是由于接种后菌株被包埋或者吸附在小球的孔隙中生长,形成了单菌;图6(d)表明降解后的小球表面孔径明显增大,推测其内部物质可能与颜料红23脱色培养基进行反应。

图6 降解前后固定化菌球的扫描电子显微镜图和小球的直观图Fig.6 SEM micrographs of the immobilized pellet before/after degradation and macroscopic photo of the pellet
2.5.2 比表面积分析
降解前后的固定化菌球比表面积测定结果如表5所示。由表5可知,降解后的固定化菌球比表面积有所减小,孔径略微增大,这表明高倍镜下观察到的覆盖在小球表面的物质很可能为微嗜酸寡养单胞菌体。小球的比表面积较大,投加后与脱色培养基进行反应,附着在小球表面的菌株减少,并且通过孔径的传质作用,包埋在小球内部的菌株和Fe3+可增强对颜料红23的脱色作用。

表5 降解前后固定化菌球的比表面积及孔径Table 5 The surface area and pore diameter of the immobilized pellet before/after degradation
2.5.3 能谱分析

图7 固定化菌球表面元素分布Fig.7 Elemental distribution on the surface of the immobilized pellet
投加前菌球表面元素分布如图7所示。由图7可知:C、Na、Cl、Fe等主要元素分散良好,小球成球性状较好,分布密度均匀;O元素的分布密度不均,高密度区域与高倍镜下的扫描电镜图表征结果一致。由此表明,覆盖在小球表面的物质为微嗜酸寡养单胞菌体,通过固定化作用将菌株随机限定在载体上,可保持良好的分散状态[17]。
降解前后固定化菌球的能谱分析如图8所示。对比可知,降解后小球出现N和P元素特征峰,C和O等元素特征峰加强、含量增多,其中O元素特征峰明显升高,说明固定后的菌株保持活性,在外加营养源的作用下生长。降解后小球的Fe和Cl等元素含量相对减少,Na元素含量增多,这表明小球投加后与脱色培养基进行反应,通过孔径进行传质作用,染料可以扩散到小球内部,有利于对颜料红23进行脱色。

(a) 降解前

(b) 降解后图8 降解前后固定化菌球能谱分析
Fig.8EDSanalysisoftheimmobilizedpelletbefore/afterdegradation
3 结 论
(1) 本文分离培养的微嗜酸寡养单胞菌为高效脱色菌株,在35 ℃和120 r/min环境下培养18 h后对颜料红23的脱色率达90%以上。经紫外可见分光光度计扫描脱色代谢产物可知,该菌株对颜料红23的生物脱色方式以生物降解为主。
(2) 以质量分数为1.5%的SA溶液为固定化载体,质量分数为5%的FeCl3溶液为交联剂,接种体积分数4%的菌悬液制成固定化菌球,菌体在小球表面稳定分散,具有较高的微生物活性。
(3) 菌球投加后,比表面积减小,孔径增大,18 h后对颜料红23的脱色率在89%左右。脱色过程中无恶臭产生,分离回收简单,对微生物固定化技术处理印染废水有一定的现实意义。
