不同藤椒商品风味成分的分析研究
2019-01-16祝磊陈茜黎江华彭伟钟慈平余凌英吴纯洁
祝磊,陈茜,黎江华,彭伟,钟慈平,余凌英*,吴纯洁*
(1.成都中医药大学 药学院,成都 611137;2.四川省食品药品检验检测院,成都 610097)
藤椒来源于芸香科花椒属植物竹叶花椒(ZanthoxylumarmatumDC.)的近成熟果实,为一种特色的药食两用之品,具有独特的麻香风味。竹叶花椒植物在全国各地分布广泛,尤以西南地区种植广泛,但各地对其称谓有所不同,如四川大部分地区(乐山、眉山、绵阳、雅安、成都等)因其枝叶披散,延长状若藤蔓,称其为藤椒;而四川金阳、平昌,云南鲁甸、昭通,重庆江津等地则称其为青花椒[1]。近年来,藤椒以其独特的清香麻鲜味和翠绿的色泽在川菜中掀起一阵鲜麻的风潮——藤椒味,促使川菜的“麻”味呈现出崭新的风貌[2]。地方政府也在农业结构调整、新一轮退耕还林及脱贫攻坚、乡村振兴政策实施过程中对藤椒产业的大力支持,极大地促进了川渝地区藤椒种植业的迅猛发展,其种植面积和产量均得以迅速增加[3]。以四川为例,全省花椒栽培面积达29.33万公顷,其中以竹叶花椒(ZanthoxylumarmatumDC.)为代表的藤椒(青花椒)种植面积已达20.89万公顷,占总栽培面积的71.22%,其产量和面积均为全国第一,并逐步形成了以四川洪雅、峨眉山、三台、金阳、平昌等为代表的全国闻名藤椒(青花椒)基地,洪雅更是被誉以“中国藤椒之乡”的称号[4]。
目前,藤椒作为食品主要以鲜藤椒、保鲜藤椒及其加工品(藤椒油)为主,鲜品容易发生褐变和霉变,为了便于长期贮存,部分晒干或烘干后作为干藤椒(青花椒)使用。藤椒以其“麻、香”为主要的风味特征,且风味物质也是其主要的活性成分[5]。现有研究报道藤椒商品中香味物质主要为烯类、醇类、酮类、醛类、酯类等挥发性成分,并具有抑菌、杀虫、镇痛、抗炎等作用[6-10];而麻味物质主要是一类链状不饱和脂肪酸酰胺类物质,以山椒素类为代表成分(如羟基-α-山椒素、羟基-β-山椒素等),具有强烈的麻刺感[11,12],并具有麻醉、镇痛、驱虫、调节糖脂代谢紊乱、保护胃肠道等生物活性[13-16]。藤椒的开发利用已成为目前研究的重点,但主要集中在藤椒种植及其加工品藤椒油上,而对其品质仍未见有统一的客观化指标,以感官评价为主[17,18],且对不同藤椒商品风味成分的对比分析研究较少。因此,本文采用HS-SPME-GC-MS和HPLC技术分别对不同藤椒商品(含鲜藤椒、保鲜藤椒、干藤椒及褐变藤椒)的香味物质和麻味物质进行定性、定量分析,以期为藤椒商品的生产加工、开发利用、质量标准及品质评价提供参考,并为四川花椒产业的发展提供理论依据。
1 仪器与材料
1.1 材料与试剂
鲜藤椒、保鲜藤椒、干藤椒、褐变藤椒皆由四川洪雅茂源藤椒种植场提供,藤椒种子由鲜藤椒于40 ℃下干燥与果皮分离获得。
羟基-α-山椒素对照品、羟基-β-山椒素对照品(自制,纯度均大于98%);分析纯甲醇:成都科龙试剂厂;色谱纯甲醇、色谱纯乙腈:美国Sigma-Aldrich公司;水为超纯水。
1.2 仪器与设备
岛津GC-MS-TQ8040气相色谱-质谱联用仪、GC-MS Solution色谱工作站软件、Aoc-6000顶空进样器、岛津LC-2010A高效液相色谱仪(含SIL-20A自动进样器、SPD-20A检测器、CTO-20A柱温箱、LC Solution色谱工作站软件) 日本岛津公司;HP-1510气相色谱顶空加热器 上海济成分析仪器有限公司;固相微萃取装置、萃取头(100 μm PDMS) 美国Supelco公司;Sartorius BP211D电子天平 德国赛多利斯公司;HX-200型高速中药粉碎机 浙江省永康市溪岸五金药具厂;Auto Science AS5150A超声波清洗器 天津奥特赛恩斯仪器有限公司;电热鼓风恒温干燥箱 成都天宇试验设备有限责任公司;ZDHW调温电热套 北京中兴伟业仪器有限公司;UPT-11-10T优普系列超纯水器 成都超纯科技有限公司。
2 方法与结果
2.1 藤椒折干率的计算
随机选取鲜藤椒、保鲜藤椒、褐变藤椒、干藤椒100粒,用电子天平称量,重复3次,取平均值。计算鲜藤椒、保鲜藤椒、褐变藤椒及干藤椒的折干率,结果见表1。

表1 不同藤椒商品折干率及挥发油测定结果
2.2 香味物质分析
2.2.1 挥发油含量测定
称取20 g干藤椒,其余藤椒样品按表1折干率计算结果称取相应重量的鲜藤椒、保鲜藤椒、褐变藤椒。按照《中国药典》2015年版中挥发油测定法甲法[19]:将称量好的样品分别置于圆底烧瓶中,加入15倍量的水与碎瓷片,振荡混匀,连接好挥发油测定器与冷凝管,自冷凝管上端加水使充满挥发油测定器的刻度部分,用电热套缓缓加热至沸腾,并保持微沸提取5 h,停止加热,冷却至室温,读取藤椒挥发油体积,测定结果见表1。
2.2.2 香味物质定性分析[20]
2.2.2.1 样品的萃取与吸附
随机选取鲜藤椒、保鲜藤椒、褐变藤椒、干藤椒各15粒分别装入萃取瓶中,在50 ℃下萃取30 min,插入活化的萃取头(230 ℃活化3 min),样品提取10 min,最后将萃取头插入气相色谱仪进样口(230 ℃)脱附3 min。
2.2.2.2 气相色谱-质谱条件
采用Agilent DB-17MS(30 m×0.25 mm×0.25 μm)气相色谱柱,初始温度为50 ℃,保持2 min,以4 ℃/min程序升温至200 ℃,保持5 min,再以15 ℃/min程序升温至240 ℃,保持5 min(升温程序);载气为He,压力为68.1 kPa,分流比为35∶1。进样口和接口温度为240 ℃,电离方式为EI,电子能量为70 eV,扫描范围(m/z)为50~550,采集方式为全扫描模式。
2.2.2.3 定性分析结果
鲜藤椒、保鲜藤椒、褐变藤椒、干藤椒香味物质总离子流图见图1。样品中各未知挥发性成分的定性由质谱仪所带数据包(Wiley Library ver.9、NIST Library ver.14和NIST Library ver. 14s)进行计算机自动检索与匹配,统计匹配度大于90的挥发性成分。挥发性成分的定量分析采用峰面积归一化法,GC-MS分析结果见表2。



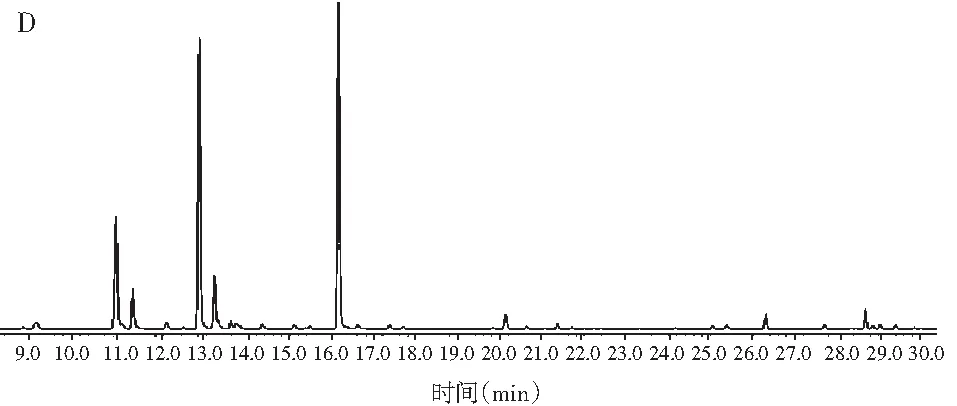
图1 鲜藤椒(A)、保鲜藤椒(B)、干藤椒(C)及褐变藤椒(D)香味物质总离子流图

峰号保留时间(min)化合物相对质量分数(%)鲜藤椒保鲜藤椒干藤椒褐变藤椒18.8553-侧柏烯0.110.20.190.1929.160α-蒎烯0.720.91.170.99311.053桧烯10.8616.1313.7415.7411.202β-蒎烯0.60.760.630.82511.454β-月桂烯1.773.684.323.48612.250α-水芹烯0.250.370.750.36712.664α-萜品烯-0.10.14-813.035柠檬烯21.2728.8630.131.48913.398β-水芹烯2.913.875.893.88

续 表
注:“-”表示未检出。
2.3 麻味物质分析
2.3.1 色谱条件
CAPCELL PAK C18柱(250 mm×4.6 mm,5 μm;MGII),流动相:乙腈-水(40∶60),柱温30 ℃,流速1.0 mL/min,检测波长270 nm,进样量5 μL。羟基-α-山椒素对照品、羟基-β-山椒素对照品、藤椒及种子的色谱图见图2。




图2 羟基-α-山椒素对照品(E)、羟基-β-山椒素对照品(F)、藤椒(G)及种子(H) 的色谱
注:1为羟基-α-山椒素;2为羟基-β-山椒素。
2.3.2 样品前处理
随机选取鲜藤椒、保鲜藤椒、褐变藤椒各30粒分别放入3个不同研钵中,加入适量甲醇混合研磨,将研磨粉碎后的甲醇溶液与残渣倒入50 mL容量瓶中,加甲醇至刻度;随机选取藤椒种子和干藤椒各30粒分别放于冲钵中粉碎,将粉碎后的种子粉末与干藤椒粉末分别倒入50 mL容量瓶中,加甲醇至刻度;超声提取30 min,冷却至室温,用甲醇定容至刻度线,摇匀,用0.45 μm的微孔滤膜过滤,取续滤液,即得。
2.3.3 方法学考察
2.3.3.1 线性关系考察
分别取羟基-α-山椒素、羟基-β-山椒素对照品适量,精密称定,加甲醇溶解并稀释至刻度,精密配制成质量浓度分别为羟基-α-山椒素1300 μg/mL、羟基-β-山椒素120 μg/mL的对照品储备液。取各对照品储备液逐级稀释,精密配制不同质量浓度的标准溶液。按2.3.1项下条件进样测定,重复3次,分别以峰面积为纵坐标(Y)、质量浓度(μg/mL)为横坐标(X)进行线性回归,结果表明各麻味成分在各自范围内与峰面积呈良好的线性关系,其回归方程见表3。

表3 回归方程、线性范围及相关系数
2.3.3.2 精密度试验
精密吸取5 μL干藤椒供试品溶液,按2.3.1项下条件进样分析,连续进样6次,测定峰面积,结果各成分峰面积的RSD分别是羟基-α-山椒素0.56%、羟基-β-山椒素0.27%,表明仪器精密度良好。
2.3.3.3 稳定性试验
精密吸取同一干藤椒供试品溶液,按照2.3.1项下色谱条件,分别于0,4,8,12,18,24 h进样测定,测得各成分峰面积的RSD分别是羟基-α-山椒素1.21%、羟基-β-山椒素0.86%,表明提取液在24 h内基本稳定。
2.3.3.4 重复性试验
取同一干藤椒30粒,按2.3.2项下方法制备6份供试品溶液,按照2.3.1项下色谱条件进行测定分析,结果各成分质量分数的RSD分别为羟基-α-山椒素0.77%、羟基-β-山椒素0.61%。
2.3.3.5 加样回收试验
称取同一干藤椒15粒,按2.3.2项下方法制备6份供试品溶液于容量瓶中,分别精密加入羟基-α-山椒素、羟基-β-山椒素对照品溶液适量,再用甲醇定容,按照2.3.1项下色谱条件进行测定分析,计算各成分的平均加样回收率及RSD值。结果表明:羟基-α-山椒素、羟基-β-山椒素平均加样回收率分别为103.21%,101.12%,RSD值分别为2.41%,1.27%。
2.3.4 含量测定
取各藤椒样品30粒,按2.3.1项下方法制备供试品溶液,在2.3.2项色谱条件下测定峰面积。根据分析与计算,求得羟基-α-山椒素、羟基-β-山椒素含量,结果见表4。

表4 不同藤椒商品麻味物质含量测定结果(n=3)
注:“—”表示未检出。
3 讨论与结论
鲜藤椒色泽鲜绿,香麻味浓,采摘及运输时果皮表面油胞的破裂、干燥贮存的不及时易造成严重的褐变,且油胞的破裂会引起油胞中挥发油以及麻味物质的溢出,造成藤椒“色、香、味”品质的全面下降,使藤椒的经济价值直线下跌。目前研究表明藤椒褐变机理可能是叶绿素通过酶降解途径造成多酚类物质的氧化生成黑色素及叶绿素降解生成脱镁叶绿素等有关[21]。为了保持鲜藤椒的色、香、味、品质,常通过晒干或恒温干燥制作成干藤椒保存,或是通过高温“杀青”将相关酶灭活,真空包装制成保鲜藤椒冷冻保存。本文对鲜藤椒及其变质品褐变藤椒、加工品干藤椒、保鲜藤椒的香味物质和麻味物质进行了定性和定量分析,探索其质量差异。
采用挥发油测定法测定各藤椒商品的香味物质总含量,由表1可知,经统一折算为相同粒数的藤椒,鲜藤椒挥发油量最高达到2.15 mL,而在鲜藤椒处理不当发生褐变时其挥发油含量显著下降至0.90 mL,而保鲜藤椒、干藤椒的挥发油含量分别下降至1.80,1.55 mL,这可能是鲜藤椒香味最为浓烈的原因之一;再采用HS-SPME-GC-MS技术直接分析不同藤椒商品的香味成分,此方法具有简便、快速、高效并能最大保持藤椒原有香味成分的特点[22,23],共分离鉴定出42种化合物,主要为烯烃类、醇类化合物。由表2可知,各藤椒商品主要成分基本一致,主要为芳樟醇、柠檬烯、桧烯、β-水芹烯等,占总香味成分的80%以上,其中以芳樟醇含量最高。鲜藤椒香味物质最为丰富,达35种,保鲜藤椒香味物质相对最少,只有32种,可能是在漂烫以及冷冻过程中部分物质有所损失造成,损失成分有侧柏酮、4-萜烯醇、β-榄香烯。鲜藤椒独有成分为胡椒酮和δ-杜松烯,以新鲜保存方式的鲜藤椒和保鲜藤椒的共同特有成分为草蒿脑、桃金娘烯醛,这可能是新鲜藤椒与干藤椒香气有所差异的原因之一。鲜藤椒在褐变过程中产生了氧化芳樟醇、氧化石竹烯、乙酸香叶酯、薄荷脑、伞花烃等产物,并在此过程中损失了β-罗勒烯、4-萜品烯乙酸酯、γ-杜松烯,这可能是褐变藤椒与鲜藤椒香味差异较大的原因之一。
采用HPLC法测定不同藤椒商品的麻味物质,因鲜藤椒、保鲜藤椒及褐变藤椒均含有藤椒种子,为避免藤椒种子中麻味物质对测定结果的干扰,因此同时测定了其藤椒种子中的麻味物质。由图2和表4可知,藤椒种子中并无麻味物质。含量测定结果表明,鲜藤椒麻味物质含量最高,总量达到63.55 mg,褐变藤椒最低,总量仅有15.22 mg,不及鲜藤椒麻味物质总量的1/4,而保鲜藤椒和干藤椒相对来说麻味物质含量损失较少,分别为52.71,45.93 mg。不同藤椒商品中都含有羟基-α-山椒素、羟基-β-山椒素,其中以羟基-α-山椒素含量最高,其含量是羟基-β-山椒素含量的15倍以上。
综上可以看出,无论是在麻味物质分析还是在香味物质分析中,均为鲜藤椒风味最佳,保鲜藤椒次之,干藤椒再次之,褐变藤椒最差。本研究分析了鲜藤椒、保鲜藤椒、褐变藤椒及干藤椒的香味物质和麻味物质,可为不同藤椒商品的“香、麻”评价提供一个客观参考,同时也为藤椒的生产加工、开发利用、质量标准及品质评价提供了借鉴,并为四川花椒产业的发展提供了理论依据。
