花椒羟基-α-山椒素在紫外照射下的降解动力学及其转化机理研究
2017-11-16严雅丽刘福权赵志峰谷学权
严雅丽 - 刘福权 - 赵志峰 - 谷学权 - 幸 勇
(1. 四川大学轻纺与食品学院,四川 成都 610065;2. 四川五丰黎红食品有限公司,四川 雅安 625302) (1. College of Light Industry, Textile and Food Engineering, Sichuan University, Chengdu, Sichuan 610065, China; 2. Sichuan Wufeng Lihong Food Co., Ltd., Ya’an, Sichuan 625302, China)
花椒羟基-α-山椒素在紫外照射下的降解动力学及其转化机理研究
严雅丽1YANYa-li1刘福权1LIUFu-quan1赵志峰1ZHAOZhi-feng1谷学权2GUXue-quan2幸 勇2XINGYong2
(1. 四川大学轻纺与食品学院,四川 成都 610065;2. 四川五丰黎红食品有限公司,四川 雅安 625302) (1.CollegeofLightIndustry,TextileandFoodEngineering,SichuanUniversity,Chengdu,Sichuan610065,China; 2.SichuanWufengLihongFoodCo.,Ltd.,Ya’an,Sichuan625302,China)
为了研究花椒中典型酰胺类物质羟基-α-山椒素在紫外照射下的变化趋势及转化方向,从花椒油中提取、分离、纯化得到羟基-α-山椒素,对其进行紫外照射处理,利用HPLC法测定不同照射时间各物质的含量。结果表明,羟基-α-山椒素在紫外照射下迅速减少,8 h后减少了95.9%,浓度与时间满足一级反应速率方程C=490.68e-0.346 9t,且转化为其同分异构体羟基-ε-山椒素,使羟基-ε-山椒素含量在3 h后升高至初始含量的8.56倍,而羟基-β-山椒素在照射过程中持续减少,说明紫外照射对花椒及其制品的麻味有很大的影响。
花椒;酰胺类物质;紫外照射;同分异构体转化;动力学模拟
花椒(Zanthoxylumbungeanum)系芸香科花椒属植物,被誉为“八大调味品”之一[1],是家庭常用的烹饪调料和中药配料。花椒的麻味主要来源于花椒中的酰胺类物质,不同的酰胺类物质的阈值、人体感觉及味觉强度有差异[2],且其含量与种类是花椒质量等级分类的重要因素[3]。花椒中酰胺类物质含量与种类的变化将引起其麻味的变化,而该变化与酰胺类物质在不同条件下的稳定性有关。花椒酰胺类物质在常温光照下不稳定,很容易发生化学变化,紫外可加速其变化[4]。
近年来,有关花椒中典型酰胺类物质的研究成为热点,但大多关注于物质本身的鉴定与生理活性[5-7],少数研究涉及了花椒中酰胺类物质贮藏稳定性,而对其保藏过程中酰胺类物质转化的研究还鲜有报道。Yang[8]发现羟基-α-山椒素水溶液在22~24 ℃中保存4周,降解了50%;当暴露在紫外光下时,80%乙醇溶液中的羟基-α-山椒素4 h完全消失。Ichiro等[9]将羟基-α-山椒素在碘催化下进行紫外照射,制备出了羟基-β-山椒素,说明羟基-α-山椒素在一定条件下可以进行同分异构体的转化,但未关注其变化过程,无法了解反应的方向与速率。本试验以花椒中典型的酰胺类物质羟基-α-山椒素为对象,研究其在紫外照射下的稳定性、模拟降解动力学方程,并测定羟基-β-山椒素与羟基-ε-山椒素的含量变化,分析同分异构体之间的相互转化,进而初步推测羟基-α-山椒素在紫外照射下的转化机理,为研究花椒及其制品在贮藏过程中的麻味变化提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
花椒油:四川成都建华食品有限公司;
甲醇、碱性氧化铝、乙腈、正己烷、无水乙醇:分析纯,成都科龙试剂厂。
1.1.2 仪器与设备
恒温振荡器:THZ-98AB型,上海一恒科学仪器有限公司;
旋转蒸发仪:RE52-99型,上海亚荣生化仪器厂;
低速离心机:TDZ5-WS型,长沙湘智离心机仪器有限公司;
循环水式真空泵:SHZ-D型,上海道京仪器有限公司;
超声机:KH2200B型,昆山禾创超声仪器有限公司;
紫外灯:ZW40Z20W型,杭州亚光照明灯饰有限公司;
高效液相色谱仪:LC-6AD型,日本岛津公司。
1.2 试验方法
1.2.1 酰胺类物质的提取、分离纯化与检测
(1) 酰胺类物质的提取:参考文献[10]的方法,称取花椒油15 g,置于500 mL试剂瓶中,加入225 mL甲醇,于恒温振荡器中水浴震荡提取(40 ℃,2 h,160 r/min),超声5 min。混合液经过离心(4 000 r/min,10 min)后取上清液,用2倍体积的正己烷进行萃取除杂,下层清液过碱性氧化铝层析柱除去多酚,所得层析液减压蒸干并计重,所得样品即为酰胺类物质提取物。
(2) 酰胺类物质的分离纯化:取一定量的粗提物用色谱级甲醇溶解后过0.22 μm滤膜,在ODS柱(F29 mm×153 mm,ODS规格50 μm 120A)中洗脱,每50 mL收集洗脱液,得到含羟基-α-山椒素及其同分异构体的洗脱液。
(3) 酰胺类物质的定量检测:取一定量的洗脱液用色谱级甲醇溶解后过0.22 μm滤膜,用高效液相色谱仪进行测定,色谱条件:MN Nucleodur 1100-5 C18柱;流动相A:水;流动相B:乙腈;流速:0.5 mL/min;柱温:30 ℃;紫外检测波长:270 nm;进样量:20 μL。洗脱程序见表1。

表1 HPLC洗脱程序Table 1 HPLC elution procedure
以各浓度的羟基-α-山椒素标准品在270 nm下吸收峰面积(mAU·min)为纵坐标,浓度(μg/mL)为横坐标,绘制标准曲线,得到线型回归方程:y=198 648x,R2=0.998,样品在60~750 μg/mL时呈较好的线性相关性,因此本试验可用峰面积表征物质的含量。
1.2.2 紫外连续照射处理
(1) 照射样品制备:将上述步骤得到的羟基-α-山椒素及其同分异构体洗脱液(80%甲醇溶液)蒸干,用适量乙醇完全溶解,得到100%乙醇溶剂的羟基-α-山椒素溶液。
(2) 紫外照射处理:将羟基-α-山椒素及其同分异构体的乙醇溶液置于透明石英试剂瓶中,试剂瓶置于距离紫外灯15 cm处,紫外灯功率40 W,对样品进行连续照射,并分别在0,1,2,3,4,5,6,7,8 h时从试剂瓶中取样,蒸干,并用甲醇溶解,进行HPLC检测。
2 结果与分析
2.1 酰胺类物质检测结果
0 h的羟基-α-山椒素乙醇溶液的液相色谱图见图1。前期研究[11]中,课题组已经利用液相色谱—质谱联用仪对花椒的酰胺类物质进行了分析,根据出峰时间、最大吸收峰和质荷比,对比参考文献[11]可知图1中的1、2、3号峰分别为羟基-ε-山椒素、羟基-α-山椒素、羟基-β-山椒素,其相对分子量均为263,互为同分异构体。各物质峰面积及纯度见表2。依次检测0~8 h时的样品,得到酰胺类物质的峰面积与纯度。
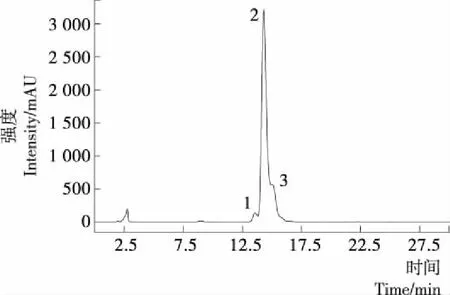
图1 羟基-α-山椒素紫外照射前(0 h时)的HPLC图谱Figure 1 HPLC chromatogram of hydroxy-α-sanshool before UV radiation(0 hour)表2 0 h时3种山椒素的峰面积与纯度Table 2 The peak area and purity of three sanshools
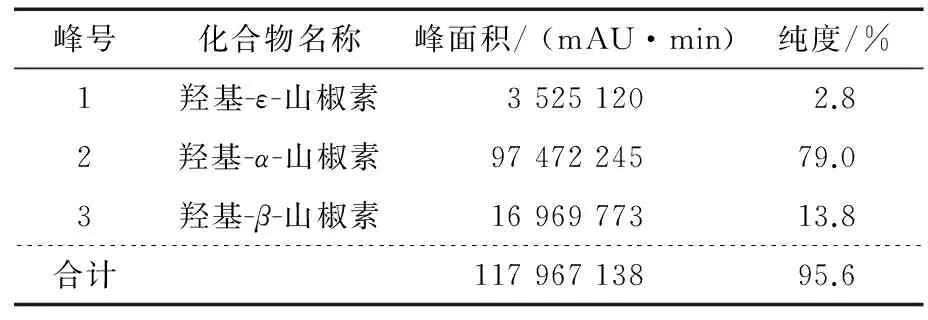
峰号化合物名称峰面积/(mAU·min)纯度/%1羟基-ε-山椒素35251202.82羟基-α-山椒素9747224579.03羟基-β-山椒素1696977313.8合计11796713895.6
紫外照射8 h后的羟基-α-山椒素乙醇溶液的液相色谱图见图2。由图2可知,经过8 h的紫外照射,样品中的3种山椒素峰高大幅降低,含量明显减少,且各物质变化规律不一致,说明3种物质在紫外照射过程中发生了不同程度的变化。
2.2 酰胺类物质在紫外照射下的变化
2.2.1 羟基-α-山椒素在紫外照射下的变化 由图3可知,在紫外照射下,羟基-α-山椒素持续减少,在0~2 h时,减少速率较快,2 h时已减少56.8%;当紫外照射8 h时共减少了95.9%。在羟基-α-山椒素含量减少的同时,其纯度也在降低,但两者趋势并不完全相同。

图2 羟基-α-山椒素紫外照射8 h后的HPLC图谱Figure 2 HPLC chromatogram of hydroxy-α-sanshool after 8 hours UV radiation

图3 羟基-α-山椒素在紫外照射下含量与纯度变化Figure 3 Changes in the content and purity of hydroxy-α- sanshool under UV radiation
对羟基-α-山椒素含量与照射时间作散点图,并根据一级反应速率方程进行拟合,得到图4所示趋势线。该模拟方程式为S=S0e-0.346 9t,S0=97 472 245,R2=0.987,拟合度较好。用标准曲线换算后得到反应速率方程C=490.68e-0.346 9t,其中C表示某时刻样品中羟基-α-山椒素的浓度(μg/mL),t表示照射时间(h)。由此方程可推测出在紫外连续照射的不同时刻羟基-α-山椒素的含量及降低速率。
2.2.2 羟基-ε-山椒素在紫外照射下的变化 由图5可知,在紫外照射1 h时,羟基-ε-山椒素含量迅速增加,并在1~3 h时持续缓慢升高,3 h时达到初始含量的8.56倍。照射4 h时羟基-ε-山椒素含量开始降低,在4~5 h和6~7 h时降低明显,8 h时含量仅为初始含量的1.54倍。羟基-ε-山椒素初始纯度含量较低,仅有2.86%,但在紫外照射2 h后,其纯度可达到30%以上,并且在后续照射中其含量不断降低,其纯度变化依然不大。
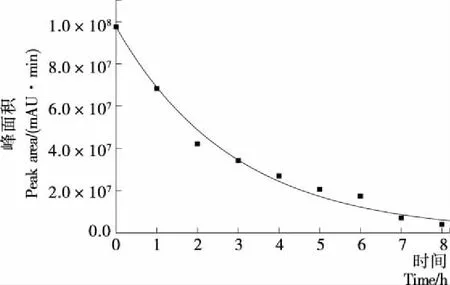
图4 羟基-α-山椒素在紫外照射下的变化拟合曲线Figure 4 Fitted curve of changes in the content of hydroxy-α-sanshool under UV radiation

图5 羟基-ε-山椒素在紫外照射下的含量与纯度变化Figure 5 Changes in the content and purity of hydroxy- ε-sanshool under UV radiation
2.2.3 羟基-β-山椒素在紫外照射下的变化 由图6可知,羟基-β-山椒素在紫外照射过程中,其含量呈下降趋势,在3 h附近有少量升高,但总体呈下降趋势。紫外照射5 h时,羟基-β-山椒素含量已降低为初始的50.7%,8 h后仅剩9.3%。
2.2.4 3种山椒素及其总量的变化 由图7可知,在紫外连续照射下,3种同分异构体总量不断降低,8 h后仅为初始含量的9.3%。其中,羟基-α-山椒素含量最高,在紫外下,其含量不断降低,而羟基-ε-山椒素初始含量最低,在前3 h照射中含量相应增高。4 h后,羟基-α-山椒素和羟基-ε-山椒素含量差异逐渐变小,并在之后的照射中呈相似的下降趋势。羟基-β-山椒素含量处于前两者之间,在紫外照射后不断下降,并且1 h后处于三者最低水平。

图6 羟基-β-山椒素在紫外照射下的含量与纯度变化
Figure 6 Changes in the content and purity of hydroxy-β-sanshool under UV radiation

图7 3种山椒素与总含量的变化Figure 7 Changes in the content of three sanshools and their sum
通过检测不同紫外照射时间下的羟基-α-山椒素、羟基-ε-山椒素和羟基-β-山椒素的含量与纯度变化可知,三者在紫外照射下很不稳定,容易发生反应从而使含量发生变化。根据试验结果推测反应可能分为2种:① 紫外照射使物质降解,导致其含量不断降低;② 紫外光使物质之间进行了同分异构体转化,从而使得羟基-ε-山椒素出现增加。总的来说,各物质最终都呈现出减少的趋势,与Yang[8]试验中80%乙醇溶液中的羟基-α-山椒素在紫外照射4 h后完全消失的结果相似。推测原因可能是这3种山椒素都拥有共轭三烯结构,此处电子云密度较高,在紫外光的照射下激发出电子,发生氧化或裂解反应。而在照射的前3 h,羟基-α-山椒素快速减少的同时羟基-ε-山椒素迅速增多,可能是紫外照射下,羟基-α-山椒素的一个反式双键吸收能量变成了顺式结构,从而得到了羟基-ε-山椒素。初始时样品中羟基-α-山椒素浓度较高,因此不断向羟基-ε-山椒素转化,当二者含量大致相等时,两者之间的转化达到动态平衡,同时呈相似的被紫外破坏趋势。Ichiro等[9]用100 mL苯溶500 mg羟基-α-山椒素在碘催化下被汞灯照射1 h,得到120 mg羟基-β-山椒素,而本试验由羟基-α-山椒素得到的是羟基-ε-山椒素,且羟基-β-山椒素含量持续降低,可能是前者用碘作为催化剂,使转化反应向羟基-β-山椒素方向进行。
3 结论
本研究对羟基-α-山椒素进行了8 h连续紫外照射,结果表明羟基-α-山椒素在紫外照射下迅速被破坏,2 h后减少50%以上,8 h后基本完全消失,并且转化为羟基-ε-山椒素使其在3 h内达到原含量的8倍以上,这对花椒及其制品的麻味有很大的影响。为了更加科学地了解紫外对山椒素的影响,需进行进一步的产物分析和同分异构体转化试验。
[1] MIZUTANI K, FUKUNAGA Y, TANAKA O, et al. Amides from Huajiao, pericarps ofZanthoxylumbungeanumMaxim[J]. Chemical and Pharmaceutical Bulletin, 1988, 36(7): 2 362-2 365.
[2] BADER M, STARK T D, DAWID C, et al. All-trans-Configuration inZanthoxylumAlkylamides swaps the tingling with a numbing sensation and diminishes salivation[J]. Journal of Agricultural and Food Chemistry, 2014, 62(12): 2 479-2 488.
[3] 朱琳, 余小琴, 阚建全. 花椒质量等级新要素探讨与分析[J]. 食品与机械, 2009, 25(2): 162-166.
[4] 宋莹莹. 花椒贮藏过程中酰胺类物质含量降低机理的初步研究[D]. 重庆: 西南大学, 2014: 15-28.
[5] KOO Jae Yeon, JANG Yongwoo, CHO Hawon, et al. Hydroxy-α-sanshool activates TRPV1 and TRPA1 in sensory neurons[J]. European Journal of Neuroscience, 2007, 26: 1 139-1 147.
[6] KRISHNA P Devkota, JENNIFER Wilson, et al. Isobutylhydroxyamides from the pericarp of NepaleseZanthoxylumarmatuminhibit NF1-defective tumor cell line growth[J]. Journal of Natural Products, 2013, 76: 59-63.
[7] HUANG Shuai, ZHAO Lei, ZHOU Xian-li, et al. New alkylamides from pericarps ofZanthoxylumbungeanum[J]. Chinese Chemical Letters, 2012, 23(11): 1 247-1 250.
[8] YANG Xiao-gen. Aroma constituents and alkylamides of red and green Huajiao (ZanthoxylumbungeanumandZanthoxylumschinifolium)[J]. Journal of Agricultural and Food Chemistry, 2008, 56(5): 1 689-1 696.
[9] ICHIRO Yasuda, KOICHI Takeya, HIDEGI Itokawa. Distribution of unsaturated aliphatic acid amides in JapaneseZanthoxylumspecies[J]. Phytochemistry, 1982, 21(6): 1 295-1 298.
[10] 赵志峰, 祝瑞雪, 高鸿, 等. 鲜花椒油和干花椒油酰胺类物质对比研究[J]. 中国调味品, 2014, 39(4): 33-36.
[11] ZHAO Zhi-feng, ZHU Rui-xue, ZHONG Kai, et al. Characterization and comparison of the pungent components in commercialZanthoxylumbungeanumoil andZanthoxylumschinifoliumoil[J]. Journal of Food Science, 2013, 78(10): 1 516-1 522.
Degradationkineticsandtransformationmechanismresearchofhydroxy-α-
sanshoolfromZanthoxylumbungeanumexposedtoUVradiation
To study the variation trend of hydroxy-α-sanshool fromZanthoxylumbungeanumexposed to UV radiation and its transformation direction, the hydroxy-α-sanshool, a typical alkylamides ofZanthoxylumbungeanum, was extracted, separated and purified fromZanthoxylumoil and exposed to UV radiation. The alkylamides content was detected by using HPLC after different hours of radiation. The results indicated that hydroxy-α-sanshool under UV radiation decreased rapidly by 95.9% in 8 hours. Furthermore, the concentration and time obeyed the first order reaction rate equationC=490.68e-0.346 9t, meanwhile it transformed into hydroxy-ε-sanshool, which was 8.56 times of its initial content after 3 hours. Moreover, another isomer hydroxy-β-sanshool kept deceasing under UV radiation,which indicated that UV radiation made a big difference on the numb-taste ofZanthoxylumbungeanumand its products.
Zanthoxylumbungeanum; alkylamides; UV radiation; isomers transformation; kinetic simulation
国家自然科学基金项目(编号:21502128);成都市产业集群协同创新重大项目(编号:2016-XT00-00031-NC)
严雅丽,女,四川大学在读本科生。
赵志峰(1980—),男,四川大学副教授,博士。
E-mail: zhaozhifeng@scu.edu.cn
2017—08—08
10.13652/j.issn.1003-5788.2017.09.006
