藤黄酸纳米脂质体的制备与优化
2019-01-14武恒仪潘娅杨佳
武恒仪 潘娅 杨佳


摘 要:以磷脂酰胆碱(phosphatidylcholine,PC)作为主要膜材,对三种藤黄酸纳米脂质体制备方法进行了筛选;对磷脂浓度、磷胆比、药脂比、水合介质体积等影响因素实施了筛选,采用正交设计实验对工艺重现性进行了优化考察。结果表明:薄膜分散-超声法为优选方法。优选工艺处方为:磷脂浓度10 mg/mL,磷胆比为3∶1,药脂比为1∶10,水相体积20 mL,此工艺制备的藤黄酸的纳米脂质体,粒径优,包裹率高,质量稳定,可作为藤黄酸的一种新型纳米制剂。
关 键 词:藤黄酸;脂质体;薄膜分散超声法;正交试验设计
中图分类号:R94 文献标识码: A 文章编号: 1671-0460(2019)12-2785-04
Abstract: The phosphatidylcholine (PC) was used as the main membrane forming material and three preparation methods of liposomes were optimized to encapsulate gambogic acid (GA), the active substance of a traditional Chinese medicine. Parameters, such as concentration of PC, amount of cholesterol (Chol), ratio of GA to membrane material and volume of aqueous phase were optimized by orthogonal experimental design and reproducibility analysis. The results indicated that the film rehydration was the suitable preparation method. When the concentration of PC was 10 mg/mL, PC∶Chol = 3∶1, the ratio of drug to liquid was 1∶10 and the volume of hydration phase was 20 mL, the highest encapsulation efficiency of GA was obtained. Therefore, the GA liposome can be applied as a novel nanomedicine with promising encapsulation efficiency, enhanced stability and better properties.
Key words: Gambogic acid; Liposome; Ultrasound film rehydration; Orthogonal design
現代研究证明,藤黄中所含有的以藤黄酸(gambogic acid),新藤黄酸(neo-gambogic acid)等为代表的酸性黄酮类化合物被认为是藤黄的主要活性物质[1],具有广谱抗癌作用,对多种肿瘤细胞包括宫颈癌,胆管癌,肝癌,乳腺癌,胃癌,膀胱癌,胶质母细胞瘤和骨肉瘤细胞等有显著的抑杀作用[2-4]。研究还表明,藤黄酸、新藤黄酸活性物质的抗肿瘤机制与常用化疗药物相比有独特的优势,不仅可靶向杀死肿瘤细胞而不伤害正常细胞,并且对造血系统和免疫功能无明显影响[5,6]。然而由于藤黄酸的不稳定性与水溶性差,传统剂型诸如注射液或硼酸水溶液的血浆半衰期极短,这使得其抗癌作用与生物利用度受到了极大的限制。脂质体作为一种新型纳米载药系统,具有包裹溶质并选择性释放内容物的能力,与抗肿瘤药效团相搭载,可以减少传统化疗的耐药性并增强靶向性,避免体内免疫系统的排异清理,增强作用时效[7,8]。开发藤黄酸纳米脂质体制剂,克服藤黄酸的缺点,改善藤黄酸活性物质的稳定性,具有切实的实际意义。
本文以磷脂酰胆碱(phosphatidylcholine,PC)作为主要膜材,对不同藤黄酸纳米脂质体制备方法进行筛选;对药脂比、水合介质体积以及胆固醇与卵磷脂的质量比等进行单因素和正交设计实验,并对优选的工艺进行重现性考察,以探索藤黄酸纳米脂质体制备方法。
1 实验部分
1.1 仪器
RE-52AA旋转蒸发器(上海亚荣生化仪器厂);DF-101S 集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);FA2004B电子天平(上海佑科仪器仪表有限公司);PHS-25 pH计(上海盛磁仪器);UV-2450紫外分光光度计(岛津企业管理(中国)有限公司);安捷伦1260Infinity II 液相色谱系统;ZS Nano S马尔文粒度仪(英国Malvern仪器有限公司);KQ3200B型超声波清洗器(昆山市超声仪器有限公司)。
1.2 材料
大豆卵磷脂(上海源聚生物科技有限公司),胆固醇(上海伯奥生物科技有限公司),藤黄酸标准品(中国食品药品检定研究所,纯度97%)。藤黄酸提取物(自制),大豆卵磷脂(上海源聚生物科技有限公司),PEG 4000,胆固醇(上海伯奥生物科技有限公司),磷酸二氢钠(分析纯),磷酸氢二钠(分析纯)(广州化学试剂厂),甲醇(分析纯)(广州市东红实业发展有限公司),三氯甲烷(分析纯)(广州化学试剂厂)。
2 实验方法
2.1 薄膜分散-超声法制备藤黄酸脂质体
精确称量磷脂酰胆碱(PC)60 mg,胆固醇(Chol)30 mg和藤黄酸提取物(GA)4 mg,置于50 mL烧杯中,滴加 15.0 mL 三氯甲烷溶解,利用旋转蒸发仪以30 ℃、0.01 MPa旋蒸成膜,速度适中,待溶剂除去后,增大真空度除去痕量氯仿。接着向烧瓶中加入处方量的磷酸缓冲盐溶液(PBS,pH=7.4)与少量玻璃珠(粒径2 mm),旋转水合5 min。之后超声10 min,即得藤黄酸脂质体。
2.2 复乳法制备藤黄酸脂质体
精确称量磷脂酰胆碱(PC)60 mg,胆固醇(Chol)30 mg和藤黄酸(GA)4 mg,乳化剂选择单硬脂酸甘油酯10 mg,15 mL三氯甲烷溶解,得到油相;将5 mL PBS溶液加入油相中,2 000 r/min下均质20 min,得到W/O型初乳。初乳旋蒸除去有机溶剂,再加入10 mL PBS水相溶液,相同条件均质15 min即得藤黄酸脂质体。
2.3 注入法制备藤黄酸脂质体
精确称量磷脂酰胆碱(PC)60 mg,胆固醇(Cho)30 mg和藤黄酸(GA)4 mg,10 mL热乙醇溶解。将油相通过针头缓慢加入100 mL PBS 缓冲液中,一边加入一边在55 ℃水浴下慢速搅拌10 min,2 h充分水合,2 000 r/min均质15 min即得藤黄酸脂质体。
2.4 以粒径为指标单因素分析
对薄膜分散法制备的藤黄酸纳米脂质体处方进行单因素考察,分析磷脂浓度、藤黄酸与磷脂质量比(药脂比)、磷脂与胆固醇质量之比(磷胆比)、水相体积对藤黄酸纳米脂质体平均粒径分布的影响。
2.5 脂质体包封率的测定方法
分别量取2 mL藤黄酸脂质体原液置于两个离心管中,向其中一組加入2 mL甲醇破乳,离心(200 000 g,30 min)后取1 mL上清液在藤黄酸最大吸收波长(360nm)减去空白(50%甲醇溶液)测吸光度,根据标准曲线计算得游离藤黄酸浓度C游。另一组离心弃去上清液,补加4mL甲醇破乳,同法测得包封藤黄酸浓度C包。则脂质体包载的藤黄酸质量与相应包封率可以计算得到。
2.6 以包封率为指标的正交试验
本文采用正交实验对藤黄酸纳米脂质各处方因素加以优化。在对比了磷脂浓度、药脂比、磷胆比、水相体积的基础上,根据实验结果,做 l12(34)的正交试验设计方案,固定搭载药物为4 mg,水平及因素条件如表1。
2.7 工艺重现性考察
对正交实验得出制备藤黄酸纳米脂质体的最佳处方组合的稳定性和可行性进行验证,按此工艺连续制备3组藤黄酸纳米脂质体,对其包封率和平均粒径分布进行检测,并计算RSD值,以此来考察优化的制备工艺的重现性。
2.8 稳定性考察
2.8.1 累积释放率
预先将透析袋、固定夹、搅拌子煮沸处理,取5 mL藤黄酸脂质体置于截留分子量为14 000 Da的透析袋中,用蒸馏水冲洗干净。将透析袋置于100 mL的蒸馏水中,其中磁力搅拌器的转速设为 300 r/min,温度为37 ℃。每隔1 h取透析液1 mL,每次取液后补充1 mL蒸馏水,共测六组。根据紫外法的测定浓度变化即得释放率。累积释放率(%)公式为:
2.8.2 长期稳定性
按上文优化方法制备脂质体样品,测定包封率,之后分成3组置于A室温,B 50 oC ,C 4 oC于0、24、48、72、96 h测定其包封率,取各采样点包封率平均值绘制包封率变化曲线。
3 实验结果
3.1 制备工艺筛选结果
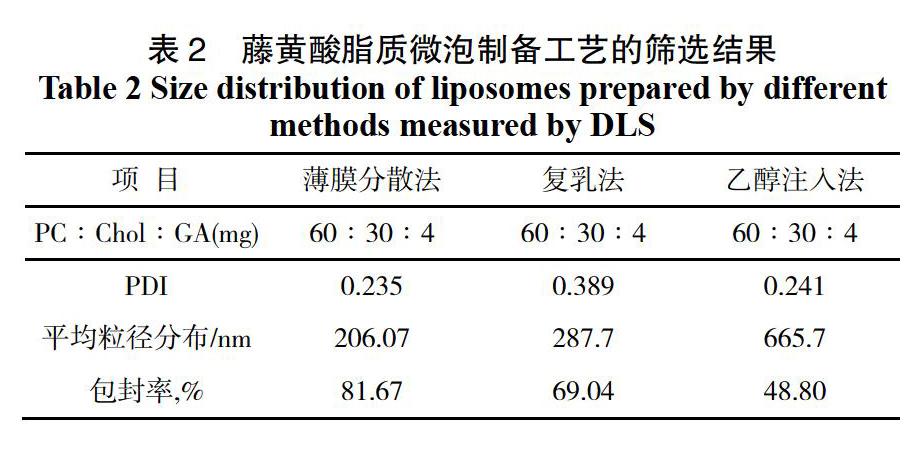
分别采用薄膜分散法,复乳法,乙醇注入法制备藤黄酸纳米脂质体后,选用超速离心法测定其包封率,并用马尔文纳米粒度分析仪动态光散射法(DLS)测定其平均粒径分布(图1),相关结果如下。
由图1与表2中结果可得,当藤黄酸纳米脂质的处方量一定时,薄膜分散法制备的脂质体包封率最高,平均粒径较小;乙醇注入法制备的脂质体,包封率也最小,平均粒径最大;因而,实验采用包封率高,工艺成熟,操作简单的薄膜分散法来制备藤黄酸纳米脂质体。
3.2 单因素粒径影响分析
对薄膜分散法制备的藤黄酸纳米脂质体处方进行单因素粒径影响分析,各因素设计为:磷脂浓度6、8、10、12、12 mg/mL;药脂比(药物:磷脂质量)1∶10、1∶15、1∶20、1∶25、1∶30;胆磷比(胆固醇/磷脂质量)1∶1、1∶2、1∶3、1∶4、1∶5;水相体积10l、15、20、25、30 mL;分组考察时,其余条件固定不变。同法测定平均粒径分布(表3)。
依顺序筛选磷脂浓度,药脂比,胆磷比和水相体积对脂质体平均粒径的影响,从各组分数据来看,药脂比对脂质体的质量影响最大,当其最优值确定为1∶15时,所得平均粒径最小。类似的,可以确定胆磷比和水相体积的最优值分别为1∶4和20 mL。
3.3 正交试验结果分析
在对比了磷脂浓度、药脂比、磷胆比、水相体积的基础上,根据实验结果,做 log34的正交试验设计方案,固定搭载药物为4 mg(表4-5)。
直观分析结果显示,各因素影响程度为C>A>B>D,其中,C即药脂比的因素对包封率影响最大,B磷脂浓度次之,C胆磷比与D水相体积对包封率影响较小。但是F检验不具备显著性。究其原因,四项因子已初选一遍,其差异性明显降低。综合以上结果,薄膜分散-超声法的最优处方工艺为A3B2C1D3,即磷脂浓度10 mg/mL,胆磷比为1∶3,药脂比为1∶10,水相体积20 mL。
3.4 工藝重现性考察
按照制备藤黄酸纳米脂质体的最佳处方组合重复制备3组藤黄酸纳米脂质体,对其包封率和平均粒径分布进行检测,并计算RSD值,考察优化的制备工艺的重现性。
表6所示,三批藤黄酸脂质微泡的包封率均大于80%,符合要求,并且包封率和平均粒径的相对标准偏差较小。说明优化的制备工艺重现性较好,稳定可靠。
3.5 稳定性考察
由表7与图2所示,累计释放率和长期稳定性表明脂质体在37 oC的环境下6 h的渗透率达到6.87% ,而冷藏长期储存下的泄露程度仅为2.67%,说明制剂具有较好的稳定性。而高温和室温的稳定性较差。
4 讨论
本章以包封率和平均粒径分布为主要评价指标,对藤黄酸脂质的制备工艺进行了筛选,并通过单因素考察和正交设计实验对其处方进行优化。
脂质体的结构主要是由制备方法所决定的。薄膜分散法制备多层脂质体,溶剂注入法制备小单层脂质体,复乳法制备多囊脂质体等。通过改变制备工艺来得到不同结构的脂质体制剂,从而起到不同的目的。
粒径作为影响纳米载药系统药动学与药物靶向性的主要因素,决定着脂质体在体内的分布与被动靶向性作用。Desai[9]等报道,纳米脂质体的透膜性随其粒径的增加而减少,粒径影响着脂质体在细胞水平上的多种作用机制,即吸附、交换、内吞、融合等。具有药用价值的脂质体粒径不能过大[10]。
藤黄酸具有亲脂性,lgP =7.6[11],在水中溶解度很小,仅为2 mg/mL。本课题主要选用薄膜分散法作为制备工艺优化的方法,所制得的藤黄酸脂质体制剂平均粒径为150~300 nm,粒径分布良好,且包封率高,长期性质稳定。因此,本文对藤黄酸纳米剂型的开发与未来体内靶向性研究具有一定意义。
参考文献:
[1]张文君,寇永强,朱鹏举. 藤黄有效成分-藤黄酸的研究进展[J]. 中国药剂 学杂志. 2013,06:121-129.
[2]陈葆仁.藤黄抗癌成分的研究Ⅰ、藤黄酸的分离和结构的鉴定[J].南昌大学学报:医学版,1980(2).
[3]Yang Y, Yang L, You Q D, et al. Differential apoptotic induction of gambogic acid, a novel anticancer natural product, on hepatoma cells and normal hepatocytes[J]. Cancer Letters, 2007, 256(2):259.
[4]Doddapaneni R, Patel K, Owaid I H, et al. Tumor neovasculature-targeted cationic PEGylated liposomes of gambogic acid for the treatment of triple-negative breast cancer[J]. Drug Delivery, 2015, 23(4):1-10.
[5]王丽莉.藤黄和双籽藤黄化学成分及抗肿瘤活性研究[D].沈阳药科大学,2008.
[6]白皎皎, 陈新棉, 曾代文, 等. 藤黄酸抗肿瘤作用机制及其纳米制剂的研究进展[J]. 华西药学杂志, 2018 (6): 24.
[7]孙庆雪,邵伟,黄桂华.脂质体制备方法的选择[J].中成药, 2010, 32 (8): 1397-1401.
[8]王佰宁. 藤黄中藤黄酸和新藤黄酸的提取分离及药理毒理研究[D]. 吉林农业大学, 2015.
[9]Desai MP, Labhasetwar V, Amidon GL, et al. Gastrointestinal uptake of biodegradable microparticles: effect of particle size[J]. Pharm Res, 1996, 13: 1838?1845.
[10]杨艳芳, 谢向阳, 杨阳,等. 粒径与表面电荷影响脂质体体内药物靶向递送的研究进展[J]. 药学学报, 2013, 48(11):1644-1650.66.
[11]Doddapaneni R, Patel K, Owaid I H, et al. Tumor neovasculature-targeted cationic PEGylated liposomes of gambogic acid for the treatment of triple-negative breast cancer[J]. Drug Delivery, 2015, 23(4):1-10.
