用于巨型脂质体制备及收集的微流控芯片研究
2015-08-13王振宇等
王振宇等
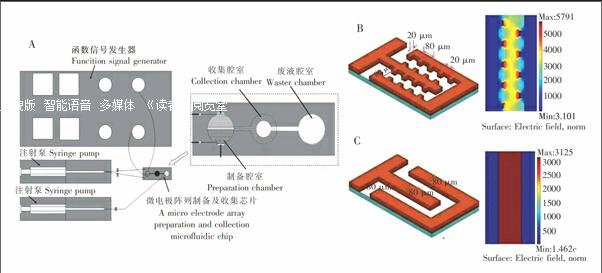
磷脂酰胆碱(1,2Diacylsnglycero3phosphocholine, PC)、胆固醇(3βHydroxy5cholestene, cholesterol, Chol)购自美国SigmaAldrich公司;乙醚、NaCl、蔗糖、葡萄糖购自中国科龙化工公司;PDMS购自美国Dow Corning公司。聚丙烯基板(2 mm厚)购自中国新涛公司;玻璃片、ITO玻璃、导电胶布购自中国珠海凯为公司。
3 结果与讨论
3.1 巨型脂质体制备
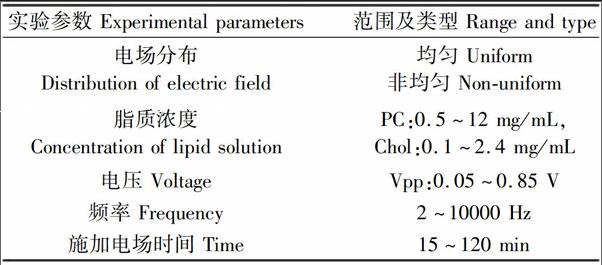
脂质膜的情况和电场参数是影响巨型脂质体电形成效果的重要因素。其中,脂质膜的形成由脂质溶液的浓度、体积、腔室的形状及尺寸等决定;电场参数涉及电场分布、电压、频率、施加时间等。在两种微电
极阵列中分别开展多种参数(脂质溶液浓度、电压、频率、施加时间,见表1)的脂质体制备实验。根据前期研究结果[14],磷脂酰胆碱(PC)和胆固醇(Chol)浓度比维持在5∶1。
将脂质溶液输入并充满两种微电极阵列所在微通道,真空干燥后,使溶剂完全蒸发形成脂质膜;注入水溶液后,在45 ℃下施加交流电场(正弦信号),观察巨型脂质体形成情况。
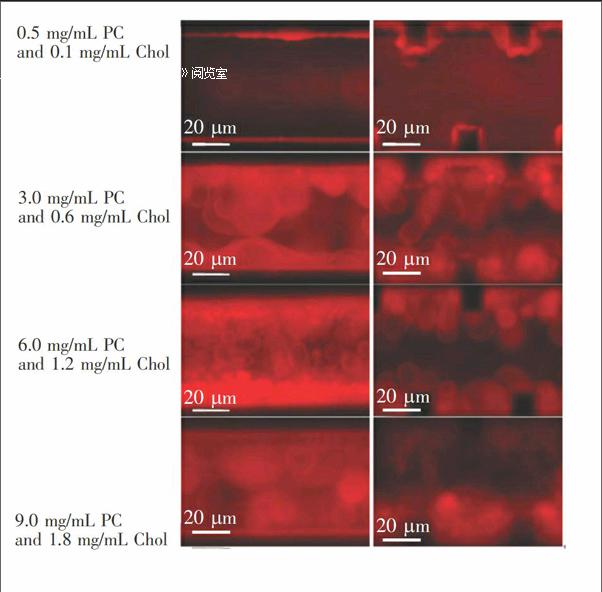
在电形成过程的最初阶段,巨型脂质体形成主要受脂质膜影响。电极附近的脂质膜较微通道中间厚,更利于巨型脂质体的形成。当脂质溶液浓度较低时(0.5 mg/mL PC和0.1 mg/mL Chol),仅电极附近的脂质膜厚度足以膨胀形成单层巨型脂质体,但是产量很低。之后,巨型脂质体的电形成产量、比率和速度脂质溶液浓度增加而递增,但其浓度超出了一个阈值(9 mg/mL PC和1.8 mg/mL Chol)后,所形成巨型脂质体互相叠加为不稳定条状结构(图2),巨型球形脂质体产量也不再增加。当PC和Chol浓度分别为6和1.2 mg/mL时,巨型球形脂质体产率较高。
在电形成过程后期,电场分布、幅值、频率、电场施加时间均对巨型脂质体的形成有影响(图3)。在电场较强区域,脂质体能更快膨胀形成。两种不同的微电极阵列中形成的巨型脂质体形状较相似,但交错电极阵列上的形成速率更快。此外,当脂质浓度逐渐增大时,在平板电极阵列中脂质体形成于整个通道,到后期边缘和中间的脂质体的膨胀会逐渐受到阻碍;而交错电极阵列上的巨型脂质体常形成在电极附近,中间位置的脂质膜就几乎不膨胀。在电场强的位置,脂质膜的膨胀速度也快于平板电极阵列,所形成巨型脂质体的形态也更好。这表明电场强度的增加有助于脂质体的快速形成。随着电场幅值的增加,脂质体膨胀形成速度增加,但由此产生的大粒径球形脂质体(粒径>50SymbolmA@ m)稳定性减弱、容易损坏,所以最终收集到的巨型脂质体比例在电压增加后并没有明显增加。在微电极阵列中,由于较小的电极间距有助于产生更大的场强,很小的电压就足以实现巨型脂质体(球形,粒径≤50SymbolmA@ m)的快速电形成,实验结果较佳的电压为0.45 V。
随着频率增加,脂质体膨胀和封闭也更快。当频率达到1000 Hz时,收集到的巨型脂质体较多,而频率继续增高时收集量没有明显的增加;电场施加时间影响巨型脂质体的膨胀和封闭,在时间远小于60 min时,巨型脂质体还较少形成,很多巨型脂质体还在膨胀过程中;当时间达到60 min后,多数巨型脂质体基本形成;进一步增加电场施加时间,产量没有明显的变化。因此,就本研究所采用的芯片制备装置,适宜的脂质浓度、电场分布、电压、频率、电场施加时间等参数分别为:磷脂酰胆碱和胆固醇浓度为6.0和1.2 mg/mL,交错电极、0.45 V,1000 Hz、60 min。此时,稳定的巨型球形脂质体的产率可以达到约60%。采用目前常用的ITO玻璃电极+PDMS垫片搭建的电形成腔室进行对照实验,在相同腔室体积、脂质用量、已报道的实验参数[15],巨型球形脂质体的产率仅为32%。
3.2 巨型脂质体收集
制备完成后,向制备腔室中缓慢注入等渗的葡萄糖、NaCl的水溶液(504SymbolmA@ L),可在一定程度上避免巨型脂质体粒径大、易形变、整体强度较差,在操作时容易破裂等问题。利用液流运动轻柔地将制备腔室里的巨型脂质体等物质输送到收集腔室。
经重力沉降和微孔滤膜过滤作用,符合要求的巨型脂质体留在收集腔室上层(图4),尺寸较小的物质则通过滤膜进入腔室下层,经微通道流入废液腔室。多次重复实验表明,在收集腔室中可以收集得到90%以上的巨型脂质体(粒径在10~50)交错微电极阵列制备的巨型脂质体收集效果优于平板微电极阵列,这也证明交错微电极阵列可以得到更多,更稳定的巨型脂质体。但仍有少部分尺寸较小的物质由于本身质量太轻,在浮力作用下仍然停留在收集腔室上层。针对这部分物质,今后可在腔室下层增加轻柔抽吸作用加以去除。
4 结 论
本研究采用了微流控芯片收集方法, 获得了更好的巨型脂质体制备效果, 并尽量多地收集所需的稳定巨型球形脂质体。通过构建两种不同微电极阵列结构,进行了多种脂质浓度、电压、频率、电场施加时间的实验研究。结果表明,交错电极对电场的聚焦作用有利于局部高电场区脂质体的膨胀形成,因此更适合巨型脂质体的制备。不同脂质浓度和电场参数对巨型脂质体的电形成有明显的影响,多参数探索表明,在微电极阵列芯片中选择磷脂酰胆碱和胆固醇浓度为6.0 mg/mL和1.2 mg/mL,电场参数为电压0.45 V、频率1000 Hz、加载时间60 min可以得到很好的制备效果。此时,稳定的巨型球形脂质体的产率可以达到60%,明显优于常规制备方法。
在制备研究基础上开展了收集芯片模块的研究,通过不同组分在收集腔室和废液腔室间的分选操作,可以在收集腔室中大量获得巨型脂质体(粒径在10~50SymbolmA@ m范围内,大多为球形、较稳定),为巨型脂质体的进一步应用奠定了良好基础。
References
1 Jesorka A, Orwar O. Ann. Rev. Anal. Chem., 2008, 1: 801-832
2 Vorselen D, Roos W H, van Loon J J W A, Wuite G J L. Biophys. J., 2013, 104 (2): 620A-620A
3 DeNardis N I, Ruzic I, PecarIlic J, El Shawish S, Ziherl P. Bioelectrochem., 2012, 88: 48-56
4 Guo B H, Cheng Y, Li N Y, Li X F, Jin M Z, Li T, Li J. J. Drug Target, 2013, 21 (3): 257-264
5 Portet T, Mauroy C, Demery V, Houles T, Escoffre J M, Dean D S, Rols M P. J. Membr. Biol., 2012, 245 (9): 555-564
6 Mikelj M, Praper T, Demic R, Hodnik V, Turk T, Anderluh G. Anal. Biochem., 2013, 435 (2): 174-180
7 Shimanouchi T, Umakoshi H, Kuboib R. J. Colloid Interface Sci., 2013, 394: 269-276
8 Natsume Y, Toyota T. Chem. Lett., 2013, 42 (3): 295-297
9 Kang Y J, Wostein H S, Majd S. Biophys. J., 2014, 106 (2): 632a
10 Tsumoto K, Nomura S M, Nakatani Y, Yoshikawa K. Langmuir, 2001, 17 (23): 7225-7228
11 Hu P C C, Li S, Malmstadt N. ACS Appl. Mater. Interfaces, 2011, 3 (5):1434-1440
12 Patil Y P, Jadhav S. Chem. Phys. Lipids, 2014, 177: 8-18
13 Mikelj M, Praper T, Demic R, Hodnik V, Turk T, Anderluh G. Anal. Biochem., 2013, 435 (2): 174-180
14 Wang Z Y, Hu N, Yeh L H, Zheng X L, Yang J, Joo S W, Qian S Z. Colloids Surf B Biointerfaces, 2013, 110: 81-87
15 Kuribayashi K, Tresset G, Coquet P, Fujita H, Takeuchi S. Meas. Sci. Technol., 2006, 17: 3121-3126
y of Education, Key Lab of Visual Damage and Regeneration & Restoration of Chongqing,
Bioengineering College, Chongqing University, Chongqing 400030, China)
3(Department of Electronic Engineering, Chongqing City Management College, Chongqing 400055, China)
Abstract A microfluidic chip with the preparation module and collection module was fabricated, in which microfluidic technology and microelectrode array were used for the preparation of giant vesicles. First, lipid solution was loaded into the microelectrode array through microchannels to form lipid film, then an electric field was subsequently loaded on the microelectrode array and the giant vesicles with a controlled diameter were formed efficiently. The ratio of the formed stable giant spherical vesicles could reach up to 60%. Giant vesicles and other materials were flushed into the upper layer of the collection chamber by microchannel. 90% of the stable giant spherical vesicles with 10-50 μm diameter could be sorted in the upper layer of the collection chamber by using micropore filter and gravity depositing. This microfluidic chip could overcome some defects existing in the current preparation method such as low efficiency, wide distribution of diameters, as well as difficult for screening and collection.
