高迁移率族蛋白B1在正常C57BL/6J小鼠耳蜗组织中的分布
2019-01-14方佳邢雅智陈衡超殷善开时海波苏开明
方佳 邢雅智 陈衡超 殷善开 时海波 苏开明
上海交通大学附属第六人民医院耳鼻咽喉头颈外科(上海200233)
上海交通大学耳鼻咽喉科研究所(上海200233)
高迁移率族蛋白B1(High mobility group box 1,HMGB1),作为一种高度保守的核内非组蛋白DNA结合蛋白,在真核细胞中表达丰富。它由215个氨基酸残基组成,其分子量约为25kDa。它能够被活化细胞主动分泌或被死亡细胞被动释放,并在细胞内外微环境中发挥重要作用[1]。HMGB1通过多种受体参与各种疾病的发生发展,尤其在晚期糖基化终产物受体(receptor for advanced glycation end-products,RAGE)和 Toll样受体家族(toll-like family of receptors,TLRs)中研究较多[2-4]。多种研究表明HMGB1参与多种疾病的发病机制,其中包括脓毒症[5,6],缺血再灌注损伤(肺、脑、脊髓、肾)[7-10],急性肝衰竭[11],急性坏死性胰腺炎[12],糖尿病[13],动脉粥样硬化[14],神经退行性疾病[15,16]以及肿瘤的发生发展中[17-19]等。HMGB1的分子信号通路尚未被完全阐明,而目前在耳科领域中HMGB1的研究较少,同时HMGB1与噪声性聋及药物性耳毒性及其他因素所致耳毒性关系也有待进一步研究。Ladrech团队分别于2013年和2017年对急性大剂量阿米卡星的耳毒性进行研究,他们初步探讨了Deiters细胞、上皮细胞、SGNs细胞通过HMGB1与不同下游信号通路在药物性耳毒性中可能发挥了重要作用[20,21]。在各种因素所致的耳毒性中不同细胞通过不同的微观分子变化参与内耳损伤的调节机制是不同的,我们猜测在生理情况下某些分子的基础水平可能存在细胞间的差异,进而在内耳疾病的发生发展中其与疾病的相关性存在差异,因此,研究HMGB1在耳蜗内的生理分布很有必要。
本研究中,我们选取4-6w听力正常的C57BL/6J小鼠为实验对象,运用全耳蜗基底膜铺片及冰冻切片,并行免疫荧光染色,观察HMGB1在Corti氏器及螺旋神经节区顶底回之间的分布情况,并定量分析HMGB1在各细胞中的差异,为研究HMGB1在内耳疾病中的作用提供基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
4-6周龄SPF级C57BL/6J小鼠10只,耳廓反应灵敏,无中耳炎及其他耳部疾病。实验动物由上海市第六人民医院实验动物中心供应。饲养环境背景噪声小于50 dB SPL。
1.1.2 实验试剂
兔单克隆抗体抗HMGB1(1∶200;Abcam);鼠单克隆抗体抗神经丝蛋白-200(NF-200)(1∶200;Sigma);鼠单克隆抗体抗SOX-2(1∶200;Abcam);羊抗鼠IgG1(y1)二抗(1∶800;Invitrogen);羊抗兔IgG二抗(1∶800;Invitrogen);罗丹明-鬼笔环肽phalloidin(1∶200;Sigma);Triton X-100(聚乙二醇辛基苯基醚;1%;Solarbio);封闭液BSA(5%;Solarbio);DAPI封片液(Sigma)。
1.2 方法
1.2.1 开放声场ABR测听
采用TDT测听设备(Tucker-Davis Technologies;美国),在隔声屏蔽室内对小鼠进行ABR阈值测试。使用氯胺酮(100 mg/kg)和赛拉嗪(15 mg/kg)的混合液对小鼠进行麻醉(腹腔注射)。进入深度麻醉后,将记录电极置于小鼠双侧耳廓前缘连线中点皮下,双侧耳后皮下分别放置参考电极及接地电极。扬声器距小鼠双耳约10 cm。刺激声采用短声(Click;给声频率21.1/s,时程0.1 ms,采样率200 kHz)和短纯音(Tone burst;给声频率21.1/s,上升/下降时间 0.5 ms,时程 10 ms,采样率 200 kHz)。ABR诱发电位经前置放大器RA16放大20倍后采集(带通滤波300~3000 Hz,叠加次数1000次,采样率25 kHz)。刺激声强度自90 dB SPL开始,以5 dB逐渐递减,直至ABR波形中III波的消失前的最后一个强度作为小鼠的听阈。
1.2.2 耳蜗基底膜铺片及耳蜗冰冻切片
动物过量麻醉后断头,取出听泡,并移至解剖显微镜下。用解剖针开放圆窗和卵圆窗,在蜗尖钻孔,并经此孔灌流4%多聚甲醛,4℃固定2 h后放入10%EDTA溶液中脱钙6-12 h。用于基底膜铺片的耳蜗,则转移至PBS溶液中,剥去其蜗壳,去除前庭膜及盖膜,切除螺旋韧带。用于冰冻切片的耳蜗则经15%、30%蔗糖,以及30%蔗糖和OCT溶液1∶1混合液梯度脱水后,将其置于OCT溶液进行包埋。在冰冻切片机中切取耳蜗中轴切片,将其迅速贴于载玻片上,室温晾干后-20℃冰箱保存。
1.2.3 免疫荧光染色
耳蜗基底膜免疫荧光染色:将分离好的基底膜置于1%Triton X-100室温中1 h后,PBS漂洗,5%BSA室温封闭1 h,加HMGB1抗体4℃摇床孵育18 h,PBS漂洗,加二抗,室温孵育2 h,PBS漂洗。加入phalloidin室温孵育20 min,PBS漂洗。载玻片上滴加DAPI后封片。
耳蜗冰冻切片免疫荧光染色:取出小鼠耳蜗切片,室温晾干,PBS溶解洗去剩余OCT,抗原修复液室温孵育半小时,1%Triton X-100室温孵育40 min,PBS漂洗,之后5%BSA室温封闭1 h,加一抗(HMGB1、SOX-2、NF-200抗体)4℃摇床孵育18 h,PBS漂洗,加二抗,室温孵育2 h,PBS漂洗。载玻片上滴加DAPI后封片。
1.2.5 图像采集及定量分析
采用激光共聚焦显微镜(Zeiss710,德国)观察并记录全耳蜗基底膜铺片及冰冻切片染色情况。利用ZEN2011(blue edition)软件分别对各区域的细胞采取荧光密度定量计数。分别选取6个不同小鼠的样本的冰冻切片共聚焦成像,然后用blue edition软件分别在每个样本各区域共选取5个不同的细胞,分别勾画出选定的Corti氏器的内毛细胞、外毛细胞和Deiter cells以及螺旋神经节区的螺旋神经节细胞和胶质细胞区域,然后用软件自带的荧光密度计算给出的HMGB1通道的荧光密度平均灰度值(Gray),最后做统计学分析。
1.2.6 统计
GraphPad Prism 5.0做图,SPSS 20.0做数据的统计学分析,统计学分析采用单因素方差分析(one-way ANOVA)及独立样本t检验(independent-samples T test),数据以平均值i标准误(xi SEM)表示,P<0.05代表差异具有统计性意义。
2 结果
HMGB1在小鼠耳蜗顶底回Corti氏器内毛细胞、外毛细胞及Deiters cells的荧光密度灰度值(x i SEM)分别为49.61i 0.97、12.14i 0.99、56.00i 4.20和50.77i 0.72、10.29i 1.39、59.70i 3.14。其中顶底回Corti氏器内毛细胞(t=0.966,P=0.340)、外毛细胞(t=0.994,P=0.327)、Deiters cells(t=0.521,P=0.606)均无统计学差异,但顶底回Corti氏器内各细胞荧光密度为Deiters cells多于内毛细胞多于外毛细胞,HMGB1的表达具有明显差异(顶回:F=92.64,P<0.01;底回:F=185.65,P<0.01)。小鼠耳蜗顶底回的螺旋神经节细胞HMGB1荧光密度分别为72.58i 5.92和73.46i 5.16,分布无明显差异(t=0.113,P=0.911),但HMGB1在螺旋神经节区胶质细胞顶底回的荧光密度分别为66.35i 4.27和78.81i 4.31,具有差异性(t=2.034,P=0.048)(图2)。顶底回螺旋神经节区内部胶质细胞与螺旋神经节细胞HMGB1分布均无明显差异(顶回:t=0.854,P=0.399;底回:t=0.795,P=0.431)
HMGB1在小鼠耳蜗内Corti氏器、螺旋神经节区及血管纹区均有表达(图2)。小鼠全耳蜗基底膜铺片各回中的HMGB1均以核内表达为主(图3)。在Corti氏器各细胞中,Deiters cells和内毛细胞HMGB1分布更多(图4)。小鼠耳蜗顶底回螺旋神经节区HMGB1主要分布于细胞核内,其中顶底回间螺旋神经节细胞无明显差异,而底回胶质细胞HMGB1的表达与顶回相比更丰富(图5)。
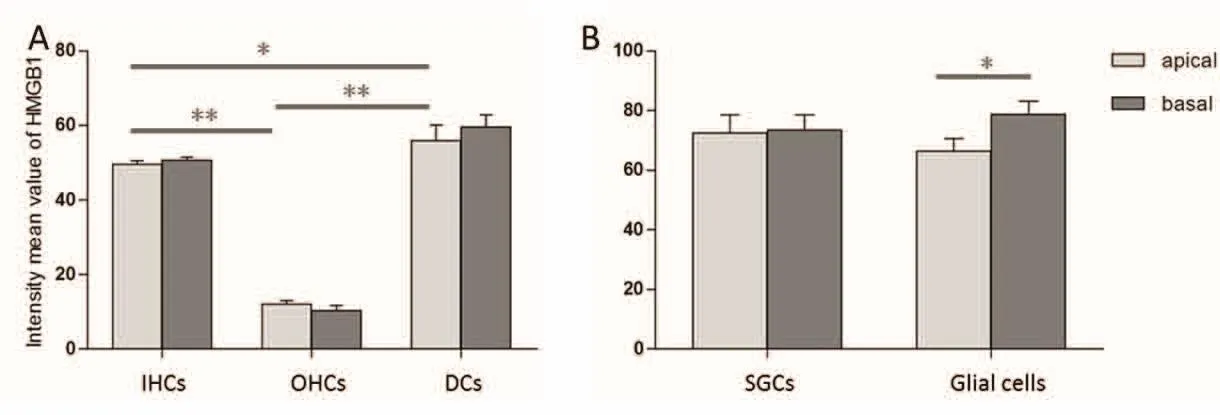
图1 HMGB1在Corti氏器和螺旋神经节区的荧光密度统计学分析。可见,耳蜗顶回和底回Corti氏器及螺旋神经节细胞HMGB1表达均无明显差异,且各回螺旋神经节区螺旋神经节细胞与胶质细胞HMGB1分布无明显差异,但顶底回Corti氏器内各细胞HMGB1的表达具有明显差异,并且顶底回胶质细胞存在显著差异。A图示顶回Corti氏器各细胞之间的统计学差异,底回Corti氏器各细胞的统计学差异同顶回,图中未标。其中*代表P < 0.05,**代表P < 0.01。Fig.1 Statistical analysis of the intensity mean value of HMGB1 in the organ of Corti and spiral ganglion area.Apparently,there has no difference between the apical and basal turn in the organ of Corti and spiral ganglion cells.Also,there has no difference between spiral ganglion cells and glial cells in apical or basal turn.However,there has a statistical difference between the Deiters cells,the inner hair cells and the outer hair cells in the organ of Corti.Besides,there has a difference between the apical and basal turn in glial cells.A shows the the statistical difference between the cells in the apial turn of the Corti's apparatus.The statistical difference between the cells in basal turn is the same as in the apical turn,and it is not marked above.Significance of one-way ANOVA and independent-samples T test,*P<0.05,**P<0.01.
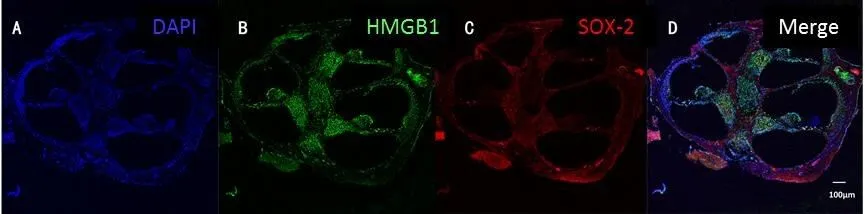
图2 低倍镜下,HMGB1在正常小鼠耳蜗中的表达分布。正常C57BL/6J小鼠耳蜗中轴切面中可见Corti氏器、螺旋神经节区及血管纹区均有HMGB1表达。A中蓝色荧光为标记细胞核DNA的DAPI,B中绿色荧光为标记HMGB1蛋白,C中红色荧光为标记支持细胞的SOX-2蛋白,D为DAPI、HMGB1和SOX-2的叠加成像。Fig.2 The distribution of HMGB1 in mouse cochlea at low magnification.HMGB1 was expressed in the organ of Corti and spiral ganglion area and stria vascularis in the axial section of the cochlea in C57BL/6J mice.A,B,C labeled with DAPI,HMGB1 and SOX-2 respectively.D represented the merged images.

图3 高倍镜下,HMGB1在正常小鼠耳蜗基底膜铺片中底回毛细胞的表达分布。正常C57BL/6J小鼠耳蜗底回基底膜的内外毛细胞均有HMGB1的表达,并且主要分布在核内。A中蓝色荧光为DAPI,B中绿色荧光为标记HMGB1,C中红色荧光为标记F-Actin微丝蛋白的Phalloidin,D为DAPI、HMGB1和Phalloidin的叠加成像。Fig.3 The expression of HMGB1 in the hair cells of basal turn in normal mice under high magnification.HMGB1 was detected in the nuclei of the inner and outer hair cells.A,B,C labeled with DAPI,HMGB1 and Phalloidin respectively.D represented the merged images.
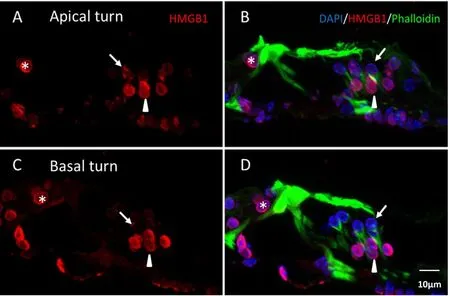
图4 HMGB1在小鼠耳蜗顶回(A和B)和底回(C和D)Corti氏器的表达分布。A和C为HMGB1。B和D分别代表DAPI、HMGB1和phalloidin叠加图像。正常小鼠Corti氏器顶底回间无明显表达差异。其中,内毛细胞(星号)和Deiters细胞(三角形)的HMGB1表达较外毛细胞(箭头)更丰富,但也主要分布于细胞核内。Fig.4 The distribution of HMGB1 in the organ of Corti.A,B was from the apical turn,and C,D was from the basal turn.A,C labeled with HMGB1.B and D represented the merged images.The expression of HMGB1 had no difference between the apical and basal turn.The HMGB1 in inner hair cells(asterisk)and Deiters cells(arrowhead)was more abundant than that in outer hair cells(arrow),mainly distributing in the nuclei.
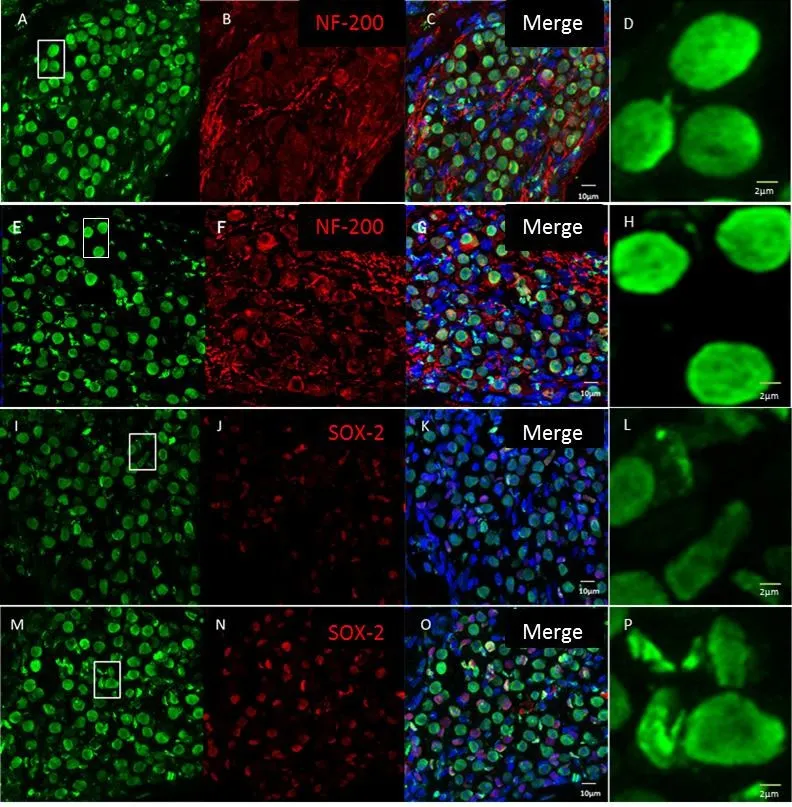
图5 HMGB1在正常小鼠耳蜗底回螺旋神经节区的表达分布。HMGB1在顶底回螺旋神经节细胞中主要分布在细胞核内(A、E),分布无明显差异。胶质细胞HMGB1(I、M)在耳蜗顶底回之间存在差异。其中D和H分别为顶回和底回螺旋神经节区螺旋神经节细胞的放大图,L和P分别为顶回和底回螺旋神经节区胶质细胞放大图。其中D、H、L、P分别为A、E、I、M中选定区域的放大图。Fig.5 The expression of HMGB1 in Rosenthal’s canal.HMGB1 mainly distributed in the nuclei of the spiral ganglion neurons(A、E represent the expression of HMGB1 in apical and basal spiral ganglion cells.There is no difference).Apparently,the HMGB1 in basal glial cells(P)was higher than that in apical turn(L).
3 讨论
HMG核蛋白家族是一组核染色质蛋白,于40年前被发现,因其在聚丙烯酰胺凝胶能快速电泳而被命名为高迁移率族[22]。这一非组蛋白、核染色质相关蛋白有相同的结构特性,主要参与到DNA的重组和转录调节中。HMGB1是HMG核蛋白家族中的一员,研究表明,HMGB1由A框、B框和C末端3个结构域构成,其中A框和B框是位于氨基端的两个DNA结合结构域,C末端是一个高度重复并富含酸性氨基酸的区域,其可参与调节HMGB1与DNA结合的亲和力[23]。在真核生物中,HMGB1位于大多数细胞的胞核和胞浆中,其中包括淋巴组织、脑、肝、肺、心、脾、肾等组织。
HMGB1具有多样的生物学效应。在正常细胞核中HMGB1主要起骨架蛋白作用,而在各种应激刺激下HMGB1则被分泌致胞质甚至胞核外,进而参与各种疾病的发生发展及转归过程中。研究表明,HMGB1既可以通过病原相关分子模式(pathogen associated molecular patterns,PAMPs)参与病原体损伤组织和细胞,同时也可以损伤相关分子模式(damage associated molecular patterns,DAMPs)参与缺氧、应激等刺激因素所致的组织和细胞损伤中[24]。HMGB1不仅可以参与早期炎症反应,亦可介导晚期炎症反应,此外它还可介导多种免疫病理,并参与特异性免疫应答反应。而多种研究又表明感音神经性聋如噪声性聋、老年性聋、突发性聋、感染性耳聋、自身免疫性内耳疾病等与局部或全身免疫反应及炎性反应密切相关,并且通过抗炎药物及免疫抑制剂可有效治疗免疫介导的感音神经性耳聋[25]。
随着在多种疾病中均发现有HMGB1的参与,HMGB1作为一个治疗靶目标的兴趣也在逐渐增加。在不同的炎症反应中有针对HMGB1的治疗包括特异性的治疗和非特异性的治疗。其中特异性的抑制剂包括抗HMGB1抗体(Anti-HMGB1 antibodies)、重组 A 盒(HMGB1 A Box)和甘草甜素(Glycyrrhizin)。而非特异性的抑制剂包括可溶性RAGE(sRAGE)、丙酮酸乙酯(Ethyl pyruvate)、血栓调节蛋白(Thrombomodulin)、抗胆碱能类药物和铂酸盐剂(Platinating agents)等。单克隆和多克隆HMGB1抗体可以直接结合HMGB1,阻断HMGB1的作用,从而抑制鼠类非甾体抗炎药(NSAID)诱导的结肠炎、出血性休克、博来霉素所致的肺纤维化等疾病[26-28]。重组A盒能对抗HMGB1的B盒,与HMGB1竞争受体的激活,可改善缺血性脑损伤的梗死范围[29]。小分子甘草甜素与HMGB1有高亲和力,可参与到包括蛛网膜下腔出血和脊髓损伤的神经保护作用中[30,31]。铂酸盐剂可抑制HMGB1从核内释放[32],使HMGB1稳定在核内,而丙酮酸乙酯和抗胆碱能药物则可阻断HMGB1释放的信号通路[33,34]。这些动物实验的探讨研究为各种疾病的临床试验及临床用药指明了新的方向。
在本研究中,C57BL/6J小鼠耳蜗内Corti氏器及螺旋神经节区均有HMGB1的表达,但其主要分布于核内,这与以往文献中报道的在其他细胞中HMGB1分布于胞核和胞质中但以胞核为主相符,故本实验中各细胞胞质中HMGB1可能是其有少量表达。目前,HMGB1在正常动物耳蜗中的表达分布情况无文献报道。在该实验中,小鼠耳蜗内Corti氏器及螺旋神经节区均有HMGB1的表达,但其在耳蜗Corti氏器各细胞中的表达存在差异,其中Deiters cells多于内毛细胞多于外毛细胞。同时,本实验还发现螺旋神经节区的胶质细胞在顶底回间存在差异。以往多种研究表明急性氨基糖苷类抗生素耳毒性主要与毛细胞凋亡相关,而慢性氨基糖苷类抗生素耳毒性主要与毛细胞坏死相关[35]。Sabine Ladrech团队研究了在阿米卡星耳毒性中HMGB1在Deiters cells胞质中大量而暂时性的表达升高从而参与Corti氏器内皮细胞重建[20],以及阿米卡星耳毒性中HMGB1可能参与到耳蜗SGNs早期存活机制中[21]。这些发现均可能与正常情况下耳蜗内细胞间的表达差异相关。并且氨基糖苷类所致的耳毒性可能与HMGB1参与凋亡坏死通路相关。因此,正常小鼠耳蜗内HMGB1的表达分布情况为HMGB1在内耳疾病中的作用机制研究提供基础。目前在多种其他疾病中HMGB1作为一个治疗靶目标已得到实验确证,目前处于临床试验阶段。因此今后我们将继续研究与探讨HMGB1及其特异性和非特异性药物在多种内耳疾病中的作用,最终为内耳疾病的临床治疗提供更广阔的选择。
